真题
名校
1 . 在恒温恒容密闭容器中充入一定量 ,发生如下反应:
,发生如下反应: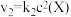 和
和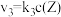 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
 ,发生如下反应:
,发生如下反应: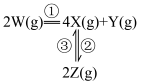
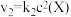 和
和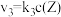 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。 | 0 | 1 | 2 | 3 | 4 | 5 |
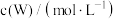 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.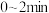 内,X的平均反应速率为 内,X的平均反应速率为 |
| B.若增大容器容积,平衡时Y的产率增大 |
C.若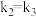 ,平衡时 ,平衡时 |
D.若升高温度,平衡时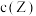 减小 减小 |
您最近一年使用:0次
2023-11-29更新
|
3268次组卷
|
5卷引用:福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题
2023·上海·模拟预测
2 . 向饱和氯水中加入少量 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是
 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是| A.溶液pH减小 | B.溶液颜色变深 | C.漂白性增强 | D.导电性减弱 |
您最近一年使用:0次
真题
名校
3 . 某小组进行实验,向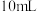 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入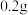 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知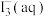 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
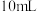 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入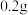 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知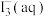 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |  在水中溶解度较小 在水中溶解度较小 |
| B | 溶液颜色加深 | 发生了反应: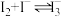 |
| C | 紫黑色晶体消失 |  ( ( )的消耗使溶解平衡 )的消耗使溶解平衡 右移 右移 |
| D | 溶液褪色 |  与有色物质发生了置换反应 与有色物质发生了置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-13更新
|
8431次组卷
|
19卷引用:福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题
福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题2023年高考辽宁卷化学真题(已下线)T13-实验方案的设计与评价(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 物质制备实验的设计与评价中国人民大学附属中学2023-2024学年高三下学期化学练习6(已下线)FHgkyldyjhx10(已下线)测试辽宁化学 请勿下载2024年中国人民大学附属中学高三下学期高考化学模拟练习试卷(六)(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷10-2023新东方高二上期中考化学湖北省鄂东新领先协作体2023-2024学年高二下学期3月联考化学试题
4 . 三元锂电池的正极材料中可含有大量的金属锂元素(LiCo1-x-yMnxNiyO2),还含有铝箔、碳和有机粘结剂等杂质。用废旧正极材料回收镍、钴、锰等金属的流程如图所示。
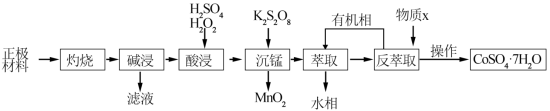
(1)灼烧的目的是_______ 。
(2)酸浸后,Ni、Co、Mn元素均以+2价形式存在。酸浸时含Co物质(以LiCoO2表示)发生反应的化学方程式为_______ 。
(3)沉锰时,需先加入适量K2S2O8,将部分Mn2+氧化成 ,沉锰时生成MnO2的离子方程式为
,沉锰时生成MnO2的离子方程式为_______ 。
(4)萃取和反萃取的过程表示为:Co2++2(HA)2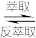 Co(HA2)2+2H+,反萃取时加入的物质X为
Co(HA2)2+2H+,反萃取时加入的物质X为_______ (填化学式),请从化学平衡的角度说明所加物质的作用_______ 。
(5)从水相回收镍时,需往混合溶液中加入氢氧化钠,以获取Ni(OH)2。常温下,为使Ni2+完全沉淀,溶液的pH至少应大于_______ (当c(Ni2+)<10-5mol/L时,视为沉淀完全,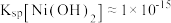 )
)
(6)CoSO4·7H2O受热时,剩余固体的物质的质量随温度变化情况如图所示,物质B的化学式为_______ 。


(1)灼烧的目的是
(2)酸浸后,Ni、Co、Mn元素均以+2价形式存在。酸浸时含Co物质(以LiCoO2表示)发生反应的化学方程式为
(3)沉锰时,需先加入适量K2S2O8,将部分Mn2+氧化成
 ,沉锰时生成MnO2的离子方程式为
,沉锰时生成MnO2的离子方程式为(4)萃取和反萃取的过程表示为:Co2++2(HA)2
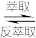 Co(HA2)2+2H+,反萃取时加入的物质X为
Co(HA2)2+2H+,反萃取时加入的物质X为(5)从水相回收镍时,需往混合溶液中加入氢氧化钠,以获取Ni(OH)2。常温下,为使Ni2+完全沉淀,溶液的pH至少应大于
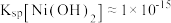 )
)(6)CoSO4·7H2O受热时,剩余固体的物质的质量随温度变化情况如图所示,物质B的化学式为

您最近一年使用:0次
解题方法
5 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
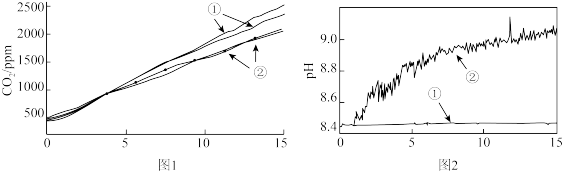
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1138次组卷
|
7卷引用:化学-2022年高考押题预测卷01(福建卷)
(已下线)化学-2022年高考押题预测卷01(福建卷)河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)
名校
解题方法
6 . 下列有关实验现象的解释或所得结论正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某补血口服液中滴加几滴酸性 溶液 溶液 | 酸性 溶液紫色褪去 溶液紫色褪去 | 该补血口服液中一定含有 |
| B | 用蒸馏水溶解 固体,并继续加水稀释 固体,并继续加水稀释 | 溶液由绿色逐渐变为蓝色 | 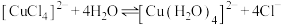 正向移动 正向移动 |
| C | 将25℃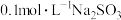 溶液加热到40℃,用传感器监测溶液pH变化 溶液加热到40℃,用传感器监测溶液pH变化 | 溶液的pH逐渐减小 | 温度升高, 水解平衡正向移动 水解平衡正向移动 |
| D | 将铜与浓硫酸反应产生的气体通入 溶液中 溶液中 | 产生白色沉淀 | 该气体中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-01更新
|
1273次组卷
|
8卷引用:福建省福州格致中学2023-2024学年高三上学期期中考试化学试题
7 . 钯催化剂(主要成分为 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的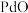 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
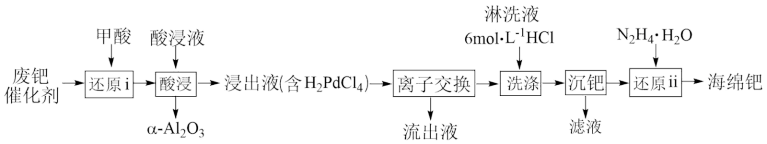
(1)“还原i”加入甲酸的目的是还原_______ (填化学式)。
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择_______ (填标号)。
A.王水(浓硝酸和浓盐酸按体积比 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
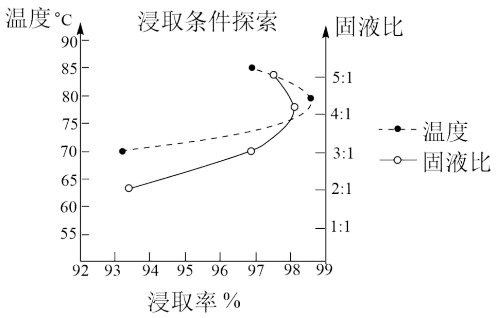
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。
①“离子交换”流出液中阳离子有 、
、_______ (填离子符号)。
②淋洗液需保持 小于2的原因是
小于2的原因是_______ 。
(4)“沉钯”过程钯元素主要发生如下转化: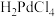 (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是_______ 。
(5)“还原ii”中产生无毒无害气体。由 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为_______ 。
(6)该工艺流程中可循环利用的物质有_______ 。
 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的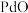 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
(1)“还原i”加入甲酸的目的是还原
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择
A.王水(浓硝酸和浓盐酸按体积比
 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为

(3)“离子交换”和“洗脱”可简单表示为:
 ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。①“离子交换”流出液中阳离子有
 、
、②淋洗液需保持
 小于2的原因是
小于2的原因是(4)“沉钯”过程钯元素主要发生如下转化:
 (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是(5)“还原ii”中产生无毒无害气体。由
 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为(6)该工艺流程中可循环利用的物质有
您最近一年使用:0次
2022-01-21更新
|
970次组卷
|
3卷引用:福建省四地市2022届高三上学期第一次质量检测化学试题
8 . 以CO2和甲醇(MeOH)为原料合成碳酸二甲酯(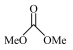 )的催化反应机理如图所示。下列说法不正确的是
)的催化反应机理如图所示。下列说法不正确的是
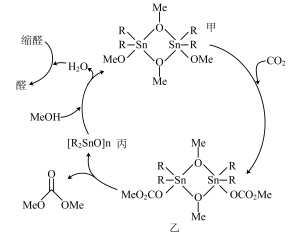
 )的催化反应机理如图所示。下列说法不正确的是
)的催化反应机理如图所示。下列说法不正确的是
A.总反应为: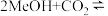 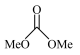 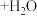 |
| B.乙是该反应的中间体 |
| C.甲→乙过程中Sn的配位数未发生改变 |
| D.加入缩醛能使总反应平衡逆向移动 |
您最近一年使用:0次



