1 . 根据实验目的设计方案并进行实验,观察到相关现象。其中方案设计或结论均正确的是
| 实验目的 | 实验方案 | 现象 | 结论 | |
| A | 检验Na2SO3固体是否变质 | 将Na2SO3固体溶于水加入少量酸性KMnO4溶液 | 最终溶液无色 | Na2SO3固体未变质 |
| B | 检验木炭与浓硫酸共热后的酸性气体 | 将木炭与浓硫酸加热反应后的气体依次通过品红溶液、澄清石灰水 | 品红溶液褪色,澄清石灰水变浑浊 | 木炭与浓硫酸加热反应后的气体中有SO2和CO2 |
| C | 探究1-溴丁烷消去后的有机产物 | 将2.0g NaOH、15mL无水乙醇、5mL 1-溴丁烷和碎瓷片共热后的气体直接通入酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 1-溴丁烷消去后有不饱和烃生成 |
| D | 探究浓度对化学平衡的影响 | 向5mL 0.005mol/L FeCl3溶液中加入5mL 0.015mol/L KSCN溶液,振荡后再加入4滴1mol/LKSCN溶液 | 溶液红色变深 | 增大反应物浓度,平衡向正方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 下列实验方案设计、现象和结论正确的是
| 选项 | 实验目的 | 方案与现象 | 结论 |
| A | 探究反应物浓度对化学平衡的影响 | 向 的 的 溶液,再滴加10滴 溶液,再滴加10滴 的 的 溶液,溶液由黄色变为橙色 溶液,溶液由黄色变为橙色 | 说明增大氢离子浓度,平衡向生成 的方向移动 的方向移动 |
| B | 探究其他离子对化学平衡的影响 | 向 溶液中加入2滴 溶液中加入2滴 溶液,产生血红色,再加入少量 溶液,产生血红色,再加入少量 溶液后血红色变浅 溶液后血红色变浅 | 说明钾离子对该平衡有一定的抑制作用 |
| C | 判断水解常数大小: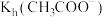 与 与 | 室温下,用 计分别测量等浓度的 计分别测量等浓度的 和 和 溶液的 溶液的 ,前者大于后者 ,前者大于后者 | 水解常数大小: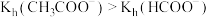 |
| D | 探究 和 和 在水溶液中的反应 在水溶液中的反应 | 向 溶液中滴加 溶液中滴加 溶液,有白色浑浊出现,并产生气体 溶液,有白色浑浊出现,并产生气体 | 说明 和 和 在相互促进水解 在相互促进水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确 的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 探究Fe和S反应特点 | 将适量硫粉和铁粉混合堆成条状。用灼热的玻璃棒触及一端,当混合物呈红热状态时,移开玻璃棒。 | 混合物继续保持红热并持续扩散,粉末呈黑色 | 该反应为放热反应 |
| B | 比较沉淀的Ksp大小 | 向相同浓度和体积的浓氨水中,分别加入等量AgCl和AgI固体,充分搅拌 | 氯化银溶解,碘化银无变化 | Ksp:AgCl>AgI |
| C | 判断平衡移动的方向 | 将装有NO2气体的注射器的活塞缓慢向外拉 | 红棕色逐渐变浅 | 可逆反应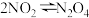 平衡正向移动 平衡正向移动 |
| D | 检验Na2S2O3样品是否含有Na2SO4杂质 | 取少量样品溶于水,先加入过量稀盐酸,过滤,向滤液中滴加少量BaCl2溶液 | 滤液中出现浑浊 | 该样品中含有Na2SO4杂质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下:
下列说法不正确 的是

下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比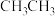 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近一年使用:0次
2024-04-10更新
|
555次组卷
|
5卷引用:2024届浙江省嘉兴市高三下学期二模化学试题
2024届浙江省嘉兴市高三下学期二模化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题04 化学反应机理 历程 能垒图分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)选择题11-16湖北省沙市中学2024届高三下学期模拟预测化学试题
5 . 硝酸盐型熔盐(含 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: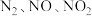 .
.
请回答:
(1)写出溶液A中的所有离子_________ ;方法Ⅱ中,“氧化吸收液”的目的是__________ .
(2)下列说法正确的是_________.
(3)方法Ⅰ中,用 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是_________ .
(4)在某温度下, 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂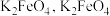 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素_________ .写出 与
与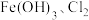 共热制取
共热制取 的化学方程式:
的化学方程式:_________ .
 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: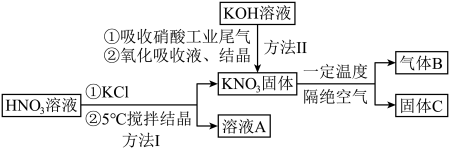
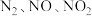 .
.请回答:
(1)写出溶液A中的所有离子
(2)下列说法正确的是_________.
A.方法Ⅰ说明:该条件下,酸性 |
B.方法Ⅱ中,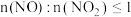 ,氮氧化物才能被足量的 ,氮氧化物才能被足量的 溶液充分吸收 溶液充分吸收 |
C. 固体与浓硫酸共热,可产生红棕色气体 固体与浓硫酸共热,可产生红棕色气体 |
| D.若气体B是一种单质,则所得固体C中不能含有三种元素 |
(3)方法Ⅰ中,用
 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是(4)在某温度下,
 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂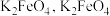 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素 与
与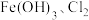 共热制取
共热制取 的化学方程式:
的化学方程式:
您最近一年使用:0次
2024-04-01更新
|
556次组卷
|
5卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
6 . 已知难溶性化合物 的化学式为
的化学式为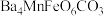 ,对
,对 进行如下实验,部分产物已经略去。
进行如下实验,部分产物已经略去。 中的金属元素在该实验条件下不能与
中的金属元素在该实验条件下不能与 产生配合物。
产生配合物。
(1) 高温下在
高温下在 气流中的反应
气流中的反应________ 氧化还原反应(填“属于”或“不属于”), 中钡元素的化合价为
中钡元素的化合价为________ 。
(2)步骤Ⅳ可以进行的原因除了生成 降低体系的能量之外,从化学平衡的角度解释能够发生的原因
降低体系的能量之外,从化学平衡的角度解释能够发生的原因________ 。
(3)下列说法正确的是________。
(4)固体 在一定条件下也可以与
在一定条件下也可以与 溶液反应,写出反应的离子方程式
溶液反应,写出反应的离子方程式________ 。
(5)设计实验检验混合气体A(除 外)的成份
外)的成份________ 。
 的化学式为
的化学式为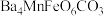 ,对
,对 进行如下实验,部分产物已经略去。
进行如下实验,部分产物已经略去。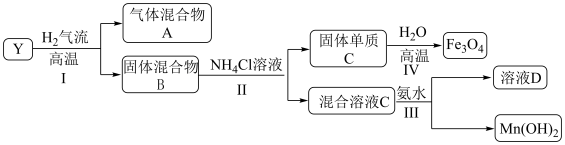
 中的金属元素在该实验条件下不能与
中的金属元素在该实验条件下不能与 产生配合物。
产生配合物。(1)
 高温下在
高温下在 气流中的反应
气流中的反应 中钡元素的化合价为
中钡元素的化合价为(2)步骤Ⅳ可以进行的原因除了生成
 降低体系的能量之外,从化学平衡的角度解释能够发生的原因
降低体系的能量之外,从化学平衡的角度解释能够发生的原因(3)下列说法正确的是________。
A.溶液D中阳离子只有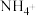 |
| B.若磁铁能吸引反应Ⅳ的剩余固体,则证明铁有剩余 |
| C.步骤Ⅱ中的氯化铵溶液也可以用盐酸代替 |
D.依据步骤Ⅲ可知碱性强弱 |
(4)固体
 在一定条件下也可以与
在一定条件下也可以与 溶液反应,写出反应的离子方程式
溶液反应,写出反应的离子方程式(5)设计实验检验混合气体A(除
 外)的成份
外)的成份
您最近一年使用:0次
解题方法
7 . 将二氧化碳转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。在催化剂作用下主要发生以下反应。
Ⅰ.

Ⅱ.
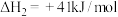
Ⅲ.

(1)反应Ⅲ自发进行的条件是______ 。
(2)恒温恒容条件下,原料气 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为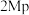 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
______ 。(对于气相反应,用组分B的平衡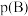 代替
代替 ,记作
,记作 。
。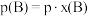 ,p为平衡压强,
,p为平衡压强,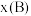 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。)
在 ,
,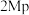 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
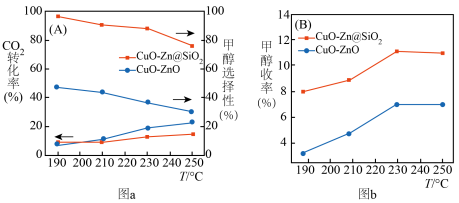
(3)分析在该压强下的最适合反应条件为______ 。
(4)推测在一定温度范围内,随着反应温度的升高, 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是______ 。
(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
(6)在 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线__________ 。
Ⅰ.


Ⅱ.

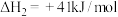
Ⅲ.


(1)反应Ⅲ自发进行的条件是
(2)恒温恒容条件下,原料气
 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为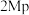 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
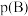 代替
代替 ,记作
,记作 。
。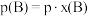 ,p为平衡压强,
,p为平衡压强,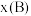 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。) 在
 ,
,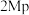 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
(3)分析在该压强下的最适合反应条件为
(4)推测在一定温度范围内,随着反应温度的升高,
 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
A. 催化剂中 催化剂中 抑制了 抑制了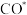 的解吸附,从而抑制 的解吸附,从而抑制 的生成。 的生成。 |
B. 催化剂上主要通过甲酸盐路径加氢生成甲醇。 催化剂上主要通过甲酸盐路径加氢生成甲醇。 |
| C.增大流速,原料气与催化剂碰撞机会多,甲醇产率一定增加。 |
D.随着温度升高,有利于 在催化剂表面反应,平衡转化率增大。 在催化剂表面反应,平衡转化率增大。 |
(6)在
 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
您最近一年使用:0次
8 .  是一种重要的盐,其水溶液中存在平衡:
是一种重要的盐,其水溶液中存在平衡: 。下列说法
。下列说法不正确 的是
 是一种重要的盐,其水溶液中存在平衡:
是一种重要的盐,其水溶液中存在平衡: 。下列说法
。下列说法A. 溶液中加入淀粉溶液,溶液显蓝色 溶液中加入淀粉溶液,溶液显蓝色 |
B. 溶液呈棕褐色溶液,加入 溶液呈棕褐色溶液,加入 后,振荡,上层溶液显紫红色 后,振荡,上层溶液显紫红色 |
C. 溶液中滴加少量 溶液中滴加少量 溶液,溶液酸性增强 溶液,溶液酸性增强 |
D.利用 溶液可以除去硫粉中的少量碘单质 溶液可以除去硫粉中的少量碘单质 |
您最近一年使用:0次
名校
解题方法
9 . 丙烯是一种重要的化工原料,在催化剂作用下,可以由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):

反应Ⅱ(氧化脱氢):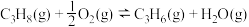

反应Ⅲ(氢气燃烧):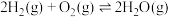
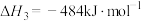
(1)
_____ kJ/mol。
(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1
①结合图1,从平衡移动的角度分析,“通入Ar”的作用是_____ 。
②若要将 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
_____ 。
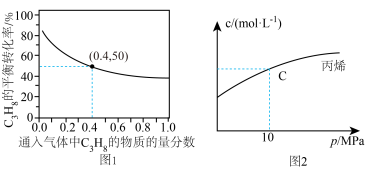
(3)恒温条件下,测得反应Ⅰ平衡时 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时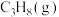 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线_____ 。(在图中C点平衡总压为10Mpa时,丙烷和丙烯的物质的浓度相等)。
(4)①关于反应Ⅲ,下列说法正确的是_____ 。
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高 的转化率
的转化率
②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是_____ 。
(5)研究表明, 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
下列说法不正确的是_____。
反应Ⅰ(直接脱氢):


反应Ⅱ(氧化脱氢):
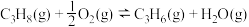

反应Ⅲ(氢气燃烧):
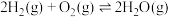
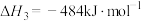
(1)

(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入
 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1①结合图1,从平衡移动的角度分析,“通入Ar”的作用是
②若要将
 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
(3)恒温条件下,测得反应Ⅰ平衡时
 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时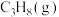 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线(4)①关于反应Ⅲ,下列说法正确的是
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高
 的转化率
的转化率②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是
(5)研究表明,
 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:| t℃ | 丙烷转化率 | 产物的选择性 | ||
 |  | CO | ||
| 400 | 4.06 | 93.12 | 2.20 | 4.68 |
| 500 | 12.32 | 91.23 | 3.16 | 5.61 |
| 600 | 35.22 | 85.44 | 7.73 | 6.83 |
| A.在较高温度下,催化剂X可提高产生丙烯反应的速率 |
B. 催化氧化 催化氧化 脱氢制丙烯的反应是放热反应 脱氢制丙烯的反应是放热反应 |
| C.相同条件下,使用不同的催化剂,丙烷的平衡转化率相同 |
| D.温度升高,催化剂X的活性下降,丙烯的产率降低 |
您最近一年使用:0次
2023-12-05更新
|
223次组卷
|
4卷引用:浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题
浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题(已下线)专题10 化学反应原理综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省宁波市2023-2024学年高二上学期九校联考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期1月期末化学试题
10 . 某兴趣小组用淀粉水解液和浓 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: (
( 作催化剂)。
作催化剂)。
请回答:
(1)图1装置中仪器乙的名称___________ 。若C烧杯中盛放足量氢氧化钠溶液,写出C中发生反应的离子方程式___________ (假设气体全部被吸收),除了氢氧化钠溶液,还可以选用___________ (至少写出两种溶液)。
(2)下列有关操作说法不正确 的是___________。
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释___________ 。
(4)草酸晶体 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:___________
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值___________ (填“偏大”“偏小”“无影响”)。
 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):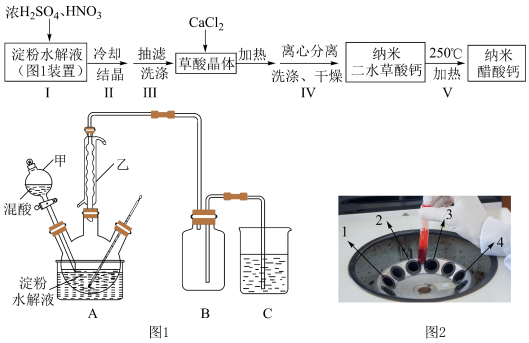
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 (
( 作催化剂)。
作催化剂)。请回答:
(1)图1装置中仪器乙的名称
(2)下列有关操作说法
| A.步骤Ⅱ采取冷却结晶,以防止草酸晶体失水 |
| B.步骤Ⅲ洗涤可用乙醇水溶液,步骤IV洗涤可用蒸馏水洗涤 |
C.步骤Ⅴ采用 加热,为提高反应速率,也可采用更高温度加热 加热,为提高反应速率,也可采用更高温度加热 |
| D.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释
(4)草酸晶体
 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线
 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述
 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值
您最近一年使用:0次
2023-10-09更新
|
214次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题09 化学实验综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)T20-实验综合题



