解题方法
1 . 合成氨工业中将 分离后的原料气循环使用的主要目的是
分离后的原料气循环使用的主要目的是
 分离后的原料气循环使用的主要目的是
分离后的原料气循环使用的主要目的是A.降低 的沸点 的沸点 | B.提高 和 和 的利用率 的利用率 |
| C.增大合成氨反应的速率 | D.提高平衡混合物中 的含量 的含量 |
您最近一年使用:0次
2 . 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
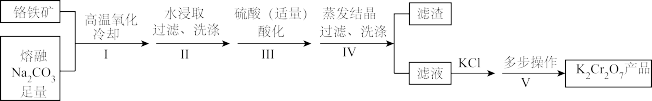
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
 Cr2O
Cr2O +H2O
+H2O
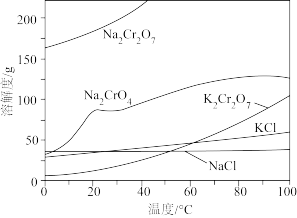
相关物质的溶解度随温度变化如下图。
请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是______ 。
(2)下列说法正确的是______ 。
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →______ →______ →______ →______ →重结晶。
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是______ 。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,______ 继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是______ ,添加该试剂的理由是______ 。
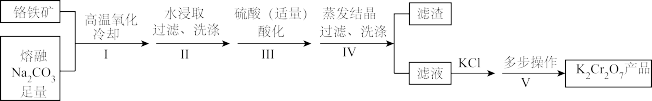
已知:4Fe (CrO2)2 + 10Na2CO3+7O2
 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO22H++2CrO

 Cr2O
Cr2O +H2O
+H2O相关物质的溶解度随温度变化如下图。

请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是
(2)下列说法正确的是
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是
您最近一年使用:0次
2021-01-09更新
|
8539次组卷
|
16卷引用:天津市天津一中2020-2021学年高三第二学期五月月考化学试题
天津市天津一中2020-2021学年高三第二学期五月月考化学试题天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题2021年1月新高考浙江化学高考真题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年1月浙江高考化学试题变式题26-31(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题27 化学工艺流程题-----物质的分离与提纯-备战2023年高考化学一轮复习考点微专题浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
3 . t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g)+ xB(g) ⇌C(g),4min时反应达到平衡状态(温度不变),剩余0.4mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)x_________ 。
(2)用A表示该反应的速率为_________ mol/(L·min)。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是_________ (填写选项字母符号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为_________ 反应(填“吸热”或“放热“),且m+n_________ p(填“>” “=”或“<”)。
②减压使容器体积增大时,A的质量分数_________ 。(填“增大少”“减小”或“不变”,下同)
③若加入B(维持体积不变),则A的转化率_________ 。
④若升高温度,则平衡时B、C的浓度之比将_________ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量_________ 。
(1)x
(2)用A表示该反应的速率为
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为
②减压使容器体积增大时,A的质量分数
③若加入B(维持体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比将
⑤若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
名校
解题方法
4 . (1)在密闭容器中,一定量混合气体发生下列反应:aM(g)+bN(g)⇌cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则N的转化率_______ (填变大,变小或不变)
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是_______
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)向相同容积的甲、乙两容器中都分别充入1 mol SO2和0.5 mol O2,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是_______
A.平衡时,容器内的压强:甲>乙
B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙
D.平衡时,容器内SO3的体积百分数:甲>乙
(4)下列说法正确的是_______
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)向相同容积的甲、乙两容器中都分别充入1 mol SO2和0.5 mol O2,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是
A.平衡时,容器内的压强:甲>乙
B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙
D.平衡时,容器内SO3的体积百分数:甲>乙
(4)下列说法正确的是
| A | B | C | D |
 |  |  |  |
| 绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)⇌2C(g),如图为其正反应速率随时间变化的示意图,则该反应为放热反应 | 催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。如图显示的是催化反应与无催化反应过程中的能量关系 | 将BaO2放入密闭真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图所示 | 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)⇌N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).则c点与a点相比,c(NO2)增大,c(N2O4)减小 |
您最近一年使用:0次
名校
5 . 一定条件下,在密闭容器里进行如下可逆反应: 橙黄色液体
橙黄色液体 气
气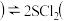 鲜红色液体
鲜红色液体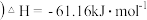 。下列说法正确的是
。下列说法正确的是

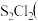 橙黄色液体
橙黄色液体 气
气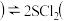 鲜红色液体
鲜红色液体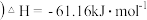 。下列说法正确的是
。下列说法正确的是

A.达到平衡时,单位时间里消耗n mol  的同时也生成n 的同时也生成n 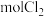 |
| B.增大压强,平衡常数将增大 |
| C.达到平衡时,若升高温度,氯气的百分含量减小 |
| D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |
您最近一年使用:0次
2019-05-05更新
|
246次组卷
|
7卷引用:2015届天津市静海县第一中学高三上学期期末考试化学试卷
2015届天津市静海县第一中学高三上学期期末考试化学试卷2015-2016学年天津市静海一中高二下开学考试化学试卷(已下线)二轮复习 专题9 化学反应速率与化学平衡 押题专练【校级联考】福建省晋江市(安溪一中、养正中学、惠安一中、泉州实验中学四校)2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(押题专练)福建省福清市华侨中学2018-2019学年高二下学期期中考试化学试题福建省福建师范大学附属中学2019-2020学年高二上学期期中考试化学(选考)试题



