名校
解题方法
1 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
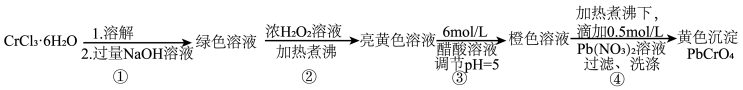
回答下列问题:
(1)已知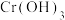 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用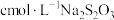 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
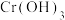 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用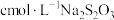 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近一年使用:0次
2022-08-30更新
|
242次组卷
|
2卷引用:四川省成都市第七中学2023届高三上学期入学考试化学试题
2 . 由 -羟基丁酸
-羟基丁酸 生成
生成 -丁内酯的反应如下:
-丁内酯的反应如下: 时,水溶液中
时,水溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为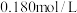 ,随着反应的进行,测得
,随着反应的进行,测得 -丁内酯的浓度随时间的变化如下表所示:
-丁内酯的浓度随时间的变化如下表所示:
下列说法不正确的是
 -羟基丁酸
-羟基丁酸 生成
生成 -丁内酯的反应如下:
-丁内酯的反应如下: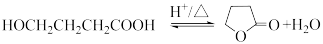
 时,水溶液中
时,水溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为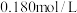 ,随着反应的进行,测得
,随着反应的进行,测得 -丁内酯的浓度随时间的变化如下表所示:
-丁内酯的浓度随时间的变化如下表所示: | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
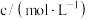 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
A.在50~80 内,以 内,以 -丁内酯的浓度变化表示的反应速率为 -丁内酯的浓度变化表示的反应速率为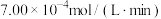 |
B.在 时,该反应的平衡常数 时,该反应的平衡常数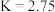 |
C.若将 -羟基丁酸的初始浓度降低,体系中水含量增多,平衡逆向移动, -羟基丁酸的初始浓度降低,体系中水含量增多,平衡逆向移动, -羟基丁酸的平衡转化率减小 -羟基丁酸的平衡转化率减小 |
D.将反应溶剂更换为非水溶剂并通过共沸回流的方式移除体系中的水分,有助于提高 -丁内酯的平衡产率 -丁内酯的平衡产率 |
您最近一年使用:0次
名校
解题方法
3 . 合成氨工业中采用循环操作,主要是为了
| A.增大化学反应速率 | B.提高平衡混合物中氨的含量 |
| C.降低氨的沸点 | D.提高氮气和氢气的利用率 |
您最近一年使用:0次
2023-06-30更新
|
504次组卷
|
16卷引用:四川省遂宁市射洪中学校2023-2024学年高二上学期11月期中化学试题
四川省遂宁市射洪中学校2023-2024学年高二上学期11月期中化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷山西省怀仁市2021-2022学年高二上学期期中化学试题人教2019版选择性必修一第二章 第四节 化学反应的调控 课后习题河北省石家庄市2021-2022学年高二上学期期末考试化学试题(已下线)2.4 化学反应的调控-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题 广东实验中学越秀学校2023-2024学年高二上学期期中考试化学试题青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题贵州神贵阳市2023-2024学年清镇市博雅实验学校高二上学期第四次月考化学试卷
解题方法
4 . 在密闭容器中进行如下反应: ,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
(1)增加C的含量,平衡____________ ,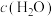
___________ .
(2)保持反应容器体积和温度不变,通入 ,平衡
,平衡____________ ,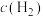
____________ .
(3)在一定温度下,缩小反应容器体积,平衡向____________ 方向移动,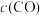
___________ , 的转化率
的转化率
______________ 。
(4)保持反应容器体积不变,升高温度,平衡向_________ 方向移动,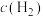
___________ .
(5)保持反应容器体积和温度不变,再通入 ,平衡向
,平衡向__________ 方向移动, 的转化率
的转化率
_________ ,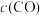
___________ 。
 ,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。(1)增加C的含量,平衡
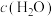
(2)保持反应容器体积和温度不变,通入
 ,平衡
,平衡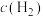
(3)在一定温度下,缩小反应容器体积,平衡向
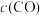
 的转化率
的转化率
(4)保持反应容器体积不变,升高温度,平衡向
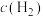
(5)保持反应容器体积和温度不变,再通入
 ,平衡向
,平衡向 的转化率
的转化率
您最近一年使用:0次
5 . 在密闭容器中进行如下反应
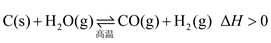
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡____________ ,c(H2O)___________ 。
(2)保持反应容器体积和温度不变,通入He,平衡____________ ,c(H2)____________ 。
(3)在一定温度下,缩小反应容器体积,平衡向____________ 方向移动,c(CO)___________ ,H2O(g)的转化率
______________ 。
(4)保持反应容器体积不变,升高温度,平衡向_________ 方向移动,c(H2)___________ 。
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向__________ 方向移动,H2O(g)的转化率
_________ ,c(CO)___________ 。
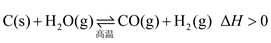
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡
(2)保持反应容器体积和温度不变,通入He,平衡
(3)在一定温度下,缩小反应容器体积,平衡向

(4)保持反应容器体积不变,升高温度,平衡向
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向

您最近一年使用:0次
2021-11-07更新
|
313次组卷
|
2卷引用:四川省成都市蓉城名校联盟2021-2022学年高二上学期期中联考化学试题
解题方法
6 . 铅在有色金属产量中居第四位,全世界消费的铅中大约有80%~85%用于铅蓄电池,下面是废铅蓄电池预处理获得的铅膏回收制取PbCl2的工艺流程:

已知:①铅膏含铅组成表:
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
③已知浸取时PbSO4可溶于盐酸与食盐水混合溶液生成 。
。
回答下列问题:
(1)铅膏浸取前通常需要研磨,目的是_______ 。
(2)“浸取”过程会产生混合气体,其成分是_______ 和少量Cl2,写出PbO2氧化盐酸产生Cl2的化学方程式_______ 。
(3)25℃时PbCl2固体在浓盐酸中存在平衡:PbCl2(s)+2Cl-(aq)
 (aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是
(aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是_______ 。
(4)铅膏浸取时,浓盐酸与水配比(浓盐酸与水的体积比)对铅浸出率的影响如下图1,温度对铅浸出率的影响如下图2。

①浸取时,最合理的浓盐酸与水配比和温度分别是:_______ ,_______ 。
②低于70℃时,随温度升高铅浸出率增大的原因可能是(写一点):_______ 。
(5)提高铅回收率,可将IV步滤液补加一定量盐酸后循环用于铅膏浸取,重复循环实验,所得结果如下:
循环实验铅浸出率、铅回收率及氯化铅纯度表
循环4次后产品PbCl2的纯度骤降,增加的杂质主要是钠盐(填化学式):_______ 。为了恢复PbCl2的纯度,可以在IV步滤液中加入CaCl2使杂质离子沉淀后再进行循环操作,请用离子方程式表示其除杂原理:_______ 。

已知:①铅膏含铅组成表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 含量/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
③已知浸取时PbSO4可溶于盐酸与食盐水混合溶液生成
 。
。回答下列问题:
(1)铅膏浸取前通常需要研磨,目的是
(2)“浸取”过程会产生混合气体,其成分是
(3)25℃时PbCl2固体在浓盐酸中存在平衡:PbCl2(s)+2Cl-(aq)

 (aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是
(aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是(4)铅膏浸取时,浓盐酸与水配比(浓盐酸与水的体积比)对铅浸出率的影响如下图1,温度对铅浸出率的影响如下图2。

①浸取时,最合理的浓盐酸与水配比和温度分别是:
②低于70℃时,随温度升高铅浸出率增大的原因可能是(写一点):
(5)提高铅回收率,可将IV步滤液补加一定量盐酸后循环用于铅膏浸取,重复循环实验,所得结果如下:
循环实验铅浸出率、铅回收率及氯化铅纯度表
| 循环次数 | 0 | 1 | 2 | 3 | 4 |
| 铅浸出率/% | 99.5 | 99.5 | 99.4 | 99.5 | 99. 3 |
| 铅回收率/% | 85.4 | 93.5 | 95.8 | 97.1 | 98.2 |
| 氯化铅纯度/% | 99.4 | 99.3 | 99.2 | 99.1 | 96.1 |
您最近一年使用:0次
7 . 一定温度下,某气态平衡体系的平衡常数表达式为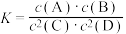 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
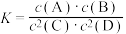 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是A.升高温度,平衡常数 一定增大 一定增大 | B.增大 浓度,平衡向正反应方向移动 浓度,平衡向正反应方向移动 |
C.增大压强, 体积分数增加 体积分数增加 | D.升高温度,若 的百分含量减少,则正反应是放热反应 的百分含量减少,则正反应是放热反应 |
您最近一年使用:0次
2021-10-15更新
|
134次组卷
|
3卷引用:四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题
四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题山东省烟台市招远市第二中学2021-2022学年高二10月月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)
名校
8 . 在一密闭容器中,放入镍粉并充入一定量的 CO 气体,一定条件下发生可逆反应 Ni(s)+4CO(g) Ni(CO)4(g),已知该反应在 25℃、80℃时的平衡常数分别为 5×104 和 2,下列说法正确的是
Ni(CO)4(g),已知该反应在 25℃、80℃时的平衡常数分别为 5×104 和 2,下列说法正确的是
 Ni(CO)4(g),已知该反应在 25℃、80℃时的平衡常数分别为 5×104 和 2,下列说法正确的是
Ni(CO)4(g),已知该反应在 25℃、80℃时的平衡常数分别为 5×104 和 2,下列说法正确的是| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.80℃时,测得某时刻 Ni(CO)4(g)、CO(g)浓度均为 0.5 mol·L-1,则此时 v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.恒温恒容下,向容器中再加入少量的 Ni(s),CO 的百分含量将增大 |
您最近一年使用:0次
名校
解题方法
9 . 合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:
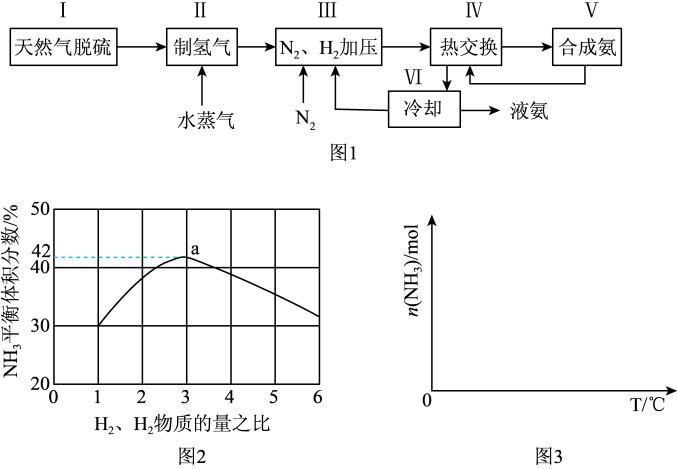
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___ 。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___ 。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___ 。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___ 。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___ (填序号),简述本流程中提高合成氨原料总转化率的方法:___ 。
一种工业合成氨的简易流程图如图:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是
您最近一年使用:0次
2020-01-07更新
|
113次组卷
|
4卷引用:2016-2017学年四川省成都市树德中学高二10月阶段性考试化学试卷
名校
解题方法
10 . 对于可逆反应2A(?)+B(g) 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:

(1)物质A的状态是_________ (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是_____ ;
(3)v(a)、v(b)、v(c)按由大到小排序_________________ ;
(4)对于2SO2(g)+O2(g) 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是___________ ;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率__________ (填“会”或“不会”)。
 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是
(3)v(a)、v(b)、v(c)按由大到小排序
(4)对于2SO2(g)+O2(g)
 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
您最近一年使用:0次



