解题方法
1 . 某铜矿酸性废水除去不溶性固体杂质后,仍含有c(H+)=0.1mol•L-1,c(Cu2+)=0.05mol•L-1,需净化处理。
已知:①含铜污水的排放标准为pH=7,c(Cu2+)≤1×10-7mol•L-1。
②Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=6.4×10-36,Ksp(FeS)=6.3×10-18;Kb(NH3•H2O)=1.7×10-25,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15。
(1)中和沉淀法处理。
①向酸性废水中加入氨水,调节pH,溶液中铜的去除率与pH关系如图所示。则pH由7到10时,铜的去除率下降的主要原因为_______ (用离子方程式表示)。

②若加入石灰乳处理废水,结合计算判断生成氢氧化铜沉淀能否达到排放标准______ (写出计算过程)。
(2)硫化物沉淀法处理。
①加入Na2S处理废水,pH=7时,Na2S溶液中硫元素的主要存在的微粒为_______ 。
②用FeS处理含铜废水比Na2S效果好。请通过必要的计算和说明采用FeS处理的优点的原因______ 。
(3)溶剂萃取法。用萃取剂RH可萃取废水中的铜离子,再加入20%的硫酸进行反萃取。
①实验室进行萃取操作时,振荡静置后,需对分液漏斗放气,正确放气的图示为_______ (填标号)。
A.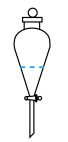 B.
B. 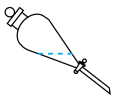 C.
C.
②萃取时,适度增大溶液的pH,Cu2+萃取率升高的原因是_______ 。
(4)实验中需测定废液中铜离子含量。
已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O =2I-+S4O
=2I-+S4O 。
。
请运用上述原理完成测定某弱酸性溶液中铜离子含量的实验方案:量取25.00mL废水于锥形瓶中,_______ (实验中须使用的试剂:0.1mol•L-1KI溶液、0.05000mol•L-1Na2S2O3标准溶液、0.5%淀粉溶液)。
已知:①含铜污水的排放标准为pH=7,c(Cu2+)≤1×10-7mol•L-1。
②Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=6.4×10-36,Ksp(FeS)=6.3×10-18;Kb(NH3•H2O)=1.7×10-25,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15。
(1)中和沉淀法处理。
①向酸性废水中加入氨水,调节pH,溶液中铜的去除率与pH关系如图所示。则pH由7到10时,铜的去除率下降的主要原因为

②若加入石灰乳处理废水,结合计算判断生成氢氧化铜沉淀能否达到排放标准
(2)硫化物沉淀法处理。
①加入Na2S处理废水,pH=7时,Na2S溶液中硫元素的主要存在的微粒为
②用FeS处理含铜废水比Na2S效果好。请通过必要的计算和说明采用FeS处理的优点的原因
(3)溶剂萃取法。用萃取剂RH可萃取废水中的铜离子,再加入20%的硫酸进行反萃取。
①实验室进行萃取操作时,振荡静置后,需对分液漏斗放气,正确放气的图示为
A.
 B.
B.  C.
C.
②萃取时,适度增大溶液的pH,Cu2+萃取率升高的原因是
(4)实验中需测定废液中铜离子含量。
已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。请运用上述原理完成测定某弱酸性溶液中铜离子含量的实验方案:量取25.00mL废水于锥形瓶中,
您最近一年使用:0次
2 . 许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(1)亚氯酸钠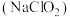 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
溶液中存在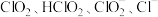 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
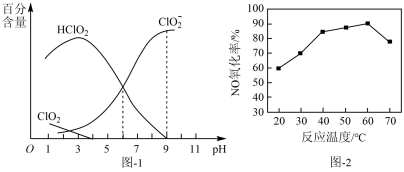
①25℃时,
_______  。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,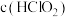
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②酸性条件下,NaClO2能将烟气中的NO氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
③温度高于60℃时,NO氧化率下降,其原因是_______ 。
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当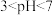 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是_______ 。
②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是_______ 。
(1)亚氯酸钠
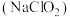 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
溶液中存在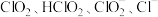 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
①25℃时,

 。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,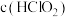
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②酸性条件下,NaClO2能将烟气中的NO氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为③温度高于60℃时,NO氧化率下降,其原因是
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当
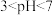 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是
您最近一年使用:0次
解题方法
3 . 金属铬坚硬,耐腐蚀,可做镀层金属,并且在制皮革,羊毛,火柴,颜料等方面均有其应用。但是Cr(Ⅵ)致癌,因此国家对废水中Cr含量有严格的排放标准。已知: Ksp[Cr(OH)3]= 1 ×10-32。
(1)基态Cr原子外围电子排布式为_______ 。
(2)还原法
①可以选择焦亚硫酸钠或硫代硫酸钠(Na2S2O3在酸性条件下分解为HSO 、SO
、SO )处理含铬(VI)废水,处理费用低。其工艺流程如图:
)处理含铬(VI)废水,处理费用低。其工艺流程如图:

反应池中发生反应的离子方程式_______ 。
②Cr2O 在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是
在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是 _______ 。
③室温下,加入石灰乳调节pH,当Cr3+完全沉淀时[c(Cr3+)≤1 ×10-6mol/L],溶液pH范围是_______ 。
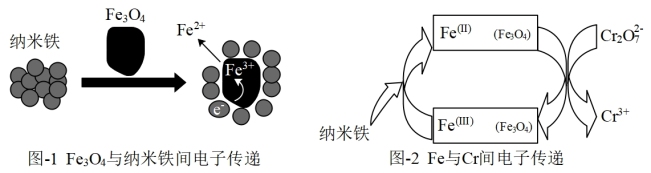
(3)Fe3O4/纳米Fe去除法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的Cr2O 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
(ii)依据如下两个图示信息,上述实验3降解Cr2O 效率增大的原因是
效率增大的原因是 _______ 。
(1)基态Cr原子外围电子排布式为
(2)还原法
①可以选择焦亚硫酸钠或硫代硫酸钠(Na2S2O3在酸性条件下分解为HSO
 、SO
、SO )处理含铬(VI)废水,处理费用低。其工艺流程如图:
)处理含铬(VI)废水,处理费用低。其工艺流程如图:
反应池中发生反应的离子方程式
②Cr2O
 在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是
在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是 ③室温下,加入石灰乳调节pH,当Cr3+完全沉淀时[c(Cr3+)≤1 ×10-6mol/L],溶液pH范围是
(3)Fe3O4/纳米Fe去除法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的Cr2O
 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。| 实验编号 | 纳米 Fe(g/L) | Fe3O4(g/L) | Cr2O 实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 51.4% |
| 2 | 0 | 2 | 7.12% |
| 3 | 0.05 | 2 | 86.67% |
 效率增大的原因是
效率增大的原因是 
您最近一年使用:0次
4 . 国家规定,排放的废水中氟的含量不得超过10.0mg·L-1,砷的含量不得超过0.5mg·L-1。硫酸工厂废水中除含有稀硫酸外,还含有H3AsO3、H2SiF6等物质。工业上常通过化学沉淀和氧化、吸附沉降处理废水,实现水体达标排放。
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主]、过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO3)2。
①CaSO4中阴离子的空间构型为____ 。
②写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:____ 。
③充分沉淀后测得废水中F-的含量为19.0mg·L-1,此时SO 的浓度为
的浓度为____ mol·L-1。[已知:Ksp(CaSO4)=5.0×10-5、Ksp(CaF2)=5.0×10-9]
(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。已知:
ⅰ.NaClO能将As(III)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ⅱ.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
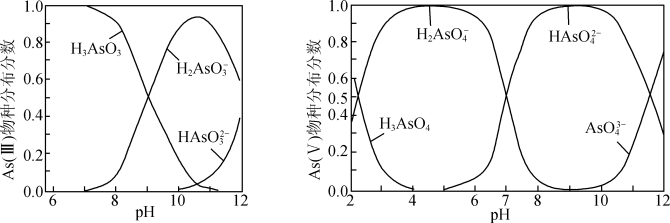
①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:____ 。
②其他条件相同的情况下,用以下两种方式向废水样中添加NaClO和FeSO4溶液。方式I:先加NaClO溶液,再加FeSO4溶液;方式II:先加FeSO4溶液,再加NaClO溶液。反应相同时间,测得As(III)的氧化效果方式II不如方式I,原因是____
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主]、过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO3)2。
①CaSO4中阴离子的空间构型为
②写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:
③充分沉淀后测得废水中F-的含量为19.0mg·L-1,此时SO
 的浓度为
的浓度为(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。已知:
ⅰ.NaClO能将As(III)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ⅱ.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:
②其他条件相同的情况下,用以下两种方式向废水样中添加NaClO和FeSO4溶液。方式I:先加NaClO溶液,再加FeSO4溶液;方式II:先加FeSO4溶液,再加NaClO溶液。反应相同时间,测得As(III)的氧化效果方式II不如方式I,原因是
您最近一年使用:0次
2022·河北石家庄·一模
解题方法
5 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
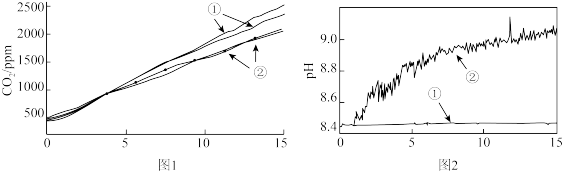
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1138次组卷
|
7卷引用:押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)
名校
解题方法
6 . 钴是元素周期表第四周期第Ⅷ族元素,其化合物用途广泛。如: 作锂电池的正极材料。
作锂电池的正极材料。
I.(1)基态Co原子的价层电子排布式为_______ 。
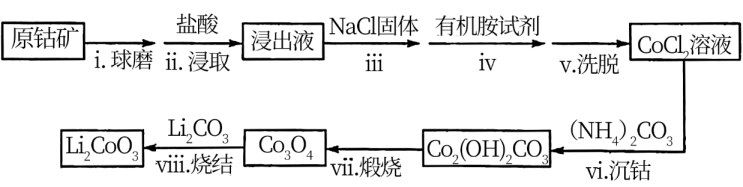
II.利用原钴矿 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
资料:①在含一定量 的溶液中:
的溶液中: 。
。
②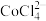 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
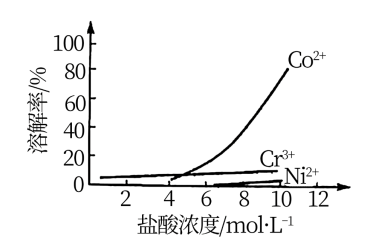
(2)步骤i的目的是_______ 。
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:_______ 。
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是_______ 。
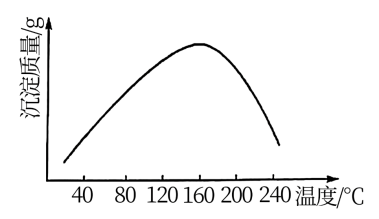
(5)步骤vi用 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因___ 。
(6)步骤vi沉钴中(常温下进行),若滤液中 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为___ 。
(7)步骤viii中 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是_______ 。
 作锂电池的正极材料。
作锂电池的正极材料。I.(1)基态Co原子的价层电子排布式为
II.利用原钴矿
 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
资料:①在含一定量
 的溶液中:
的溶液中: 。
。②
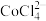 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:

(2)步骤i的目的是
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是
(5)步骤vi用
 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
(6)步骤vi沉钴中(常温下进行),若滤液中
 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为
(7)步骤viii中
 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是
您最近一年使用:0次
2021-03-04更新
|
253次组卷
|
2卷引用:江苏省南京市中华中学 2021-2022学年高三上学期第一次月考化学试题
名校
7 . 可逆反应进行到一定程度会达到化学平衡状态,如K2Cr2O7溶液中存在平衡:Cr2 (橙色)+H2O
(橙色)+H2O 2Cr
2Cr (黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
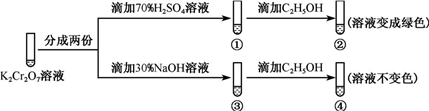
已知:C2H5OH遇到氧化剂容易被氧化。
结合实验,下列说法不正确的是
 (橙色)+H2O
(橙色)+H2O 2Cr
2Cr (黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
已知:C2H5OH遇到氧化剂容易被氧化。
结合实验,下列说法不正确的是
| A.①中溶液橙色加深,③中溶液变黄 | B.②中Cr2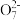 被C2H5OH还原 被C2H5OH还原 |
| C.对比②和④可知K2Cr2O7酸性溶液氧化性弱 | D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
您最近一年使用:0次



