真题
名校
1 . 在恒温恒容密闭容器中充入一定量 ,发生如下反应:
,发生如下反应: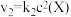 和
和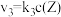 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
 ,发生如下反应:
,发生如下反应: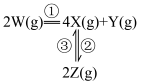
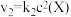 和
和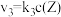 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。 | 0 | 1 | 2 | 3 | 4 | 5 |
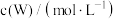 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.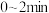 内,X的平均反应速率为 内,X的平均反应速率为 |
| B.若增大容器容积,平衡时Y的产率增大 |
C.若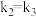 ,平衡时 ,平衡时 |
D.若升高温度,平衡时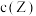 减小 减小 |
您最近一年使用:0次
2023-11-29更新
|
3334次组卷
|
5卷引用:选择题11-14
解题方法
2 . 下列方案设计、现象和结论不正确的是
| 实验方案 | 现象 | 结论 | |
| A | 试管中依次加入3mL乙醇2mL浓硫酸、2mL乙酸及沸石后连接好装置并加热 | 饱和碳酸钠液面上出现有香味的无色油状液体 | 有酯类物质生成 |
| B | 将 液体和 液体和 固体分别暴露在潮湿空气中 固体分别暴露在潮湿空气中 | 只有前者会冒“白烟” | 相同条件下水解程度: |
| C | 室温下,将 溶液和稀 溶液和稀 混合 混合 | 溶液变浑浊且有刺激性气味的气体生成 |  既体现还原性又体现氧化性 既体现还原性又体现氧化性 |
| D | 向 溶液中加入5滴 溶液中加入5滴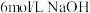 溶液 溶液 | 溶液由橙色变黄色 |  减小,平衡向 减小,平衡向 减小的方向移动 减小的方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023·全国·模拟预测
名校
3 . 下列实验操作、现象、结论均正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入适量KCl固体 Fe(SCN)3+3KCl中加入适量KCl固体 | 溶液的颜色变浅 | 平衡逆向移动 |
| B | 对平衡体系2NO2(g) N2O4(g)压缩体积,增大压强 N2O4(g)压缩体积,增大压强 | 混合气体的颜色变深 | 平衡逆向移动 |
| C | 2mL0.1mol•L-1K2Cr2O7溶液中存在:Cr2O +H2O +H2O 2CrO 2CrO +2H+,向其中滴加5~10滴6mol•L-1NaOH溶液 +2H+,向其中滴加5~10滴6mol•L-1NaOH溶液 | 溶液由橙色变为黄色 | 平衡正向移动 |
| D | CuCl2溶液中存在:[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O △H>0,对CuCl2溶液加热 [CuCl4]2-(黄色)+4H2O △H>0,对CuCl2溶液加热 | 溶液由蓝色变为黄色 | 平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 乙烯水合法是工业制乙醇的方法: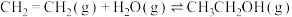 ,该反应在密闭容器中进行,下列说法错误的是
,该反应在密闭容器中进行,下列说法错误的是
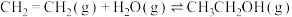 ,该反应在密闭容器中进行,下列说法错误的是
,该反应在密闭容器中进行,下列说法错误的是A.恒温恒容,充入 , ,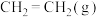 的转化率增大 的转化率增大 |
B.若升高温度,平衡常数减小,则该反应 |
| C.压缩容积,活化分子百分数增大,反应速率加快 |
D.恒温恒压,通入 ,平衡向左移动 ,平衡向左移动 |
您最近一年使用:0次
2022-10-29更新
|
581次组卷
|
7卷引用:选择题11-15
(已下线)选择题11-15(已下线)专题13 化学反应速率和化学平衡(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2019年高考海南卷化学试题变式题(单选题)四川省雅安市2023届高三上学期零诊考试化学试题湖南省衡阳市第一中学2023届高三下学期5月月考化学试题辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题
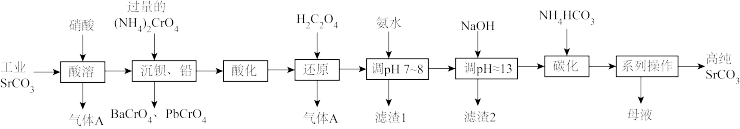
5 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1200次组卷
|
13卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)
(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题湖南省邵阳市第一中学2023届高三第五次月考化学试题
解题方法
6 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
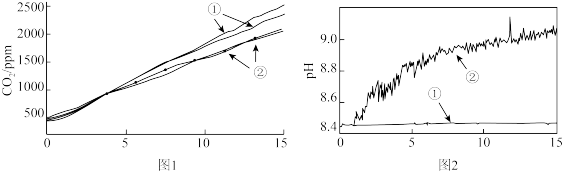
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1140次组卷
|
7卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)
(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)
名校
7 . 在热带海域中,珊瑚虫在浅海区域分泌石灰石骨骼,与藻类共生形成美丽的珊瑚。下列说法错误的是
A.珊瑚形成的反应为Ca2+ (aq)+2HCO (aq)⇌ CaCO3(s)+ H2O(l)+CO2(aq) (aq)⇌ CaCO3(s)+ H2O(l)+CO2(aq) |
| B.与温带海域相比,热带海域水温较高是利于形成珊瑚的原因之一 |
| C.与深海区域相比,浅海区阳光强烈,藻类光合作用强,更有利于珊瑚形成 |
D.大气中CO2浓度增加,会导致海水中CO 浓度增大,有利于珊瑚形成 浓度增大,有利于珊瑚形成 |
您最近一年使用:0次
2022-01-13更新
|
521次组卷
|
7卷引用:选择题11-15
(已下线)选择题11-15山东省济南市2021-2022学年上学期高三上学期1月学情检测化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)山东省枣庄市2022-2023学年高二上学期期末考试化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期10月月考化学试题辽宁省六校协作体2023-2024学年高二上学期12月月考化学试题2024届内蒙古自治区包头市高三下学期三模理科综合试题-高中化学
名校
8 . 进入实验室后,一切行动听指挥。不听老师指挥或者不听课的同学就容易做错这一题。下列实验设计或实验现象描述正确的是
①水溶液中,K2Cr2O7存在以下平衡:Cr2O +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄
②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1- [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
①水溶液中,K2Cr2O7存在以下平衡:Cr2O
 +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1-
 [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
| A.②④⑤ | B.②③⑤ | C.①⑤ | D.①②④ |
您最近一年使用:0次



