解题方法
1 . 回答下列问题。
(1)工业合成氨的反应: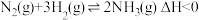 ,分别在
,分别在 、
、 温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
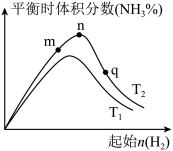
①比较在m、n、q三点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是___________ 点。
② 条件下,在
条件下,在 的密闭容器中,充入
的密闭容器中,充入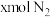 和
和 时,
时, 达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):
达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):
___________ ;该反应的平衡常数的值
___________ 。
③图像中
___________  (填“高于”、“低于”、“等于”或“无法确定”)。
(填“高于”、“低于”、“等于”或“无法确定”)。
(2)一定温度下,在密闭容器中将等物质的量的 和
和 混合,采用适当的催化剂进行反应
混合,采用适当的催化剂进行反应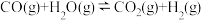 ,已知此温度下,该反应的平衡常数
,已知此温度下,该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数为
的物质的量分数为___________  。
。
(1)工业合成氨的反应:
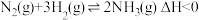 ,分别在
,分别在 、
、 温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
①比较在m、n、q三点所处的平衡状态中,反应物
 的转化率最高的是
的转化率最高的是②
 条件下,在
条件下,在 的密闭容器中,充入
的密闭容器中,充入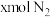 和
和 时,
时, 达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):
达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):

③图像中

 (填“高于”、“低于”、“等于”或“无法确定”)。
(填“高于”、“低于”、“等于”或“无法确定”)。(2)一定温度下,在密闭容器中将等物质的量的
 和
和 混合,采用适当的催化剂进行反应
混合,采用适当的催化剂进行反应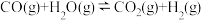 ,已知此温度下,该反应的平衡常数
,已知此温度下,该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数为
的物质的量分数为 。
。
您最近一年使用:0次
名校
2 . 甲醇是重要的化工原料,发展前景广阔。研究表明, 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: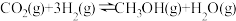
(1)反应的平衡常数表达式为K=___________ 。
(2)有利于提高平衡时 转化率的措施有
转化率的措施有___________ (填字母)。
a.使用催化剂
b.加压
c.增大 和H2的初始投料比
和H2的初始投料比
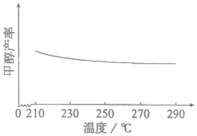
(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
___________ 0(填“>”“=”或“<”),依据是___________ 。
 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: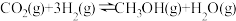
(1)反应的平衡常数表达式为K=
(2)有利于提高平衡时
 转化率的措施有
转化率的措施有a.使用催化剂
b.加压
c.增大
 和H2的初始投料比
和H2的初始投料比(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中
 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的

您最近一年使用:0次
2021-12-02更新
|
798次组卷
|
4卷引用:福建省上杭县才溪中学2022-2023学年高二上学期10月月考化学试题
3 . 在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变为红色。
(1)写出反应的化学方程式:____________ 。
(2)再向溶液中滴入1mol/LFeC13溶液,现象_______________ ,平衡向_______ 反应方向移动,KSCN浓度会________________ 。
(3)在烧杯中加入KC1固体,颜色___________________ ,平衡_______ 移动。
(1)写出反应的化学方程式:
(2)再向溶液中滴入1mol/LFeC13溶液,现象
(3)在烧杯中加入KC1固体,颜色
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:

其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O
(1)向平衡体系滴加少量浓H2SO4,则溶液显______ 色.
(2)能说明第①步反应达平衡状态的是______ 。
a. 和
和 的浓度相同 b.2v(
的浓度相同 b.2v( )=v(
)=v( ) c.溶液的颜色不变
) c.溶液的颜色不变
(3)第②步中,还原1mol 离子,需要
离子,需要______ mol的FeSO4·7H2O。
Ⅱ.已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同.发生反应:2NO2(g) N2O4(g)∆H<0,一段时间后相继达到平衡状态.
N2O4(g)∆H<0,一段时间后相继达到平衡状态.
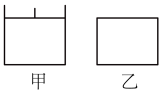
(1)平衡时NO2体积分数:甲_____ 乙(填“ ”、“
”、“ ”或“
”或“ ”)
”)
(2)达到平衡所需时间,甲______ 乙(填“ ”、“
”、“ ”或“
”或“ ”)
”)
(3)该反应的平衡常数表达式K=______ 。
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2
 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O(1)向平衡体系滴加少量浓H2SO4,则溶液显
(2)能说明第①步反应达平衡状态的是
a.
 和
和 的浓度相同 b.2v(
的浓度相同 b.2v( )=v(
)=v( ) c.溶液的颜色不变
) c.溶液的颜色不变(3)第②步中,还原1mol
 离子,需要
离子,需要Ⅱ.已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同.发生反应:2NO2(g)
 N2O4(g)∆H<0,一段时间后相继达到平衡状态.
N2O4(g)∆H<0,一段时间后相继达到平衡状态.
(1)平衡时NO2体积分数:甲
 ”、“
”、“ ”或“
”或“ ”)
”)(2)达到平衡所需时间,甲
 ”、“
”、“ ”或“
”或“ ”)
”)(3)该反应的平衡常数表达式K=
您最近一年使用:0次
5 . 甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。__ PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__ 。
③下列叙述能说明上述反应能达到化学平衡状态的是__ (填代号)。
a.H2的消耗速率是CH3OH消耗速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__ ,再加入1.0molCO后重新到达平衡,则CO的转化率__ (填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)__ v(逆)(填“>、<或=”)。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。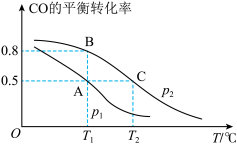
②A、B、C三点的平衡常数KA,KB,KC的大小关系是
③下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH消耗速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
您最近一年使用:0次
2020-10-19更新
|
184次组卷
|
21卷引用:【校级联考】福建省福州市八县(市)协作校2018-2019学年高二上学期期末联考化学试题
【校级联考】福建省福州市八县(市)协作校2018-2019学年高二上学期期末联考化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期第一次月考化学试题陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题湖北省随州市曾都一中2020-2021学年高二上学期9月月考化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学(实验班)试题内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题山东省惠民县第二中学致远部2020-2021学年高二上学期10月月考化学试题内蒙古通辽市开鲁县第一中学2021届高三上学期第二次阶段性考试化学试题重庆市铁路中学校2020-2021学年高二上学期11月月考化学试题重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题湖南师范大学附属中学2022-2023学年高二上学期期中考试化学试题四川省广安代市中学校2021-2022学年高二上学期9月考化学试题湖南省怀化市第三中学2022-2023学年高二上学期期中考试化学试题江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题河南省濮阳市2023-2024学年高二上学期9月月考化学试题江西省宜春市宜丰中学2023-2024学年高二上学期开学考试化学试题陕西省西安市长安区2023-2024学年高二上学期10月份月考化学试题四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题海南省琼海市嘉积中学2023-2024学年高二上学期第一次月考化学试题四川省泸州市泸县第四中学2023-2024学年高二上学期12月月考化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题
6 . 煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是___ 。
CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)CaSO4(s)+4CO(g)
 CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)请回答下列问题:
通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是
您最近一年使用:0次
7 . 在密闭容器中,使2 mol A和4 mol B混合发生下列反应:
A(g)+2B(g) 2C(g) ΔH<0。
2C(g) ΔH<0。
(1)当反应达到平衡时,A和B的浓度比是_______ ;A和B的转化率比是_______ 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_________ ,密度_________ 。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________ (填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______ (填“大于”、“小于”或“等于”)原来的2倍。
A(g)+2B(g)
 2C(g) ΔH<0。
2C(g) ΔH<0。(1)当反应达到平衡时,A和B的浓度比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
您最近一年使用:0次
8 . 在一定条件下,可逆反应:mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是_______ 。其它条件不变时,若再充入一定量的A, 则平衡向______________ 方向移动,A的消耗速率将____________ ;B的浓度将_________ (后两个空填增大、减小、或 “不能确定”)。
(2)A、C是气体,增加B的量,平衡不移动,则B为__________ 态。
(3)B、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是_________ 。
(4)加热后,可使C的质量增加,则正反应是___________ 反应(放热或吸热)。
 pC达到平衡,若:
pC达到平衡,若: (1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是
(2)A、C是气体,增加B的量,平衡不移动,则B为
(3)B、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使C的质量增加,则正反应是
您最近一年使用:0次
9 . 近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
某研究小组向某密闭容器加入一定量的活性炭和一氧化氮,发生反应:
C(s)+2NO(g)⇌N2(g)+CO2(g) △H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下表:
(1)根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率v(NO)=___ ;计算该反应的平衡常数K=__________ 。
(2)30min后,只改变某一条件,根据上表的数据判断改变的条件可能是___ (填序号)。
A.通入一定量的CO2 B.加入合适的催化剂 C.通入一定量的NO
D.加入一定量的活性炭 E.适当缩小容器的体积 F.改变温度
(3)若30min后降低温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为4:3:3,则达到新平衡时NO的转化率____ (填“升高” 或“降低” ),a_____ 0(填“>”或“<” )。
某研究小组向某密闭容器加入一定量的活性炭和一氧化氮,发生反应:
C(s)+2NO(g)⇌N2(g)+CO2(g) △H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下表:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.68 | 0.50 | 0.50 | 0.70 | 0.70 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.35 | 0.35 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.35 | 0.35 |
(1)根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率v(NO)=
(2)30min后,只改变某一条件,根据上表的数据判断改变的条件可能是
A.通入一定量的CO2 B.加入合适的催化剂 C.通入一定量的NO
D.加入一定量的活性炭 E.适当缩小容器的体积 F.改变温度
(3)若30min后降低温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为4:3:3,则达到新平衡时NO的转化率
您最近一年使用:0次
2019-01-28更新
|
274次组卷
|
4卷引用:【校级联考】福建省八县(市)一中2018-2019学年高二上学期期末考试化学试题
名校
10 . 在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g)  CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
(1)K的表达式为:____ ;
(2)该反应的正反应为___ 反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) = c(CO)= c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时上述的反应中正、逆反应速率的关系式是___________ (填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___ (“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因________ 。
 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:
(2)该反应的正反应为
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) = c(CO)= c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时上述的反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率
您最近一年使用:0次



