名校
1 . 在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是___________ 。
(2)在实际生产中,选定的温度为400℃~500℃,原因是___________
(3)在实际生产中,采用的压强为常压,原因是___________
(4)在实际生产中,通入过量的空气,原因是___________
(5)尾气中的SO2必须回收,原因是___________ 。
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=___________ 。
 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 95.0 | 97.7 | 98.3 |
(2)在实际生产中,选定的温度为400℃~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中的SO2必须回收,原因是
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=
您最近一年使用:0次
2 . 将0.4molN2O4充入2L固定容积的密闭容器中发生反应:N2O4(g) 2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
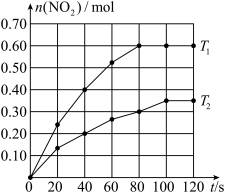
(1)该反应的△H_______ (填“>”“<”或“=”)0,理由是_______ 。
(2) T1时,40~80s内用N2O4的浓度变化表示的反应速率为_______ mol·L-1·s-1。
(3) T1时,反应的平衡常数K=_______ 。恒温恒容条件下,下列能说明该反应达到平衡状态的是_______ (填序号)。
①v(NO2)=2v(N2O4);②反应体系的总压强保持恒定不变;③混合气体的密度保持恒定不变;④体系颜色保持不变;⑤容器内NO2和N2O4的浓度相等
(4)T2时,改变条件使反应重新达到平衡时, 的值变小,则采取的措施可能是_______(填字母)。
的值变小,则采取的措施可能是_______(填字母)。
 2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
2NO2(g) △H。分别在T1和T2时,测得NO2的物质的量随时间的变化如下图所示:
(1)该反应的△H
(2) T1时,40~80s内用N2O4的浓度变化表示的反应速率为
(3) T1时,反应的平衡常数K=
①v(NO2)=2v(N2O4);②反应体系的总压强保持恒定不变;③混合气体的密度保持恒定不变;④体系颜色保持不变;⑤容器内NO2和N2O4的浓度相等
(4)T2时,改变条件使反应重新达到平衡时,
 的值变小,则采取的措施可能是_______(填字母)。
的值变小,则采取的措施可能是_______(填字母)。| A.增大 N2O4的起始浓度 | B.升高温度 |
| C.向混合气体中通入NO2 | D.使用高效催化剂 |
您最近一年使用:0次
2023-02-11更新
|
131次组卷
|
2卷引用:安徽省合肥卓越中学2023-2024学年高二上学期期中考试化学试题
3 . 已知Fe3+与 之间的反应是可逆反应:
之间的反应是可逆反应: 。某同学对该反应的可逆性进行实验。实验过程如下:
。某同学对该反应的可逆性进行实验。实验过程如下:
①将2mL0.004 KI溶液放入试管中,然后加入VmL0.004
KI溶液放入试管中,然后加入VmL0.004 FeCl3溶液并立即振荡。
FeCl3溶液并立即振荡。
②将充分反应后的①中溶液分成三份,分别放入A、B、C三个试管中,向A中加入3滴淀粉溶液,向B中加入3滴X溶液,向C中加入3滴蒸馏水。
回答下列问题:
(1)为达到预期实验目的,
_______ ,常用试剂X是_______ ,当A、B中溶液出现预期现象时,可确定该反应是可逆反应。
(2)假设实验①中V=2且忽略溶液体积的变化,反应经5s末时溶液颜色稳定不变且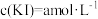 。则前5s内v(I2)=
。则前5s内v(I2)=_______ 。在图1的坐标系中画出用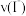 表示正、逆反应速率随时间的变化示意图
表示正、逆反应速率随时间的变化示意图_____ ;在图2的坐标系中画出c(Fe2+)随时间的变化图象______ 。


图1 图2
(3)若向C试管中加入少量固体KCl,振荡后静置,溶液颜色_______ (填“变深”“变浅”或“不变”)。
 之间的反应是可逆反应:
之间的反应是可逆反应: 。某同学对该反应的可逆性进行实验。实验过程如下:
。某同学对该反应的可逆性进行实验。实验过程如下:①将2mL0.004
 KI溶液放入试管中,然后加入VmL0.004
KI溶液放入试管中,然后加入VmL0.004 FeCl3溶液并立即振荡。
FeCl3溶液并立即振荡。②将充分反应后的①中溶液分成三份,分别放入A、B、C三个试管中,向A中加入3滴淀粉溶液,向B中加入3滴X溶液,向C中加入3滴蒸馏水。
回答下列问题:
(1)为达到预期实验目的,

(2)假设实验①中V=2且忽略溶液体积的变化,反应经5s末时溶液颜色稳定不变且
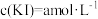 。则前5s内v(I2)=
。则前5s内v(I2)= 表示正、逆反应速率随时间的变化示意图
表示正、逆反应速率随时间的变化示意图

图1 图2
(3)若向C试管中加入少量固体KCl,振荡后静置,溶液颜色
您最近一年使用:0次
名校
4 . 利用太阳能光解水,制备的H2用于还原CO2可以在一定条件下合成CH3OH(不考虑副反应),CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0,可实现资源的再利用。回答下列问题:
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为_______ 。
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
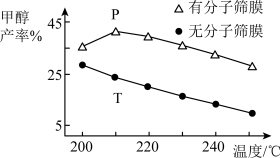
①甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为_______ °C。
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
您最近一年使用:0次
2021-01-19更新
|
210次组卷
|
4卷引用:安徽省池州市第一中学2020-2021学年高二12月月考化学试题
安徽省池州市第一中学2020-2021学年高二12月月考化学试题选择性必修1 专题2 素养检测四川省大竹中学2021-2022学年高二上学期期中达标测化学试题(基础卷)(已下线)第七章 化学反应速率与化学平衡 第45讲 实际工业生产中图像问题分类突破
5 . 在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O 2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入浓硫酸溶液,溶液呈_________ 色,因为_____________ 。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__________ 方向移动(正或逆),溶液颜色将__________ (加深或变浅)。
 2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。(1)向上述溶液中加入浓硫酸溶液,溶液呈
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向
您最近一年使用:0次
6 . 已知CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的转化反应______ 。
(2)由图可知,溶液酸性增大,CrO42-的平衡转化率____ (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为________ 。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________ 0(填“大于”“小于”或“等于”)。

(1)用离子方程式表示Na2CrO4溶液中的转化反应
(2)由图可知,溶液酸性增大,CrO42-的平衡转化率
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH
您最近一年使用:0次
名校
7 . 可逆反应3A(g) 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量______ ;
②若B、C都不是气体,气体的平均相对分子质量______ ;
③若B是气体,C不是气体,气体的平均相对分子质量______ ;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是__________ 态,C的状态是__________ 态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2 N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________ 。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量
②若B、C都不是气体,气体的平均相对分子质量
③若B是气体,C不是气体,气体的平均相对分子质量
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是
(3)某密闭容器中放入一定量的NO2,发生反应2NO2
 N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
您最近一年使用:0次
2019-09-02更新
|
357次组卷
|
3卷引用:【市级联考】安徽省池州市2019-2020学年高二第一学期九月份素质检测(开学考试)化学试题
名校
解题方法
8 . 现将0.4 mol A气体和0.2 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:

(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________ ;该反应在t1时达到平衡,其化学方程式为____________________________________ 。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________ 。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积

(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
您最近一年使用:0次
2018-10-20更新
|
253次组卷
|
2卷引用:【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题
12-13高一下·辽宁·期末
9 . 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O 2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
(1)向上述溶液中加入NaOH溶液,溶液呈__________ 色,因为_________ 。
(2)向已加入NaOH溶液的1中再加入过量稀硫酸,则溶液呈__________ 色,因为__________ 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡____________________ ,溶液颜色将____________________ 。
 2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向已加入NaOH溶液的1中再加入过量稀硫酸,则溶液呈
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡
您最近一年使用:0次
2019-12-02更新
|
92次组卷
|
10卷引用:【校级联考】安徽省滁州市定远县西片区2018-2019学年高二上学期期中考试化学试题
【校级联考】安徽省滁州市定远县西片区2018-2019学年高二上学期期中考试化学试题安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题(已下线)2012-2013学年辽宁省辽河油田第二高中高一下学期期末考试化学试卷2016-2017学年甘肃省兰州一中高二上期中理化学试卷河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题海南省海南鑫源高级中学2019-2020学年高二上学期期末考试化学试题(已下线)2.3.1 浓度、压强变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)作业(十一) 温度、浓度对化学平衡的影响第二章 化学反应速率与化学平衡 第二节 化学平衡 第3课时 影响化学平衡的因素
10 . 请根据要求填空:
(1)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式:_________________________________ 。

(2)化学反应速率和化学平衡是化学反应原理的重要组成部分。
将4.0mol PCl3和2.0 mol Cl2充入10 L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g) PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
①在0~2 min 内,用Cl2 表示的反应速率为:v(Cl2)=_____ mol·L-l·min-1;
②达到平衡时,PCl3的转化率为___________________ 。
③如果再通入1.0 mol Cl2,相同温度下重新达到平衡时,PCl5的物质的量________________ 。(填标号)
A.增大 B.减小 C.不变
(1)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式:

(2)化学反应速率和化学平衡是化学反应原理的重要组成部分。
将4.0mol PCl3和2.0 mol Cl2充入10 L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)
 PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。①在0~2 min 内,用Cl2 表示的反应速率为:v(Cl2)=
②达到平衡时,PCl3的转化率为
③如果再通入1.0 mol Cl2,相同温度下重新达到平衡时,PCl5的物质的量
A.增大 B.减小 C.不变
您最近一年使用:0次
2018-03-05更新
|
405次组卷
|
2卷引用:安徽省滁州市(九校)2017-2018学年高二上学期期末考试化学试题



