名校
1 . 钼酸铵是豆科植物的生命素。工业上欲利用废钼催化剂(主要成分为 ,还含少量的
,还含少量的 、CoS、NiO)制备钼酸铵,其具体流程为下:
、CoS、NiO)制备钼酸铵,其具体流程为下:
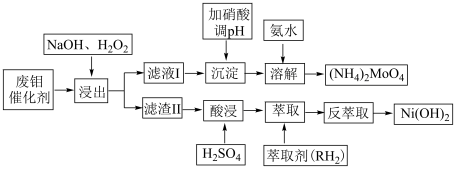
回答下列问题:
(1)为了提高浸出效率,可采取的措施为粉碎、___________ (写出2条)。
(2)写出浸出过程中主要反应的离子方程式___________ 。
(3)钼酸铵溶液经___________ 、过滤、洗涤、干燥可得到钼酸铵晶体,为减小产品损失,应选择下列___________ 试剂洗涤晶体。
A.蒸馏水 B.钼酸铵饱和溶液 C.乙醇水溶液
(4)由萃取过程的方程式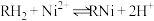 可知反萃取时应向体系中加入
可知反萃取时应向体系中加入___________ (酸性、碱性、中性)溶液。
(5)室温下,为保证反萃取后的溶液中 沉淀完全,应控制
沉淀完全,应控制 在什么范围
在什么范围___________ (已知:离子浓度小于 时可认为完全沉淀;
时可认为完全沉淀; )。
)。
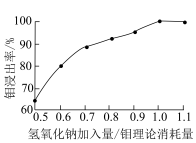
(6) 用量对钼的浸出率的影响如图所示,则浸出时最佳的
用量对钼的浸出率的影响如图所示,则浸出时最佳的 加入量与钼理论消耗量之比为
加入量与钼理论消耗量之比为___________ 。
 ,还含少量的
,还含少量的 、CoS、NiO)制备钼酸铵,其具体流程为下:
、CoS、NiO)制备钼酸铵,其具体流程为下:
回答下列问题:
(1)为了提高浸出效率,可采取的措施为粉碎、
(2)写出浸出过程中主要反应的离子方程式
(3)钼酸铵溶液经
A.蒸馏水 B.钼酸铵饱和溶液 C.乙醇水溶液
(4)由萃取过程的方程式
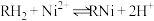 可知反萃取时应向体系中加入
可知反萃取时应向体系中加入(5)室温下,为保证反萃取后的溶液中
 沉淀完全,应控制
沉淀完全,应控制 在什么范围
在什么范围 时可认为完全沉淀;
时可认为完全沉淀; )。
)。(6)
 用量对钼的浸出率的影响如图所示,则浸出时最佳的
用量对钼的浸出率的影响如图所示,则浸出时最佳的 加入量与钼理论消耗量之比为
加入量与钼理论消耗量之比为
您最近一年使用:0次
名校
解题方法
2 . 三氯化六氨合钴(III) 是一种典型的维尔纳配合物,实验室常以活性炭为催化剂来制备,化学方程式为
是一种典型的维尔纳配合物,实验室常以活性炭为催化剂来制备,化学方程式为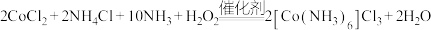 。
。
【配制氯化铵溶液】
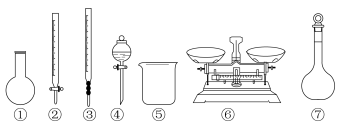
(1)实验欲用 固体配制
固体配制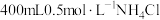 溶液,需要称取
溶液,需要称取 固体的质量为
固体的质量为_______ ;图中有四种仪器是不需要的,还需要的玻璃仪器除量筒以外还有_______ 。
【制备 】
】
设计小组设计如图装置(夹持仪器及加热装置已省略),回答下列问题:
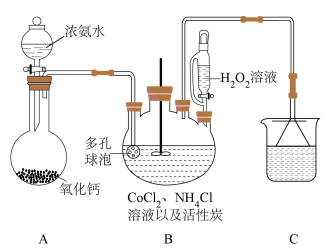
(2)装置A中发生反应的化学方程式为_______ 。
(3)装置B中盛放H2O2的实验仪器名称为_______ ,反应温度不宜超过50℃,除H2O2会分解外,另一原因是_______ 。
(4)装置C中漏斗的作用是_______ 。
(5)装置B中反应结束后,用冰水浴冷却后过滤,把沉淀溶解于沸水中,……,再慢慢加入适量浓盐酸于滤液中,有大量橙黄色 晶体析出。
晶体析出。
①除去活性炭的实验操作是_______ 。
②用平衡移动原理解释析出大量橙黄色晶体的原因:_______ 。
 是一种典型的维尔纳配合物,实验室常以活性炭为催化剂来制备,化学方程式为
是一种典型的维尔纳配合物,实验室常以活性炭为催化剂来制备,化学方程式为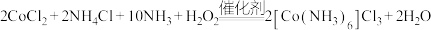 。
。【配制氯化铵溶液】

(1)实验欲用
 固体配制
固体配制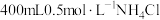 溶液,需要称取
溶液,需要称取 固体的质量为
固体的质量为【制备
 】
】设计小组设计如图装置(夹持仪器及加热装置已省略),回答下列问题:

(2)装置A中发生反应的化学方程式为
(3)装置B中盛放H2O2的实验仪器名称为
(4)装置C中漏斗的作用是
(5)装置B中反应结束后,用冰水浴冷却后过滤,把沉淀溶解于沸水中,……,再慢慢加入适量浓盐酸于滤液中,有大量橙黄色
 晶体析出。
晶体析出。①除去活性炭的实验操作是
②用平衡移动原理解释析出大量橙黄色晶体的原因:
您最近一年使用:0次
3 . 通过向烟道内喷入还原剂NH3,然后在催化剂的作用下将烟气中的NOx还原成清洁的N2和H2O。回答下列问题:
(1)已知下列反应的热化学方程式
①2NH3(g)+2NO(g)+ O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
②2NO2(g)+ NH3(g)⇌
NH3(g)⇌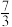 N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
③NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g) ΔH3
④2NH3(g)+ O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
计算反应③的ΔH3=___________ kJ·mol-1
(2)关于合成氨工艺的下列理解,不正确的是___________(填字母)。
(3)工业上生产NH3过程中,常用Fe作催化剂,控制温度773K,压强3.0×107Pa,原料中N2和H2物质的量之比为1:2.8.分析说明原料气中N2过量的理由:___________ 。
(4)若向容积为1.0L的反应容器中通入5molN2、15molH2,在不同温度下分别达到平衡时,混合气体中NH3的质量分数随压强变化的曲线如图所示。

①温度T1、T2、T3大小关系是___________ 。
②M点的平衡常数K=___________ (可用计算式表示)。
(5)铁和氨气在一定条件下发生置换反应生成氢气和另外一种化合物,该化合物的晶胞结构如图所示,该化合物的化学式为___________ ,若两个最近的Fe原子间的距离为acm,设NA为阿伏加德罗常数的数值,则该晶体的密度是___________ gcm-3(列出表达式即可)

(1)已知下列反应的热化学方程式
①2NH3(g)+2NO(g)+
 O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1②2NO2(g)+
 NH3(g)⇌
NH3(g)⇌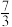 N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
N2(g)+4H2O(g) ΔH2=-912kJ·mol-1③NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g) ΔH3
④2NH3(g)+
 O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1计算反应③的ΔH3=
(2)关于合成氨工艺的下列理解,不正确的是___________(填字母)。
| A.工业实际生产中合成氨反应的ΔH和ΔS都小于零 |
| B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行 |
| D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂“中毒” |
(4)若向容积为1.0L的反应容器中通入5molN2、15molH2,在不同温度下分别达到平衡时,混合气体中NH3的质量分数随压强变化的曲线如图所示。

①温度T1、T2、T3大小关系是
②M点的平衡常数K=
(5)铁和氨气在一定条件下发生置换反应生成氢气和另外一种化合物,该化合物的晶胞结构如图所示,该化合物的化学式为

您最近一年使用:0次
4 . 平衡移动是化学平衡研究的重要方向。
(1)在 溶液中存在平衡:
溶液中存在平衡: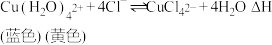
某兴趣小组取适量 固体进行下面实验:
固体进行下面实验:
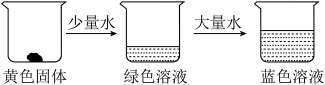
①向 固体中加入少量水时,溶液呈绿色的原因是:
固体中加入少量水时,溶液呈绿色的原因是:_______________________________________ ;
②取少量蓝色溶液加热后,溶液变为绿色,则
_____________ 0;(填“>”、“<”或“=”)
③另取少量蓝色溶液滴加几滴浓盐酸,溶液颜色变为__________________________ 。
(2)已知:a. 与
与 反应存在一定限度:
反应存在一定限度: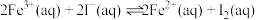 ;
;
b. 为黄色沉淀,且溶解度比
为黄色沉淀,且溶解度比 小很多。
小很多。

①ⅰ中蓝色变深,说明加入 饱和
饱和 溶液后,平衡
溶液后,平衡_____________ 移动。(填“正向”、“逆向”或“不”)
②ⅱ中蓝色变浅,用平衡移动解释其原因为__________________________ 。
③ⅲ中出现_____________ 色沉淀,静置后溶液颜色与ⅳ相比更_____________ 。(填“深”或“浅”)
(1)在
 溶液中存在平衡:
溶液中存在平衡: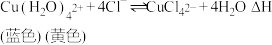
某兴趣小组取适量
 固体进行下面实验:
固体进行下面实验:
①向
 固体中加入少量水时,溶液呈绿色的原因是:
固体中加入少量水时,溶液呈绿色的原因是:②取少量蓝色溶液加热后,溶液变为绿色,则

③另取少量蓝色溶液滴加几滴浓盐酸,溶液颜色变为
(2)已知:a.
 与
与 反应存在一定限度:
反应存在一定限度: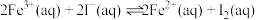 ;
;b.
 为黄色沉淀,且溶解度比
为黄色沉淀,且溶解度比 小很多。
小很多。
①ⅰ中蓝色变深,说明加入
 饱和
饱和 溶液后,平衡
溶液后,平衡②ⅱ中蓝色变浅,用平衡移动解释其原因为
③ⅲ中出现
您最近一年使用:0次
名校
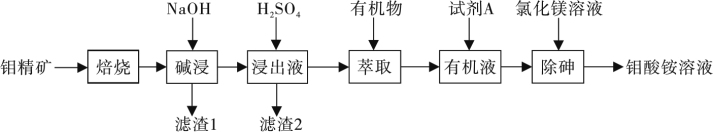
5 . 钼酸铵 常用作石化工业的催化剂,冶金工业用于制钼粉、钼条、钼丝、钼坯、钼片等,亦可作为微量元素肥料,制造陶瓷色料、颜料及其它钼的化合物的原料等。从钼精矿中(主要成分为
常用作石化工业的催化剂,冶金工业用于制钼粉、钼条、钼丝、钼坯、钼片等,亦可作为微量元素肥料,制造陶瓷色料、颜料及其它钼的化合物的原料等。从钼精矿中(主要成分为 ,还含有少量NiS以及铁、硅和砷的氧化物)制备钼酸铵的一种流程如图所示:
,还含有少量NiS以及铁、硅和砷的氧化物)制备钼酸铵的一种流程如图所示:
请回答下列问题:
(1)焙烧前,钼精矿要粉碎过筛,目的是___________ ;滤渣2的主要成分为___________ 。
(2)滤渣1为镍和铁的氧化物,浸出液中主要存在的离子为 、
、 、
、 、
、 、
、 、
、 ,“焙烧”时
,“焙烧”时 发生反应生成
发生反应生成 的化学方程式为
的化学方程式为___________ 。
(3)实验室进行萃取操作通常在仪器___________ 中进行。
(4)加入有机物萃取,发生化学反应为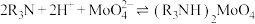 ,则加入试剂A进行反萃取,可选用___________(填序号)。
,则加入试剂A进行反萃取,可选用___________(填序号)。
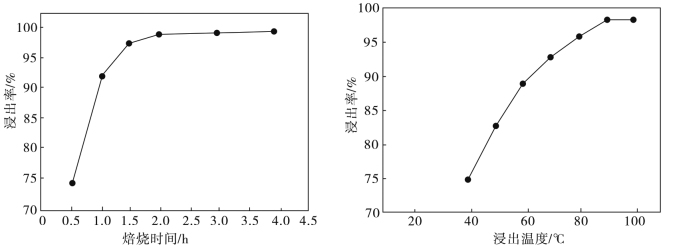
(5)钼的浸出率随焙烧时间和浸出温度变化的曲线如图所示,则最适宜的焙烧时间、浸出温度分别为___________ 、___________ 。
 常用作石化工业的催化剂,冶金工业用于制钼粉、钼条、钼丝、钼坯、钼片等,亦可作为微量元素肥料,制造陶瓷色料、颜料及其它钼的化合物的原料等。从钼精矿中(主要成分为
常用作石化工业的催化剂,冶金工业用于制钼粉、钼条、钼丝、钼坯、钼片等,亦可作为微量元素肥料,制造陶瓷色料、颜料及其它钼的化合物的原料等。从钼精矿中(主要成分为 ,还含有少量NiS以及铁、硅和砷的氧化物)制备钼酸铵的一种流程如图所示:
,还含有少量NiS以及铁、硅和砷的氧化物)制备钼酸铵的一种流程如图所示:
请回答下列问题:
(1)焙烧前,钼精矿要粉碎过筛,目的是
(2)滤渣1为镍和铁的氧化物,浸出液中主要存在的离子为
 、
、 、
、 、
、 、
、 、
、 ,“焙烧”时
,“焙烧”时 发生反应生成
发生反应生成 的化学方程式为
的化学方程式为(3)实验室进行萃取操作通常在仪器
(4)加入有机物萃取,发生化学反应为
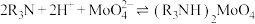 ,则加入试剂A进行反萃取,可选用___________(填序号)。
,则加入试剂A进行反萃取,可选用___________(填序号)。| A.NaOH溶液 | B.氨水 | C.稀硫酸 | D. 溶液 溶液 |

您最近一年使用:0次
名校
6 .  资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
Ⅰ. 与
与 催化重整制合成气是研究热点之一、发生的主要反应有:
催化重整制合成气是研究热点之一、发生的主要反应有:
反应①:
反应②: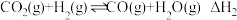
(1)有关化学键键能数据如表:
则反应②的反应热
_______  。
。
(2)对于上述反位体系,下列说法错误的是_______ 。
A.增大 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高 的平衡转化率
的平衡转化率
(3)恒压下进行 与
与 催化重整实验。初始压强为
催化重整实验。初始压强为 ,起始投料
,起始投料 ,
, 和
和 的平衡转化率随温度变化曲线如图所示。
的平衡转化率随温度变化曲线如图所示。
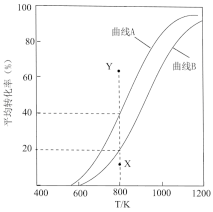
①曲线_______ (填“A”或“B”)表示 的平衡转化率。
的平衡转化率。
②800K,反应至 转化率达到X点时,v(正)
转化率达到X点时,v(正)_______ v(逆)(填“>”、“<”或“=”)。若要使 的转化率由X点达到Y点,改变的外界条件可以是
的转化率由X点达到Y点,改变的外界条件可以是_______ (答一条即可)。
③800K,反应①的分压平衡常数
_______ (分压=总压×物质的量分数)。
Ⅱ.利用电化学装置可实现 和
和 两种分子的耦合转化,其原理如图所示。
两种分子的耦合转化,其原理如图所示。
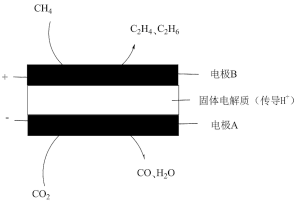
(4)阴极的电极反应式为_______ 。
 资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。Ⅰ.
 与
与 催化重整制合成气是研究热点之一、发生的主要反应有:
催化重整制合成气是研究热点之一、发生的主要反应有:反应①:

反应②:
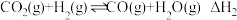
(1)有关化学键键能数据如表:
| 化学键 |  | H-O | C=O |  |
键能/ | 436 | 463 | 803 | 1076 |

 。
。(2)对于上述反位体系,下列说法错误的是
A.增大
 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高
 的平衡转化率
的平衡转化率(3)恒压下进行
 与
与 催化重整实验。初始压强为
催化重整实验。初始压强为 ,起始投料
,起始投料 ,
, 和
和 的平衡转化率随温度变化曲线如图所示。
的平衡转化率随温度变化曲线如图所示。
①曲线
 的平衡转化率。
的平衡转化率。②800K,反应至
 转化率达到X点时,v(正)
转化率达到X点时,v(正) 的转化率由X点达到Y点,改变的外界条件可以是
的转化率由X点达到Y点,改变的外界条件可以是③800K,反应①的分压平衡常数

Ⅱ.利用电化学装置可实现
 和
和 两种分子的耦合转化,其原理如图所示。
两种分子的耦合转化,其原理如图所示。
(4)阴极的电极反应式为
您最近一年使用:0次
2022-01-24更新
|
594次组卷
|
4卷引用:安徽省合肥市2022届高三上学期第一次教学质量检测化学试题
安徽省合肥市2022届高三上学期第一次教学质量检测化学试题(已下线)专项16 化学反应原理综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)甘肃省武威第六中学2022届高三下学期第八次诊断考试理综化学试题四川省成都艺术高级中学2021-2022学年高三下学期模拟考试理科综合化学部分试题(三)
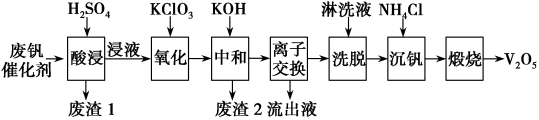
7 . 废钒催化剂的主要成分为V2O5、V2O4、K2SO4、Al2O3、SiO2、Fe2O3。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。下图为废钒催化剂回收工艺路线:
已知:①酸浸时,V2O5、V2O4分别转化为VO ,VO2+
,VO2+
②“离子交换”和“洗脱”过程可简单表示为4ROH+V4O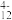
 R4V4O12+4OH-(ROH为阴离子交换树脂)
R4V4O12+4OH-(ROH为阴离子交换树脂)
(1)酸浸时需要粉碎废钒催化剂,目的是_______ 。
(2)写出酸浸时V2O4的转化反应方程式_______ 。废渣1的主要成分是_______ (填化学式)。
(3)氧化时加入0.1molKClO3,理论上能氧化_______ mol的VO2+离子。
(4)中和时pH应控制在大于_______ 。(精确到0.1)(已知中和时钒元素未形成沉淀,Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33,离子浓度小于1.0×10-5mol/L时认为沉淀完全)。
(5)为了提高洗脱效率,淋洗液应该呈_______ (填酸性或碱性)。
(6)已知沉钒时溶液中产生钒酸铵沉淀(NH4VO3),写出煅烧时的化学反应方程式_______ 。

已知:①酸浸时,V2O5、V2O4分别转化为VO
 ,VO2+
,VO2+②“离子交换”和“洗脱”过程可简单表示为4ROH+V4O
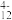
 R4V4O12+4OH-(ROH为阴离子交换树脂)
R4V4O12+4OH-(ROH为阴离子交换树脂)(1)酸浸时需要粉碎废钒催化剂,目的是
(2)写出酸浸时V2O4的转化反应方程式
(3)氧化时加入0.1molKClO3,理论上能氧化
(4)中和时pH应控制在大于
(5)为了提高洗脱效率,淋洗液应该呈
(6)已知沉钒时溶液中产生钒酸铵沉淀(NH4VO3),写出煅烧时的化学反应方程式
您最近一年使用:0次



