名校
1 . 电池正极片由镍钴锰酸锂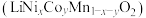 正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
(1)滤液1中含铝微粒为___________ 。
(2)“碱浸”后需进行过滤、洗涤,简述洗涤的操作过程:___________ 。
(3)“还原”时,参加反应的
___________ 。
(4)“分离”过程包含萃取和反萃取,萃取时必须使用的仪器是___________ ;萃取时利用有机物HT将Co2+从水溶液中萃取出来,该过程可表示为Co2+(水层)+2HT(有机层) CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:
CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:___________ 。
(5)“氧化”过程中MnSO4发生反应生成MnO2、(NH4)2SO4和H2SO4的化学方程式为___________ 。
(6)“沉钴”后获得CoC2O4·2H2O,取mgCoC2O4·2H2O进行“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
)与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:___________ ;“高温分解”需控制的最低温度为___________ 。
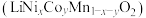 正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
(1)滤液1中含铝微粒为
(2)“碱浸”后需进行过滤、洗涤,简述洗涤的操作过程:
(3)“还原”时,参加反应的

(4)“分离”过程包含萃取和反萃取,萃取时必须使用的仪器是
 CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:
CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:(5)“氧化”过程中MnSO4发生反应生成MnO2、(NH4)2SO4和H2SO4的化学方程式为
(6)“沉钴”后获得CoC2O4·2H2O,取mgCoC2O4·2H2O进行“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
)与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
您最近一年使用:0次
2 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=___________ kJ/mol。
(2)在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
(3)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为___________ (保留2位有效数字)。
(4)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:

①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(5)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比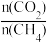 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:

随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=
(2)在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
| A.增大CO2的浓度,有利于NH3的转化率增大 |
| B.反应在任何温度下都能自发进行 |
| C.当混合气体的密度不再发生改变时反应达平衡状态 |
| D.充入He,压强增大,平衡向正反应移动 |
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)(3)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为
(4)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(5)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比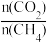 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近一年使用:0次
3 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
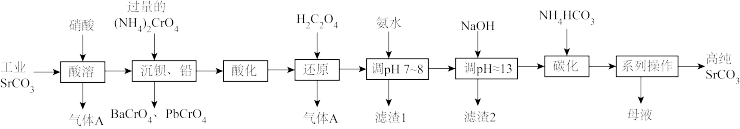
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1200次组卷
|
13卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题
河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题湖南省邵阳市第一中学2023届高三第五次月考化学试题
解题方法
4 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
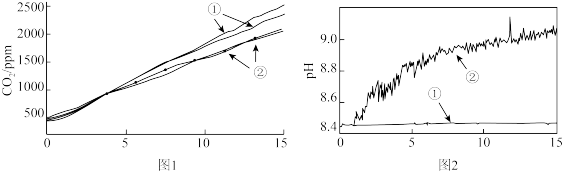
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1140次组卷
|
7卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题
河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)
名校
5 . 某实验小组从电极反应角度探究银镜反应中物质氧化性和还原性的变化。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、_______ 。
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:_______ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_______ 。
(3)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_______ 。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是_______ 。
(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因_______ 。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
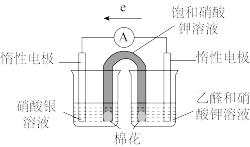
| 实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是
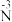 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因
您最近一年使用:0次
2022-04-02更新
|
1049次组卷
|
7卷引用:河北省石家庄市河北正定中学2023-2024学年高三下学期4月模拟考试化学试题
6 . 近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。以下是两种制取过程:
(1)利用CO2制取甲醇
在1L的容器中,选择合适的催化剂进行反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。改变表中条件,测得如下数据:
①T1时平衡常数K=_______ (计算结果保留2位小数);若T1=T3,则α_______ 60%(填“<”“=”“>”),结合相关数据计算,写出推理过程_______ 。
②已知反应速率v正=k正x(CO2)x3(H2),v逆=k逆x(CH3OH)x(H2O),k正、k逆为速率常数,x为物质的量分数。若第2组数据的k正=20mol·L-1·s-1,则平衡时v逆=_______ mol·L-1·s-1。
(2)利用烯烃催化制取甲醇
制取过程中发生如下反应:
I.C3H6(g)+3H2O(g)⇌3CH3OH(g) △H1
II.C2H4(g)+2H2O(g)⇌2CH3OH(g) △H2
III.3C2H4(g)⇌2C3H6(g) △H3
反应I、III的vantHoff实验数据如图所示(vantHoff经验公式RlnK=- +C,
+C, 为标准焓变,K为平衡常数,R和C为常数)。根据图判断:.
为标准焓变,K为平衡常数,R和C为常数)。根据图判断:.
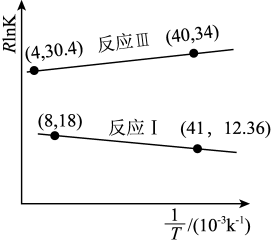
①△H2=_______ (用含△H1和△H3的计算式表示),反应III的 =
=_______ kJ·mol-1。
②为研究该反应体系的平衡关系,向容积为1L的容器中加入1.0mol甲醇,控制温度为500K,测得平衡时,甲醇的转化率为0.8,乙烯的物质的量为0.1mol,则R的数值为_______ 。(计算结果保留1位小数,已知:lge=0.43,lg5=0.7)
(1)利用CO2制取甲醇
在1L的容器中,选择合适的催化剂进行反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。改变表中条件,测得如下数据:
| 温度 | 投料n(H2)/mol | 投料n(CO2)/mol | H2平衡转化率/% | |
| 1组 | T1 | 1 | 2 | 60 |
| 2组 | T2 | 2 | 2 | 50 |
| 3组 | T3 | 6 | 2 | α |
①T1时平衡常数K=
②已知反应速率v正=k正x(CO2)x3(H2),v逆=k逆x(CH3OH)x(H2O),k正、k逆为速率常数,x为物质的量分数。若第2组数据的k正=20mol·L-1·s-1,则平衡时v逆=
(2)利用烯烃催化制取甲醇
制取过程中发生如下反应:
I.C3H6(g)+3H2O(g)⇌3CH3OH(g) △H1
II.C2H4(g)+2H2O(g)⇌2CH3OH(g) △H2
III.3C2H4(g)⇌2C3H6(g) △H3
反应I、III的vantHoff实验数据如图所示(vantHoff经验公式RlnK=-
 +C,
+C, 为标准焓变,K为平衡常数,R和C为常数)。根据图判断:.
为标准焓变,K为平衡常数,R和C为常数)。根据图判断:.
①△H2=
 =
=②为研究该反应体系的平衡关系,向容积为1L的容器中加入1.0mol甲醇,控制温度为500K,测得平衡时,甲醇的转化率为0.8,乙烯的物质的量为0.1mol,则R的数值为
您最近一年使用:0次
2022-04-01更新
|
555次组卷
|
3卷引用:河北省五个一联盟2022-2023学年高三上学期12月联考化学试题
河北省五个一联盟2022-2023学年高三上学期12月联考化学试题山东省潍坊市2021-2022学年高三下学期高中学科核心素养测评化学试题(已下线)化学(全国甲卷单科A卷)-学易金卷:2023年高考第一次模拟考试卷
2022·河北·模拟预测
7 . 次氯酸仅存在于溶液中,有很强的氧化性和漂白作用。某学习小组通过查阅资料知,可用以下两种方法制备次氯酸溶液。
实验1: 与水反应
与水反应
实验装置如图所示( 制备装置、装置B中的冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备
制备装置、装置B中的冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备 ,并用水吸收
,并用水吸收 制备次氯酸溶液。
制备次氯酸溶液。
已知: 极易溶于水;
极易溶于水; 的沸点为3.8 ℃,42 ℃以上
的沸点为3.8 ℃,42 ℃以上 可分解为
可分解为 和
和

回答下列问题:
(1)该实验用浓盐酸和漂白粉制备氯气,该反应的化学方程式为___________ ;装置A中饱和食盐水的作用是___________ 。
(2)反应过程中,装置B需放在冷水中,其目的是___________ 。
(3)若装置B中反应生成8.7 g ,则该反应中转移电子的总数为
,则该反应中转移电子的总数为___________ (设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(4)装置C中使用棕色圆底烧瓶的原因是___________ (用化学方程式表示)。
实验2:饱和氯水与石灰石反应
实验操作:①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去。
②过滤,滤液即为较浓的HClO溶液。
(5)实验2能得到较浓HClO溶液的原因是___________ 。
(6)请设计一个简单的实验,证明实验2所得滤液中HClO的浓度比饱和氯水中HClO浓度大___________ 。
实验1:
 与水反应
与水反应实验装置如图所示(
 制备装置、装置B中的冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备
制备装置、装置B中的冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备 ,并用水吸收
,并用水吸收 制备次氯酸溶液。
制备次氯酸溶液。已知:
 极易溶于水;
极易溶于水; 的沸点为3.8 ℃,42 ℃以上
的沸点为3.8 ℃,42 ℃以上 可分解为
可分解为 和
和

回答下列问题:
(1)该实验用浓盐酸和漂白粉制备氯气,该反应的化学方程式为
(2)反应过程中,装置B需放在冷水中,其目的是
(3)若装置B中反应生成8.7 g
 ,则该反应中转移电子的总数为
,则该反应中转移电子的总数为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(4)装置C中使用棕色圆底烧瓶的原因是
实验2:饱和氯水与石灰石反应
实验操作:①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去。
②过滤,滤液即为较浓的HClO溶液。
(5)实验2能得到较浓HClO溶液的原因是
(6)请设计一个简单的实验,证明实验2所得滤液中HClO的浓度比饱和氯水中HClO浓度大
您最近一年使用:0次
名校
8 . 油气田卤水中含有大量碘元素(主要以 形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
已知:ⅰ.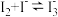 ,反应进行的程度很大;
,反应进行的程度很大; 的氧化性与
的氧化性与 相近,其水溶液呈棕黄色;
相近,其水溶液呈棕黄色;
ⅱ.酸性条件下 的氧化性强于
的氧化性强于 或
或 ,且酸性越强,其氧化性越强;
,且酸性越强,其氧化性越强;
ⅲ. 不能被阴离子交换树脂吸附。
不能被阴离子交换树脂吸附。
(1)预处理:将卤水中的 转化为
转化为 。
。
①写出 与
与 反应生成
反应生成 的离子方程式
的离子方程式_______ 。
②该步可能会有少量 生成。流程中,抑制
生成。流程中,抑制 生成的措施有:ⅰ.控制
生成的措施有:ⅰ.控制 的用量;ⅱ.
的用量;ⅱ._______ 。
(2)富集过程使用的阴离子交换树脂是一种高分子材料,其链节可表示为 。离子交换的原理:
。离子交换的原理: 。在阴离子交换树脂上的循环操作如图1所示。
。在阴离子交换树脂上的循环操作如图1所示。
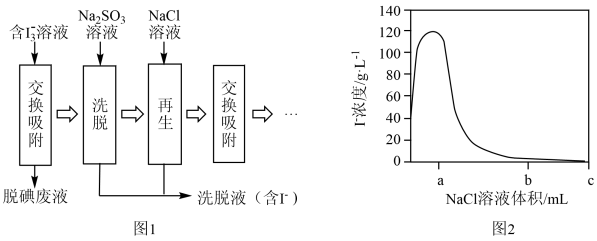
①交换吸附:当观察到脱碘废液_______ 时,说明离子交换树脂已吸附饱和。
②洗脱:用 溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式
溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式_______ 。

③再生:用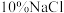 溶液缓慢冲洗离子交换树脂,收集含
溶液缓慢冲洗离子交换树脂,收集含 的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中
的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中 浓度,如图2所示。
浓度,如图2所示。 溶液最佳体积为b,理由是
溶液最佳体积为b,理由是_______ 。
④已知离子交换树脂对 的结合能力强于对
的结合能力强于对 的结合能力,再生过程能够发生的原因是
的结合能力,再生过程能够发生的原因是_______ 。
(3)氧化步骤得到泥状粗碘, 元素被还原到最低价。该反应的离子方程式是
元素被还原到最低价。该反应的离子方程式是_______ 。
 形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
形式存在)。工业上以净化后的卤水为原料通过离子交换法提取碘。
已知:ⅰ.
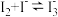 ,反应进行的程度很大;
,反应进行的程度很大; 的氧化性与
的氧化性与 相近,其水溶液呈棕黄色;
相近,其水溶液呈棕黄色;ⅱ.酸性条件下
 的氧化性强于
的氧化性强于 或
或 ,且酸性越强,其氧化性越强;
,且酸性越强,其氧化性越强;ⅲ.
 不能被阴离子交换树脂吸附。
不能被阴离子交换树脂吸附。(1)预处理:将卤水中的
 转化为
转化为 。
。①写出
 与
与 反应生成
反应生成 的离子方程式
的离子方程式②该步可能会有少量
 生成。流程中,抑制
生成。流程中,抑制 生成的措施有:ⅰ.控制
生成的措施有:ⅰ.控制 的用量;ⅱ.
的用量;ⅱ.(2)富集过程使用的阴离子交换树脂是一种高分子材料,其链节可表示为
 。离子交换的原理:
。离子交换的原理: 。在阴离子交换树脂上的循环操作如图1所示。
。在阴离子交换树脂上的循环操作如图1所示。
①交换吸附:当观察到脱碘废液
②洗脱:用
 溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式
溶液充分浸泡吸附饱和的离子交换树脂。补全该过程中反应的离子方程式
③再生:用
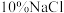 溶液缓慢冲洗离子交换树脂,收集含
溶液缓慢冲洗离子交换树脂,收集含 的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中
的洗脱液并使离子交换树脂再生。实时监测从离子交换树脂中流出的洗脱液中 浓度,如图2所示。
浓度,如图2所示。 溶液最佳体积为b,理由是
溶液最佳体积为b,理由是④已知离子交换树脂对
 的结合能力强于对
的结合能力强于对 的结合能力,再生过程能够发生的原因是
的结合能力,再生过程能够发生的原因是(3)氧化步骤得到泥状粗碘,
 元素被还原到最低价。该反应的离子方程式是
元素被还原到最低价。该反应的离子方程式是
您最近一年使用:0次
2022-03-20更新
|
247次组卷
|
2卷引用:河北省廊坊市第十五中学2021-2022学年高三下学期第一次模拟测试化学试题
9 . 钯催化剂(主要成分为 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的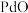 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
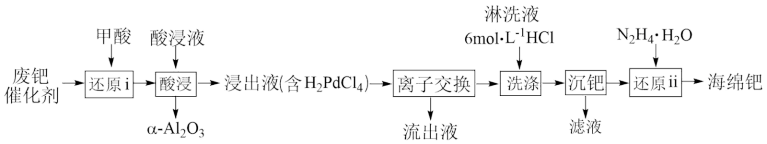
(1)“还原i”加入甲酸的目的是还原_______ (填化学式)。
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择_______ (填标号)。
A.王水(浓硝酸和浓盐酸按体积比 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
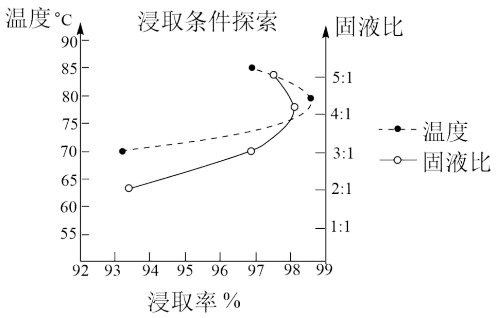
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。
①“离子交换”流出液中阳离子有 、
、_______ (填离子符号)。
②淋洗液需保持 小于2的原因是
小于2的原因是_______ 。
(4)“沉钯”过程钯元素主要发生如下转化: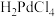 (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是_______ 。
(5)“还原ii”中产生无毒无害气体。由 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为_______ 。
(6)该工艺流程中可循环利用的物质有_______ 。
 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的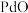 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
(1)“还原i”加入甲酸的目的是还原
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择
A.王水(浓硝酸和浓盐酸按体积比
 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为

(3)“离子交换”和“洗脱”可简单表示为:
 ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。①“离子交换”流出液中阳离子有
 、
、②淋洗液需保持
 小于2的原因是
小于2的原因是(4)“沉钯”过程钯元素主要发生如下转化:
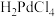 (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是(5)“还原ii”中产生无毒无害气体。由
 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为(6)该工艺流程中可循环利用的物质有
您最近一年使用:0次
2022-01-21更新
|
970次组卷
|
3卷引用:河北省石家庄市第二中学2022届高三2.5模化学试题
名校
解题方法
10 . 钯在尖端科学和石化、电子电气、环境保护、生物制药、国防等现代工业中起着关键和核心作用,由于钯资源非常有限,因此废旧催化剂等二次资源中钯再生回收价值很高。废钯催化剂的杂质主要含碳、有机物及少量Fe、Zn等元素。废催化剂中钯的分离与提纯工艺流程如下:

已知:
①钯常见的化合价有+2价和+4价。钯容易形成配位化合物,如[Pd(NH3)4]Cl2、[Pb(NH3)2]Cl2、[H2Pd(NO3)4]。
②当有硝酸存在时,钯易与硝酸形成稳定的配位体。
回答下列问题:
(1)“焙烧”的目的是___________ 。
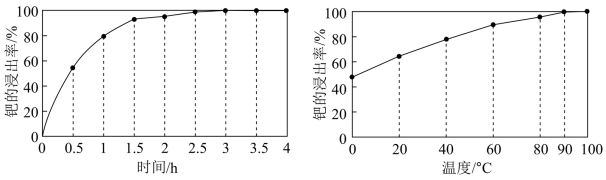
(2)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(H2PdCl4)溶液,钯的浸出率与反应的温度、时间的关系如图所示。最佳的浸取时间和温度为___________ 。
(3)将氯亚钯酸溶液进行充分“浓缩赶硝”的原因是___________ 。
(4)氯亚钯酸溶液经“氨水络合”后;生成二氯四氨络亚钯{[Pd(NH3)4]Cl2}的化学方程式为___________ 。
(5)“氨水络合”时需要控制好溶液的pH,已知常温下,Ksp[Fe(OH)3]=2.8×10-39,Ksp[Zn(OH)2]=2.0×10-16,要使得溶液中的杂质金属离子沉淀完全,pH至少调节为___________ (保留三位有效数字)。(lg2=0.3)
(6)往二氯四氨络亚钯{[Pd(NH3)4]Cl2}溶液中搅拌滴加盐酸,调节pH析出黄色的二氯二氨络亚钯{[Pb(NH3)2]Cl2}用化学用语解释实现该转化的原因_________ 。
(7)二氯二氨络亚钯经水合肼(N2H4·H2O)处理后得到纯钯,同时还产生对环境无污染的气体,则该反应的化学方程式为___________ 。

已知:
①钯常见的化合价有+2价和+4价。钯容易形成配位化合物,如[Pd(NH3)4]Cl2、[Pb(NH3)2]Cl2、[H2Pd(NO3)4]。
②当有硝酸存在时,钯易与硝酸形成稳定的配位体。
回答下列问题:
(1)“焙烧”的目的是
(2)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(H2PdCl4)溶液,钯的浸出率与反应的温度、时间的关系如图所示。最佳的浸取时间和温度为

(3)将氯亚钯酸溶液进行充分“浓缩赶硝”的原因是
(4)氯亚钯酸溶液经“氨水络合”后;生成二氯四氨络亚钯{[Pd(NH3)4]Cl2}的化学方程式为
(5)“氨水络合”时需要控制好溶液的pH,已知常温下,Ksp[Fe(OH)3]=2.8×10-39,Ksp[Zn(OH)2]=2.0×10-16,要使得溶液中的杂质金属离子沉淀完全,pH至少调节为
(6)往二氯四氨络亚钯{[Pd(NH3)4]Cl2}溶液中搅拌滴加盐酸,调节pH析出黄色的二氯二氨络亚钯{[Pb(NH3)2]Cl2}用化学用语解释实现该转化的原因
(7)二氯二氨络亚钯经水合肼(N2H4·H2O)处理后得到纯钯,同时还产生对环境无污染的气体,则该反应的化学方程式为
您最近一年使用:0次



