通过向烟道内喷入还原剂NH3,然后在催化剂的作用下将烟气中的NOx还原成清洁的N2和H2O。回答下列问题:
(1)已知下列反应的热化学方程式
①2NH3(g)+2NO(g)+ O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
②2NO2(g)+ NH3(g)⇌
NH3(g)⇌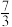 N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
③NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g) ΔH3
④2NH3(g)+ O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
计算反应③的ΔH3=___________ kJ·mol-1
(2)关于合成氨工艺的下列理解,不正确的是___________(填字母)。
(3)工业上生产NH3过程中,常用Fe作催化剂,控制温度773K,压强3.0×107Pa,原料中N2和H2物质的量之比为1:2.8.分析说明原料气中N2过量的理由:___________ 。
(4)若向容积为1.0L的反应容器中通入5molN2、15molH2,在不同温度下分别达到平衡时,混合气体中NH3的质量分数随压强变化的曲线如图所示。

①温度T1、T2、T3大小关系是___________ 。
②M点的平衡常数K=___________ (可用计算式表示)。
(5)铁和氨气在一定条件下发生置换反应生成氢气和另外一种化合物,该化合物的晶胞结构如图所示,该化合物的化学式为___________ ,若两个最近的Fe原子间的距离为acm,设NA为阿伏加德罗常数的数值,则该晶体的密度是___________ gcm-3(列出表达式即可)

(1)已知下列反应的热化学方程式
①2NH3(g)+2NO(g)+
 O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1②2NO2(g)+
 NH3(g)⇌
NH3(g)⇌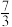 N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
N2(g)+4H2O(g) ΔH2=-912kJ·mol-1③NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g) ΔH3
④2NH3(g)+
 O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1计算反应③的ΔH3=
(2)关于合成氨工艺的下列理解,不正确的是___________(填字母)。
| A.工业实际生产中合成氨反应的ΔH和ΔS都小于零 |
| B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行 |
| D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂“中毒” |
(4)若向容积为1.0L的反应容器中通入5molN2、15molH2,在不同温度下分别达到平衡时,混合气体中NH3的质量分数随压强变化的曲线如图所示。

①温度T1、T2、T3大小关系是
②M点的平衡常数K=
(5)铁和氨气在一定条件下发生置换反应生成氢气和另外一种化合物,该化合物的晶胞结构如图所示,该化合物的化学式为

2023·安徽铜陵·模拟预测 查看更多[2]
更新时间:2023-05-22 14:39:07
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】某小组同学探究铁离子与苯酚的反应。
已知:Fe3++6C6H5O [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、___________ 。
(2)氯化铁溶液呈___________ (填“酸性”或“碱性”),用离子方程式表示原因___________ 。
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是___________ 。
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
①向实验2反应后溶液中加入___________ ,溶液颜色无变化,证明猜想i不成立。
②实验证明猜想ii成立,请写出实验操作和现象___________ 。
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释___________ 。
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由___________ 。
(7)由以上研究可知,影响铁离子与苯酚反应的因素有___________ 。
已知:Fe3++6C6H5O
 [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、
(2)氯化铁溶液呈
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。①向实验2反应后溶液中加入
②实验证明猜想ii成立,请写出实验操作和现象
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由
(7)由以上研究可知,影响铁离子与苯酚反应的因素有
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】以 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
资料:i.水溶液中: 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。
ii. ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。
将等体积的溶液a分别加到等量铜粉中,实验记录如下:
(1)Ⅰ中产生白色沉淀的离子方程式是____________ 。
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将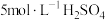 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。
依据电极反应式,分析产生 的原因
的原因____________ 。
②Ⅱ中溶液变为黄色,用离子方程式解释可能原因____________ 。
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1: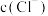 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因____________ 。
②假设2: 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:______ (填操作和现象),证实假设2不合理。
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因______ 。
(5)结合现象和化学反应原理解释选择 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因____________ 。
 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。资料:i.水溶液中:
 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。ii.
 ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。将等体积的溶液a分别加到等量铜粉中,实验记录如下:
实验 | 溶液a | 现象 |
Ⅰ |  溶液( 溶液( ) ) | 产生白色沉淀,溶液蓝色变浅,5h时铜粉剩余 |
Ⅱ | 浓盐酸(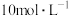 ) ) | 产生无色气泡,溶液无色;继而溶液变为黄色;较长时间后溶液变为棕色,5h时铜粉剩余 |
Ⅲ |  溶液( 溶液( )和浓盐酸( )和浓盐酸(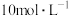 ) ) | 溶液由黄绿色变为棕色,无气泡;随着反应进行,溶液颜色变浅,后接近于无色,5h时铜粉几乎无剩余 |
(1)Ⅰ中产生白色沉淀的离子方程式是
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为
 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将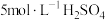 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。依据电极反应式,分析产生
 的原因
的原因②Ⅱ中溶液变为黄色,用离子方程式解释可能原因
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1:
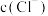 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因
②假设2:
 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因
(5)结合现象和化学反应原理解释选择
 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因
您最近一年使用:0次
【推荐3】利用工业废气CO2制甲醇I:CO2(g)+3H2(g CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。
CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。
(1)上述反应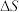
_______ 0,该反应能自发进行,则△H1_______ 0(填“>”或“<”)。
(2)在VL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生上述反应,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势_______ 。

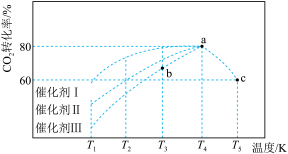
(3)将1.0molCO2和3.0molH2充入2L恒容密闭容器中,使其按反应I进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______。
(4)现向恒温恒压(0.1MPa)的密闭容器中充入1molCO2,3molH2和6molHe,上述反应达平衡时,测得CO2的转化率为0.2,则该反应的Kp=_______ MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果保留小数点后1位)。
(5)CO2制备CH3OH的过程中,往往伴随着另一反应发生:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3=+40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:_______ 。
(其中:CH3OH的选择性= ×100%)
×100%)
 CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。
CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。(1)上述反应
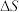
(2)在VL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生上述反应,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势

(3)将1.0molCO2和3.0molH2充入2L恒容密闭容器中,使其按反应I进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______。

| A.T3对应的平衡常数小于T4对应的平衡常数 |
| B.根据图中曲线分析,催化剂Ⅰ的催化效果好 |
| C.b点v(正)可能等于v(逆) |
| D.a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低 |
(5)CO2制备CH3OH的过程中,往往伴随着另一反应发生:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3=+40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:
(其中:CH3OH的选择性=
 ×100%)
×100%)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】中国科学院天津工业生物技术研究所研究员马延和研究团队,采用一种类似“搭积木”的方式,以二氧化碳、氢气为原料,首次在实验室实现了二氧化碳到淀粉的合成。回答下列问题:
(1)用CO2人工合成淀粉,其中前两步分别合成甲醇、甲醛,涉及的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CH3OH(g)+O2(g) HCHO(g)+H2O2(l) ΔH2
HCHO(g)+H2O2(l) ΔH2
③2H2O2(l) 2H2O(g)+O2(g) ΔH3
2H2O(g)+O2(g) ΔH3
已知反应④2H2(g)+O2(g)=2H2O(g) ΔH4,则反应CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH=
HCHO(g)+H2O(g) ΔH=___________ 。
(2)一定温度下,在一个刚性密闭容器中同时进行反应①和反应②,下列说法正确的是___________ (填标号)。
A.平衡时向容器中充入惰性气体,反应①的平衡正向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.选用合适的催化剂可以提高CH3OH的平衡产率
D.增加H2O2的量,可加快反应速率
E.体系达平衡后,若压缩容器容积,则反应②平衡正向移动
(3)CO2与CH3OH反应可制备HCOOCH3和HCOOH,发生的主要反应如下:
Ⅰ.CH3OH(g)+CO2(g) HCOOH(g)+HCHO(g) ΔH5>0
HCOOH(g)+HCHO(g) ΔH5>0
Ⅱ.HCOOH(g)+CH3OH(g) HCOOCH3(g)+H2O(g) ΔH6>0
HCOOCH3(g)+H2O(g) ΔH6>0
Ⅲ.2HCHO(g) HCOOCH3(g) ΔH7<0
HCOOCH3(g) ΔH7<0
一定温度下,在一装有压强传感器的2 L刚性密闭容器中,充入2.0 mol CH3OH(g)和1.0 mol CO2(g)发生反应Ⅰ、Ⅱ、Ⅲ,测得压强变化如表:
达到平衡时,测得容器中HCOOH、HCHO的物质的量分别为0.10 mol、0.20 mol。
①0~20 min内,反应Ⅲ的平均反应速率v(HCHO)=___________ mol·L-1·min-1。
②CO2的平衡转化率为___________ 。
③该温度下,反应Ⅱ的压强平衡常数Kp=___________ 。
④不同压强下,投入足量CH3OH(g)和CO2(g)发生反应Ⅰ、Ⅱ、Ⅲ,实验测定HCOOCH3的平衡产率随温度的变化关系如图所示。随温度升高,HCOOCH3的平衡产率先升高后降低,其原因为___________ 。

压强p1、p2、p3由大到小的顺序为___________ ;图中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(1)用CO2人工合成淀粉,其中前两步分别合成甲醇、甲醛,涉及的反应如下:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②CH3OH(g)+O2(g)
 HCHO(g)+H2O2(l) ΔH2
HCHO(g)+H2O2(l) ΔH2③2H2O2(l)
 2H2O(g)+O2(g) ΔH3
2H2O(g)+O2(g) ΔH3已知反应④2H2(g)+O2(g)=2H2O(g) ΔH4,则反应CO2(g)+2H2(g)
 HCHO(g)+H2O(g) ΔH=
HCHO(g)+H2O(g) ΔH=(2)一定温度下,在一个刚性密闭容器中同时进行反应①和反应②,下列说法正确的是
A.平衡时向容器中充入惰性气体,反应①的平衡正向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.选用合适的催化剂可以提高CH3OH的平衡产率
D.增加H2O2的量,可加快反应速率
E.体系达平衡后,若压缩容器容积,则反应②平衡正向移动
(3)CO2与CH3OH反应可制备HCOOCH3和HCOOH,发生的主要反应如下:
Ⅰ.CH3OH(g)+CO2(g)
 HCOOH(g)+HCHO(g) ΔH5>0
HCOOH(g)+HCHO(g) ΔH5>0Ⅱ.HCOOH(g)+CH3OH(g)
 HCOOCH3(g)+H2O(g) ΔH6>0
HCOOCH3(g)+H2O(g) ΔH6>0Ⅲ.2HCHO(g)
 HCOOCH3(g) ΔH7<0
HCOOCH3(g) ΔH7<0一定温度下,在一装有压强传感器的2 L刚性密闭容器中,充入2.0 mol CH3OH(g)和1.0 mol CO2(g)发生反应Ⅰ、Ⅱ、Ⅲ,测得压强变化如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 | ∞ |
| 压强/kPa | 60 | 57 | 55.5 | 54.5 | 54 | 54 |
①0~20 min内,反应Ⅲ的平均反应速率v(HCHO)=
②CO2的平衡转化率为
③该温度下,反应Ⅱ的压强平衡常数Kp=
④不同压强下,投入足量CH3OH(g)和CO2(g)发生反应Ⅰ、Ⅱ、Ⅲ,实验测定HCOOCH3的平衡产率随温度的变化关系如图所示。随温度升高,HCOOCH3的平衡产率先升高后降低,其原因为

压强p1、p2、p3由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】碳氧化物的转化有重大用途,回答关于CO和 的问题。
的问题。
 已知:
已知: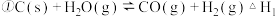
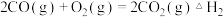
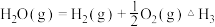
则 的
的
______  用
用 、
、 、
、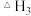 表示
表示 。
。
 对于化学平衡
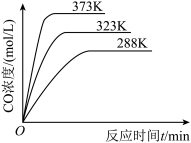
对于化学平衡 ,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
随着温度升高,______ 、______
 某温度下,将
某温度下,将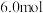
 和足量碳充入3L的恒容密闭容器中,发生如下反应:
和足量碳充入3L的恒容密闭容器中,发生如下反应: ,达到平衡时测得
,达到平衡时测得 为平衡常数
为平衡常数 ,求平衡时
,求平衡时 的转化率
的转化率___________ ? 写出计算过程
写出计算过程
 的问题。
的问题。 已知:
已知: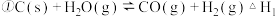
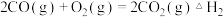
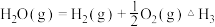
则
 的
的
 用
用 、
、 、
、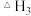 表示
表示 。
。 对于化学平衡
对于化学平衡 ,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:随着温度升高,

 某温度下,将
某温度下,将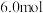
 和足量碳充入3L的恒容密闭容器中,发生如下反应:
和足量碳充入3L的恒容密闭容器中,发生如下反应: ,达到平衡时测得
,达到平衡时测得 为平衡常数
为平衡常数 ,求平衡时
,求平衡时 的转化率
的转化率 写出计算过程
写出计算过程
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为____________ ;2s时物质B的浓度为________ ;
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为_____________ ;若再通入少量B气体,体系中A的物质的量_________ (填“增大”、“减小”或“不变”),若要使A的物质的量再达到与原平衡状态相同,可采取的措施有_____________ 。(填一种措施即可)
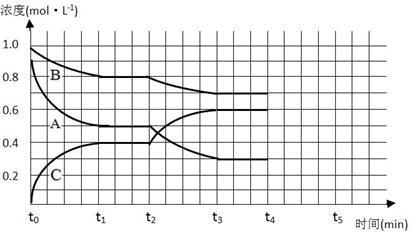
(3)下图是一定条件下该反应过程中,体系内各物质浓度的变化情况。t2时曲线发生变化的原因是_______________ ,若在t4时将B的浓度增大0.l mol·L-1,在t5时刻到达新平衡。请在图中画出各物质浓度的变化情况。_______________________
 2C(g),△H<0。
2C(g),△H<0。(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为
(3)下图是一定条件下该反应过程中,体系内各物质浓度的变化情况。t2时曲线发生变化的原因是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】一种阳极泥的主要成分为Cu、Ag、Pt、Au、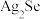 和
和 ,从中回收Se和贵重金属的工艺流程如图所示。
,从中回收Se和贵重金属的工艺流程如图所示。

已知:①该工艺中萃取与反萃取原理为: ;
;
② 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子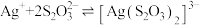 ,常温下该反应的平衡常数
,常温下该反应的平衡常数 。
。
回答下列问题:
(1)试列举可加快“焙烧”速率的措施:_______ (任写一条),写出 焙烧时生成CuO的化学方程式:
焙烧时生成CuO的化学方程式:_______ 。
(2)“滤渣Ⅰ”的主要成分是_______ ;“酸浸氧化”中通入氧气的目的是_______ 。
(3)“沉银”时证明银离子沉淀完全的操作是_______ 。
(4)萃取后得到有机相的操作方法是分液,“反萃取剂”最好选用_______ (填化学式)溶液。
(5)“溶浸”中发生的反应为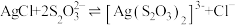 ,该反应中平衡常数K′=
,该反应中平衡常数K′=_______ [已知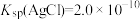 ]。
]。
(6)“滤液Ⅳ”中含有 ,则“还原”中发生反应的离子方程式为
,则“还原”中发生反应的离子方程式为_______ (提示:“滤液Ⅳ”可返回“溶浸”工序循环使用)。
 和
和 ,从中回收Se和贵重金属的工艺流程如图所示。
,从中回收Se和贵重金属的工艺流程如图所示。
已知:①该工艺中萃取与反萃取原理为:
 ;
;②
 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子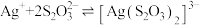 ,常温下该反应的平衡常数
,常温下该反应的平衡常数 。
。回答下列问题:
(1)试列举可加快“焙烧”速率的措施:
 焙烧时生成CuO的化学方程式:
焙烧时生成CuO的化学方程式:(2)“滤渣Ⅰ”的主要成分是
(3)“沉银”时证明银离子沉淀完全的操作是
(4)萃取后得到有机相的操作方法是分液,“反萃取剂”最好选用
(5)“溶浸”中发生的反应为
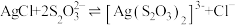 ,该反应中平衡常数K′=
,该反应中平衡常数K′=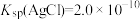 ]。
]。(6)“滤液Ⅳ”中含有
 ,则“还原”中发生反应的离子方程式为
,则“还原”中发生反应的离子方程式为
您最近一年使用:0次
【推荐2】雾霾中有多种污染物,包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)有机物乙烯可以消除氮氧化物的污染。已知:①乙烯的燃烧热 ∆H1=ak·mol-1;②N2(g)+O2(g)=2NO(g) ∆H2=bk·mol-1。则乙烯和NO反应的热化学方程式:C2H4(g)+6NO(g)=2CO2(g)+3N2(g)+2H2O(l) ∆H=___ kJ·mol-1(用字母a、b表示)。
(2)已知SO2(g)+NO2(g) SO3(g)+NO(g)△H=-42kJ·mol-1,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
SO3(g)+NO(g)△H=-42kJ·mol-1,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率
进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率 。部分实验结果如图所示:
。部分实验结果如图所示:

①如果要将图中C点对应的平衡状态改变为B点对应的平衡状态,则应采取的措施是__ (填字母)。
A.升高温度 B.降低温度 C.用更好的催化剂 D.移去SO3
②若A点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,则该时段用NO2表示的平均化学速率为v(NO2)=___ mol·L-1·min-1。
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。每活化1个氧分子放出的能量为__ eV,水可以使氧分子活化反应的活化能降低__ eV。

(4)焦炭催化还原SO2生成S2的反应为2C(s)+2SO2(g) S2(g)+2CO2(g)。实验测得:v正=k正·c2(SO2),v逆=k逆·c(S2)·c2(CO2)(k正、k逆分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为2L的恒容密闭容器中充入1molSO2,并加入足量焦炭,当反应到达平衡时,SO2的转化率为80%,则:
S2(g)+2CO2(g)。实验测得:v正=k正·c2(SO2),v逆=k逆·c(S2)·c2(CO2)(k正、k逆分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为2L的恒容密闭容器中充入1molSO2,并加入足量焦炭,当反应到达平衡时,SO2的转化率为80%,则:
①k正:k逆=_____ 。
②平衡时体系压强为pkPa,Kp为用分压表示的平衡常数(分压=总压×物质的量分数),则平衡常数Kp=__ (用含p的式子表示)。
(1)有机物乙烯可以消除氮氧化物的污染。已知:①乙烯的燃烧热 ∆H1=ak·mol-1;②N2(g)+O2(g)=2NO(g) ∆H2=bk·mol-1。则乙烯和NO反应的热化学方程式:C2H4(g)+6NO(g)=2CO2(g)+3N2(g)+2H2O(l) ∆H=
(2)已知SO2(g)+NO2(g)
 SO3(g)+NO(g)△H=-42kJ·mol-1,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
SO3(g)+NO(g)△H=-42kJ·mol-1,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率
进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率 。部分实验结果如图所示:
。部分实验结果如图所示:
①如果要将图中C点对应的平衡状态改变为B点对应的平衡状态,则应采取的措施是
A.升高温度 B.降低温度 C.用更好的催化剂 D.移去SO3
②若A点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,则该时段用NO2表示的平均化学速率为v(NO2)=
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。每活化1个氧分子放出的能量为

(4)焦炭催化还原SO2生成S2的反应为2C(s)+2SO2(g)
 S2(g)+2CO2(g)。实验测得:v正=k正·c2(SO2),v逆=k逆·c(S2)·c2(CO2)(k正、k逆分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为2L的恒容密闭容器中充入1molSO2,并加入足量焦炭,当反应到达平衡时,SO2的转化率为80%,则:
S2(g)+2CO2(g)。实验测得:v正=k正·c2(SO2),v逆=k逆·c(S2)·c2(CO2)(k正、k逆分别为正、逆反应的速率常数,只与温度有关)。某温度下,在体积为2L的恒容密闭容器中充入1molSO2,并加入足量焦炭,当反应到达平衡时,SO2的转化率为80%,则:①k正:k逆=
②平衡时体系压强为pkPa,Kp为用分压表示的平衡常数(分压=总压×物质的量分数),则平衡常数Kp=
您最近一年使用:0次
【推荐3】I.中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用CH4与CO2制备“合成气”CO、H2,合成气可直接制备甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。
(1)若要该反应自发进行,___________ (填“高温”、“低温”或“任何温度”)更有利。
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g) HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③O2(g)+2H2(g) 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1
则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:___________ 。
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=___________ =___________ 。(第一空写表达式,第二空保留三位有效数字)
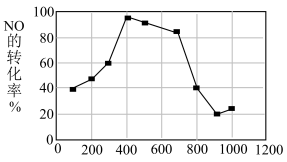
(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是___________ ;___________ 。
 CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。(1)若要该反应自发进行,
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体中碳元素的质量分数不再改变 | B.混合气体的密度不再变化 |
| C.CO的百分含量不再变化 | D.2v(H2)正=v(CO)逆 |
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g)
 HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1③O2(g)+2H2(g)
 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。

A.电解池的阴极电极反应式为2CO2+2e-+H2O=HCOO-+HCO |
| B.b为电源正极 |
| C.电解一段时间后,阳极区的KHCO3 溶液浓度降低 |
| D.若以氢氧碱性燃料电池作直流电源,那么负极的电极反应式为H2-2e-+2OH-=2H2O |
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。

| A.a | B.b | C.c | D.d |
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为
 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】将各种易得的、廉价的资源进行催化重整,可以实现资源的综合利用,对环境保护和实现双碳目标具有十分重要的意义。
已知反应Ⅰ:

反应Ⅱ:
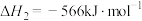
反应Ⅲ:

回答下列问题:
Ⅰ. 和
和 催化重整
催化重整
(1)在恒温恒容的密闭容器中通入等物质的量的 和
和 ,发生反应:
,发生反应:
 。
。
①
_______ 
②下列描述不能说明该反应达到平衡状态的是_______ (填标号)。
A.容器内混合气体的密度保持不变
B.容器内压强保持不变
C. 和
和 的物质的量分数保持不变
的物质的量分数保持不变
D.断裂 键的同时形成
键的同时形成 键
键
③若要提高反应 的平衡混合物中CO的百分含量,可以采取的措施是
的平衡混合物中CO的百分含量,可以采取的措施是_______ (任写一种)。
Ⅱ.甲醇水蒸气催化重整制氢,成本低,产率高。主要反应为 ;副反应为
;副反应为 ,在催化剂中添加助剂
,在催化剂中添加助剂 等,可降低CO的选择性。
等,可降低CO的选择性。
(2)温度为T,向体积为 、
、 的恒容密闭容器中均通入
的恒容密闭容器中均通入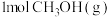 和
和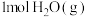 ,仅发生反应
,仅发生反应 ,测得两容器中
,测得两容器中 的体积分数
的体积分数 随时间t的变化曲线如图所示。
随时间t的变化曲线如图所示。

①已知体积为 的容器中,起始压强为
的容器中,起始压强为 ,则
,则 内体积为
内体积为 的容器中的反应速率
的容器中的反应速率
_______  ;达到平衡时的平衡常数
;达到平衡时的平衡常数
_______  (列出计算式即可,
(列出计算式即可, 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
②c点时 的平衡转化率为
的平衡转化率为_______ %(保留3位有效数字)。
(3)已知 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 ,C原子的坐标为
,C原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。

①请在晶胞结构图上指出原子坐标为 的B原子
的B原子_______ 。
②距离Zr原子最近且等距离的Zr原子的数目为_______ 。
③该晶胞的密度为_______  (列出计算式即可)。
(列出计算式即可)。
已知反应Ⅰ:


反应Ⅱ:

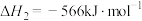
反应Ⅲ:


回答下列问题:
Ⅰ.
 和
和 催化重整
催化重整(1)在恒温恒容的密闭容器中通入等物质的量的
 和
和 ,发生反应:
,发生反应:
 。
。①


②下列描述不能说明该反应达到平衡状态的是
A.容器内混合气体的密度保持不变
B.容器内压强保持不变
C.
 和
和 的物质的量分数保持不变
的物质的量分数保持不变D.断裂
 键的同时形成
键的同时形成 键
键③若要提高反应
 的平衡混合物中CO的百分含量,可以采取的措施是
的平衡混合物中CO的百分含量,可以采取的措施是Ⅱ.甲醇水蒸气催化重整制氢,成本低,产率高。主要反应为
 ;副反应为
;副反应为 ,在催化剂中添加助剂
,在催化剂中添加助剂 等,可降低CO的选择性。
等,可降低CO的选择性。(2)温度为T,向体积为
 、
、 的恒容密闭容器中均通入
的恒容密闭容器中均通入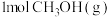 和
和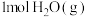 ,仅发生反应
,仅发生反应 ,测得两容器中
,测得两容器中 的体积分数
的体积分数 随时间t的变化曲线如图所示。
随时间t的变化曲线如图所示。
①已知体积为
 的容器中,起始压强为
的容器中,起始压强为 ,则
,则 内体积为
内体积为 的容器中的反应速率
的容器中的反应速率
 ;达到平衡时的平衡常数
;达到平衡时的平衡常数
 (列出计算式即可,
(列出计算式即可, 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。②c点时
 的平衡转化率为
的平衡转化率为(3)已知
 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 ,C原子的坐标为
,C原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①请在晶胞结构图上指出原子坐标为
 的B原子
的B原子②距离Zr原子最近且等距离的Zr原子的数目为
③该晶胞的密度为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】氧化钴(Co2O3)在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石[主要成分为CoO(OH),CoCO3、Cu2(OH)2CO3和SiO2,还有少量Fe、Mg、Ca的氧化物]为原料制备氧化钴(Co2O3)的工艺流程如图所示:

已知:①常温下CoO(OH)不溶于水
②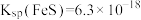 、
、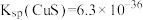 、
、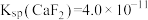 、
、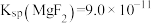
回答下列问题:
(1)Co元素在元素周期表的位置_______ 。
(2)“浸泡”过程中,所得滤渣1的主要成分是_______ (写化学式),写出此过程中CoO(OH)与Na2SO3反应的离子方程式_______ 。
(3)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式_______ 。
(4)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,_______ 。
(5)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为_______ mol∙L-1(溶液中离子浓度小于1.0×10-5mol∙L-1视为该离子沉淀完全)。
(6)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是_______ 。
(7)CoO的面心立方晶胞如图所示,设阿伏加德罗常数的值为NA,则CoO晶体的密度为_______  (用含NA的代数式表示)。
(用含NA的代数式表示)。


已知:①常温下CoO(OH)不溶于水
②
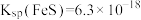 、
、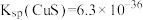 、
、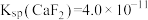 、
、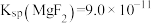
回答下列问题:
(1)Co元素在元素周期表的位置
(2)“浸泡”过程中,所得滤渣1的主要成分是
(3)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式
(4)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,
(5)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为
(6)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是
(7)CoO的面心立方晶胞如图所示,设阿伏加德罗常数的值为NA,则CoO晶体的密度为
 (用含NA的代数式表示)。
(用含NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】2050年新能源使用的比重将达到50%。实现新能源的转换,是人类社会和科技进步必须实施的一项全球性的任务。最近科学家通过含第VIII族元素物质制得了纳米CoFe2O4和NiFe2O4,该纳米材料可有效改善固体推进剂的燃速和压力指数。请回答下列问题:
(1)Co属于元素周期表中_______ 区元素,其基态原子的价电子排布式为_______ 。
(2)第VIII族元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知Fe(CO)5的沸点103℃,常温下为浅黄色液体,则Fe(CO)5中含有的化学键类型包括______ (填选项标号)。
a.极性键 b.非极性键 c.配位键 d.离子键 e.金属键
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示,该分子中碳原子的杂化方式有_______ ;该配合物中除氢外的非金属元素第一电离能由大到小的顺序是_______ 。

(4)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是______ 。
(5)黄铜矿的主要成分是由铁、铜、硫三种元素构成的化合物,其晶胞结构如下图所示,该晶胞上下底面为正方形,侧面与底面垂直。

①一个晶胞中有____ 个Cu原子,晶体中与一个Cu原子键合的S原子有_____ 个。
②已知:NA为阿伏加德罗常数的值,根据如图中所示的数据可得该晶体的密度是_____ g·cm-3(列出计算式)。
(1)Co属于元素周期表中
(2)第VIII族元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知Fe(CO)5的沸点103℃,常温下为浅黄色液体,则Fe(CO)5中含有的化学键类型包括
a.极性键 b.非极性键 c.配位键 d.离子键 e.金属键
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示,该分子中碳原子的杂化方式有

(4)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是
(5)黄铜矿的主要成分是由铁、铜、硫三种元素构成的化合物,其晶胞结构如下图所示,该晶胞上下底面为正方形,侧面与底面垂直。

①一个晶胞中有
②已知:NA为阿伏加德罗常数的值,根据如图中所示的数据可得该晶体的密度是
您最近一年使用:0次



