名校
解题方法
1 . 探究溶液中Ag+与单质S的反应。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有__________ 性,推测b中可能含有Ag2S、Ag、Ag2SO3或Ag2SO4。
②检验黑色固体b的成分______ 。
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是______ (填序号)。
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:_________________ 。
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在 或H2SO3,依据是
或H2SO3,依据是_______________ 。___________________ 。
②加入足量稀盐酸的作用是_________________ 。
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是__________________ 。
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:_______________ 。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有
②检验黑色固体b的成分
实验Ⅱ.
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在
 或H2SO3,依据是
或H2SO3,依据是实验Ⅲ.
②加入足量稀盐酸的作用是
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:
您最近一年使用:0次
名校
解题方法
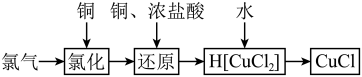
2 . 氯化亚铜为白色难溶于水,不溶于乙醇的固体。可用作催化剂、脱色剂,实验室制备它的流程之一如下: 的装置如图所示:
的装置如图所示:
(1)B中试剂是________ (填名称),装置A中发生反应的物质不可能是下列中的___________ (填标号)。
A. 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO
(2)适合点燃C处酒精灯的标志是______________ ,进入C处反应装置中的气体中含有少量HCl,实验中没有除去HCl的原因是________________________ 。
(3)试剂a可以是NaOH,也可以是_________ (填一种),写出NaOH与尾气主要反应的化学方程式____________________ 。
(4)“还原”过程中浓盐酸的作用是_____________ 。向 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是____________________ 。
 的装置如图所示:
的装置如图所示: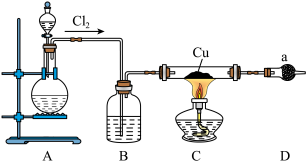
(1)B中试剂是
A.
 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO(2)适合点燃C处酒精灯的标志是
(3)试剂a可以是NaOH,也可以是
(4)“还原”过程中浓盐酸的作用是
 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
您最近一年使用:0次
名校
3 . 某研究小组试探究1,6-己二硫醇(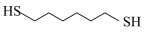 ,用HDT表示)与铜的反应历程。
,用HDT表示)与铜的反应历程。
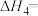
化学键 | C-H | C-C | H-H |
键能/ | 413 | 347 | 436 |
(2)温度一定时,在隔绝空气的条件下使HDT(g)以恒定的流速通过如甲图所示的反应器,仅发生反应Ⅰ、Ⅱ、Ⅲ,在反应器出口处实时检测各物质的相对含量如图乙所示。
②推测
 在该实验条件下与Cu反应生成烃类产物的名称为
在该实验条件下与Cu反应生成烃类产物的名称为(3)向恒温刚性容器M中充入己烷(g)和HDT(g),初始总压为2.5Pa,己烷的体积分数为80%。容器M中只发生反应Ⅳ,达平衡时,己烷的转化率为50%,则反应Ⅳ的

(
 )
)
您最近一年使用:0次
2024-05-30更新
|
76次组卷
|
2卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
名校
4 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①Co(OH)2为浅青色沉淀
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
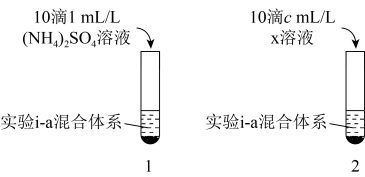
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是___________ ,c=___________ 。___________ 。
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:___________ ;反应的离子方程式为:___________ 。
| 实验序号 | 操作 | 现象 | |
| 实验i:[Cu(NH3)4]2+的配制 | 实验i-a | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的6mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合CuSO4溶液和NH3·H2O溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
| 实验ii:[Co(NH3)6]2+的配制 | 实验ii-a | 在试管内混合CoCl2溶液和过量6mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合CoCl2溶液和过量14mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 | |
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:
您最近一年使用:0次
名校
5 . 草酸钴在化学中应用广泛,可用于制备催化剂等。以钻矿[主要成分为 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1) 位于元素周期表中第
位于元素周期表中第___________ 周期第___________ 族。
(2)浸出渣的主要成分是___________ (填化学式)。“浸取”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)“氧化”过程中消耗 的量明显偏高的原因是
的量明显偏高的原因是___________ (用化学方程式表示)。
(4)取“调节 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为___________ 。
(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是___________ 。反萃取时,应加入___________ 。
(6)取 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为___________  。
。
 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1)
 位于元素周期表中第
位于元素周期表中第(2)浸出渣的主要成分是
 发生反应的化学方程式为
发生反应的化学方程式为(3)“氧化”过程中消耗
 的量明显偏高的原因是
的量明显偏高的原因是(4)取“调节
 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂
 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是(6)取
 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为 。
。
您最近一年使用:0次
名校
解题方法
6 . CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铁矿,飞机上天全靠它。铼(Re)是一种稀散金属,广泛应用于航空航天领域。工业上从高铼废料(含 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示: 。
。
回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为___________ 。该工序中,ReS2发生反应的化学方程式为___________ 。
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。___________ 。
②其他条件相同,混合溶液的pH>1.5时, 的提取率降低的主要原因为
的提取率降低的主要原因为___________ 。
(3)“反萃取”时,选用的试剂X为盐酸的理由为___________ 。
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以 形式存在):
形式存在):___________ 方法提纯高铼酸铵晶体。
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为___________ ;晶体密度为___________ g∙cm-3 (列出含a、b、NA的计算表达式,NA表示阿伏加德罗常数的值)。
 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示:
 。
。回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与
 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。
②其他条件相同,混合溶液的pH>1.5时,
 的提取率降低的主要原因为
的提取率降低的主要原因为(3)“反萃取”时,选用的试剂X为盐酸的理由为
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以
 形式存在):
形式存在):
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为

您最近一年使用:0次
7 . 研究 的综合利用具有重要的意义。
的综合利用具有重要的意义。
Ⅰ. 催化重整制氢气
催化重整制氢气
一种 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为 ,进行步骤Ⅱ。
,进行步骤Ⅱ。___________ 。
(2)步骤Ⅱ中还存在少量副反应: ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是___________ 。
②反应进行 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是___________ 。
Ⅱ. 用于烟气脱硝
用于烟气脱硝
(3) 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:
反应Ⅰ

反应Ⅱ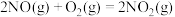

反应Ⅲ
①反应Ⅲ的
___________  。
。
②反应Ⅰ和反应II的平衡常数分别为 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
___________ (用 、
、 表示)。
表示)。
(4)模拟烟气脱硝:一定条件下,将 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是___________ 。
②当温度高于 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是___________ 。
 的综合利用具有重要的意义。
的综合利用具有重要的意义。Ⅰ.
 催化重整制氢气
催化重整制氢气一种
 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为 ,进行步骤Ⅱ。
,进行步骤Ⅱ。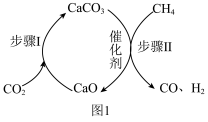
(2)步骤Ⅱ中还存在少量副反应:
 ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。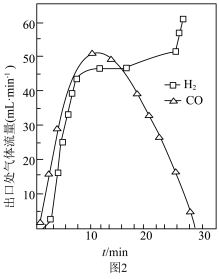
 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是②反应进行
 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是Ⅱ.
 用于烟气脱硝
用于烟气脱硝(3)
 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:反应Ⅰ


反应Ⅱ
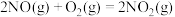

反应Ⅲ

①反应Ⅲ的

 。
。②反应Ⅰ和反应II的平衡常数分别为
 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
 、
、 表示)。
表示)。(4)模拟烟气脱硝:一定条件下,将
 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。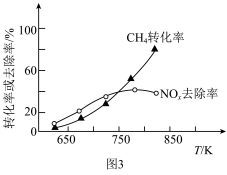
 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是②当温度高于
 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是
您最近一年使用:0次
名校
8 . CO2的资源化利用具有重要的意义。合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现:
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为_______ ;该反应自发进行的条件是_______ (填“低温”、“高温”或“任意条件“”)。
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是_______ 。
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。_______ 。
②控制电压为0.8V,电解时转移电子的物质的量为_______ mol。
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
反应2:H2(g)+CO2(g) H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol
恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。_______ (写出计算式即可)。
(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=_______ 。
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。
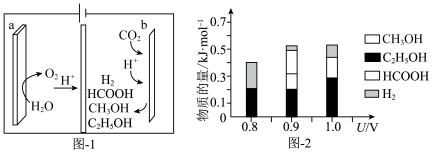
②控制电压为0.8V,电解时转移电子的物质的量为
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol反应2:H2(g)+CO2(g)
 H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
| A.n(CO)保持不变说明容器已经达到平衡状态 |
| B.容器中气体密度不变能说明反应已经达到平衡状态 |
| C.恒容向容器中充入He,CH4平衡转化率变小 |
| D.如果将容器体积缩小为1L,则反应1的化学反应速率变快,反应2不变 |
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。

(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=
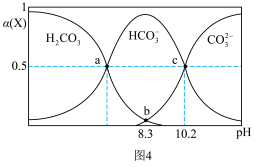
您最近一年使用:0次
解题方法
9 . 工业上利用软锰矿(主要成分为 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。
②不同金属离子生成氢氧化物沉淀的pH如下表:
③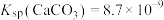 ,
,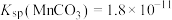 。
。
回答下列问题:
(1)下列说法正确的是________(填序号)。
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是________ 。
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有________ 。如果没有前期的“氧化”环节,pH就需要调节到更大的数值,这样会导致________ 。
(4)“沉锰”过程中加入氨水的目的是________ (从化学平衡移动的角度解释)。“沉锰”过程宜在较低温度下进行,可能的原因是________ (写1条即可)。“沉锰”时通过控制合理的pH,就可以控制 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是________ 。
 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。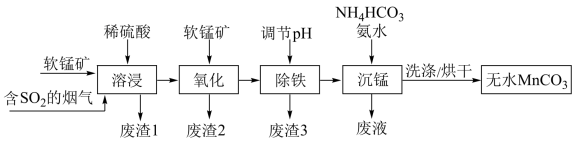
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。②不同金属离子生成氢氧化物沉淀的pH如下表:
| 离子 |  |  |  |
| 开始沉淀时pH | 2.7 | 7.5 | 7.8 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.8 |
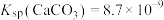 ,
,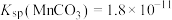 。
。回答下列问题:
(1)下列说法正确的是________(填序号)。
| A.最好使用粉状软锰矿进行“溶浸” | B.废渣1的主要成分和“芯片”相同 |
| C.溶浸时不会发生氧化还原反应 | D.废液经处理可用于灌溉农作物 |
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有
(4)“沉锰”过程中加入氨水的目的是
 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是
您最近一年使用:0次
名校
10 . 过氧化锶( )通常用作分析试剂、氧化剂、漂白剂等。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)通常用作分析试剂、氧化剂、漂白剂等。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
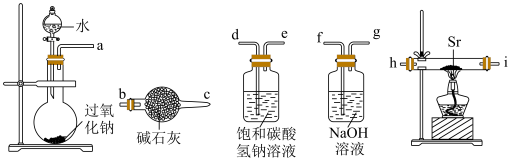
③连接好装置进行实验,实验步骤如下,正确的操作顺序为
a、打开分液漏斗活塞,将水滴入烧瓶中b、检查装置气密性c、在相应装置中装入药品d、加热e、关闭分液漏斗活塞f、停止加热
(2)乙同学在通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
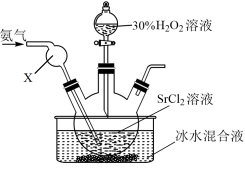
②写出该方法制备SrO2·8H2O的离子方程式
③实验结束后,得到SrO2·8H2O的操作为
(3)除SrO2·8H2O外,请选择下列试剂:FeCl2溶液、HCl溶液、HNO3溶液、KSCN溶液、H2O2溶液设计实验证明SrO2的氧化性比FeCl3的氧化性强:
您最近一年使用:0次