名校
1 . 特定催化剂作用下乙酸加氢制备乙醇的反应如下:
主反应:
副反应: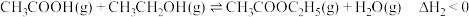
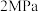 下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化;
下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化; 下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图:
下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图: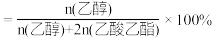
②副反应热效应小,放出的热量可忽略
下列说法错误的是
主反应:

副反应:
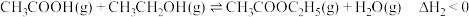
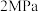 下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化;
下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化; 下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图:
下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图:
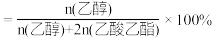
②副反应热效应小,放出的热量可忽略
下列说法错误的是
A.恒温恒压密闭容器中,按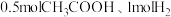 和 和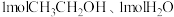 分别投料,达平衡时热量变化分别为 分别投料,达平衡时热量变化分别为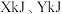 ,则 ,则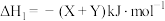 |
B.恒温恒压下,向体积为 的密闭容器中通入 的密闭容器中通入 和 和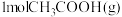 ,平衡时 ,平衡时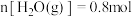 ,体积减小20%,主反应的平衡常数 ,体积减小20%,主反应的平衡常数 |
C. 时,S(乙醇)随压强变化的曲线为a; 时,S(乙醇)随压强变化的曲线为a; 时,S(乙醇)随温度的变化曲线为c 时,S(乙醇)随温度的变化曲线为c |
D. 时, 时, 和 和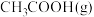 反应一段时间后,乙醇的选择性位于m点,其他条件不变,增大压强一定能提高乙醇选释性 反应一段时间后,乙醇的选择性位于m点,其他条件不变,增大压强一定能提高乙醇选释性 |
您最近一年使用:0次
7日内更新
|
45次组卷
|
2卷引用:2024届山东省潍坊市四县联考高三下学期三模化学试题
名校
解题方法
2 . 氙的氟化物是优良的氟化剂,稀有气体Xe和F2混合在催化剂作用下同时存在如下反应:
反应I:
反应Ⅱ: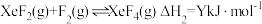
反应Ⅲ: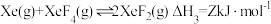
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
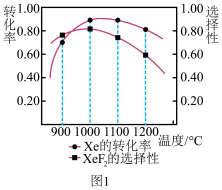
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为_______ ;当超过1000℃,XeF2选择性随着温度升高而降低的可能原因是_______ 。
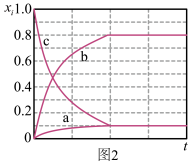
(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是_______ ,则反应过程能量变化为_______ kJ(用含X、Y的代数式表示),F2的转化率为_______ ,反应I以物质的量分数表示的平衡常数Kx=_______ 。
(3)在1000℃时,反应Ⅲ的平衡常数Kp=_______ ,保持初始其他条件不变,反应达平衡后增大体系压强,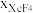 的变化趋势为
的变化趋势为_______ (填“增大”“减小”或“不变”)。
反应I:

反应Ⅱ:
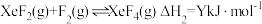
反应Ⅲ:
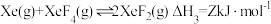
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为

(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是

(3)在1000℃时,反应Ⅲ的平衡常数Kp=
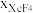 的变化趋势为
的变化趋势为
您最近一年使用:0次
2023-01-15更新
|
527次组卷
|
3卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
山东省潍坊市2022-2023学年高三上学期期末考试化学试题(已下线)化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题
名校
3 . 硝酸厂常用催化还原法处理尾气, 在催化条件下可以将
在催化条件下可以将 还原为
还原为 ,反应原理为
,反应原理为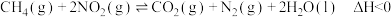 ,
, 的平衡转化率随温度或压强的变化如图所示。下列说法正确的是
的平衡转化率随温度或压强的变化如图所示。下列说法正确的是

 在催化条件下可以将
在催化条件下可以将 还原为
还原为 ,反应原理为
,反应原理为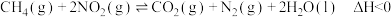 ,
, 的平衡转化率随温度或压强的变化如图所示。下列说法正确的是
的平衡转化率随温度或压强的变化如图所示。下列说法正确的是
A.速率大小: |
B. |
C.平衡常数: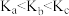 |
D.使用合适的催化剂, 的平衡转化率增大 的平衡转化率增大 |
您最近一年使用:0次
2022-11-17更新
|
375次组卷
|
3卷引用:山东省潍坊安丘市2022-2023学年高二上学期期中考试化学试题
山东省潍坊安丘市2022-2023学年高二上学期期中考试化学试题福建省泉州市永春第一中学2022-2023学年高二上学期期末考试化学试题(已下线)第06讲 化学反应速率与化学平衡的图像-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
名校
4 . 一定温度下,密闭容器中发生反应: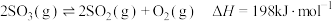 。当反应达到平衡后,下列各项措施不能提高SO3转化率的是
。当反应达到平衡后,下列各项措施不能提高SO3转化率的是
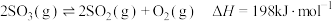 。当反应达到平衡后,下列各项措施不能提高SO3转化率的是
。当反应达到平衡后,下列各项措施不能提高SO3转化率的是| A.升高反应的温度 | B.增大容器的体积 |
| C.分离出部分氧气 | D.容积不变,通入气体He |
您最近一年使用:0次
2022-11-17更新
|
250次组卷
|
2卷引用:山东省潍坊安丘市2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . 下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某无色溶液中滴加足量稀盐酸 | 产生白色沉淀 | 溶液中一定存在 |
| B | 分别向饱和硼酸溶液和稀硫酸溶液中加入少量 粉末 粉末 | 前者无气泡冒出,后者有气泡冒出 | 非金属性:S>C>B |
| C | 密闭容器中盛有 ,一段时间后反应达平衡,压缩体积至原来的一半 ,一段时间后反应达平衡,压缩体积至原来的一半 | 气体颜色加深 | 平衡向生成 的方向移动 的方向移动 |
| D | 向两支试管中加入等体积等浓度的 溶液,再分别滴入等体积等浓度的 溶液,再分别滴入等体积等浓度的 溶液和 溶液和 溶液 溶液 | 后者产生气泡速度快 | 催化效果 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-11更新
|
208次组卷
|
4卷引用:山东省潍坊市(安丘、诸城、高密)三县市2022-2023学年高三10月联考化学试题
名校
6 . 下列事实中,不能用勒·夏特列原理加以解释的是
| A.缩小容器的体积,由H2(g)、I2(g)、HI(g)组成的平衡体系颜色变深 |
| B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体 |
| C.合成氨时选择加压作为反应条件 |
| D.新制的氯水在光照下颜色变浅 |
您最近一年使用:0次
2022-09-26更新
|
353次组卷
|
2卷引用:山东省潍坊实验中学2022-2023学年高二上学期第一次单元过关检测化学试题
7 . 恒容密闭容器中充入3 mol CH4和6 mol H2S,发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是
CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是

 CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是
CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是
| A.当满足v逆(H2S)=2v正(H2)时,反应达到平衡状态 |
| B.高温、低压条件有利于提高CH4的平衡转化率 |
| C.M点时,保持温度不变,继续充入3 mol CH4和6 mol H2S,达到新平衡时,CH4的物质的量分数小于H2 |
D.图中N点对应温度下,以物质的量分数表示的化学平衡常数Kx= |
您最近一年使用:0次
名校
解题方法
8 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______ mol·L-1·min-1(用含t1的代数式表示);
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________
(3)在该温度下,反应的标准平衡常数Kθ=____ 。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)⇌gG(g)+hH(g) Kθ= ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。

(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
(3)在该温度下,反应的标准平衡常数Kθ=
 ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
您最近一年使用:0次
11-12高二下·陕西宝鸡·期中
名校
9 . 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol•L﹣1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol•L﹣1,下列有关判断正确的是
| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率增大 | D.C的体积分数下降 |
您最近一年使用:0次
2023-09-22更新
|
221次组卷
|
75卷引用:2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷
(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期中考试化学试题(已下线)2013届江西省丰城中学高三阶段测试化学试卷2015-2016学年湖北省宜昌葛洲坝中学高二上学期期中测试化学试卷2016届辽宁师范大学附属中学高三上学期期中考试化学试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高二上期末化学卷2016届河南省信阳市鸡公山风景区学校高三下2月月考化学试卷2017届黑龙江牡丹江高级中学高三上期中化学卷云南省玉溪市第一中学2016-2017学年高二下学期期中考试化学试题广西桂林市第十八中学2016-2017学年高二下学期期中考试化学试题辽宁省庄河市高级中学2017-2018学年高二10月月考化学试题广东省阳东广雅学校2017-2018学年高二10月月考化学试题山西省运城中学、芮城中学2017-2018学年高二上学期期中联考化学试题内蒙古包头市第一中学2017-2018学年高二上学期期中考试化学试题陕西省西安市“八校”2018届高三联考化学试题【全国百强校】河北省武邑中学2019届高三上学期期中考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题辽宁省本溪市第一中学2018-2019学年高二上学期期末考试化学试题【区级联考】上海市黄浦区2019届高三第一学期期末(一模)学科质量检测化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题1重庆市万州二中2019-2020学年高二上学期入学考试化学试题重庆市万州第二高级中学2019-2020学年高二入学考试化学试题安徽省铜陵市第一中学2019-2020学年高二上学期期中考试化学试题四川省广元川师大万达中学2019-2020学年高二上学期期中考试化学试题安徽省合肥市六校2019-2020学年高二上学期期末考试化学(理)试题湖南省益阳市2019-2020学年高二上学期期末统考化学试题内蒙古包头市第六中学2019-2020学年高二上学期期中考试化学试题四川省广元市剑门关中学2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题湖北省黄冈市黄梅国际育才高级中学2018-2019学年高二下学期3月月考化学试题安徽省六安市第一中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)上海市行知中学2019-2020学年高三上学期期中考化学试题(已下线)2.3.1化学平衡状态(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期实验班第一次月考化学试题湖南省邵东县第一中学2020-2021学年高二上学期第一次月考化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题山西省运城市景胜中学2020-2021学年高二10月月考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题河南省洛阳市新安县第一高级中学2020-2021学年高二10月月考化学试题内蒙古自治区包头市第六中学2020-2021学年高二上学期期中考试化学试题贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题重庆市石柱中学2020-2021学年高二上学期第一次月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题广西南宁市宾阳县宾阳中学2021-2022学年高二上学期期中考试化学(理科)试题吉林省长春市东北师大附中2021-2022学年高二上学期阶段测试化学试题辽宁省大连市2021-2022学年高三上学期双基测试化学试题辽宁省大连市2021-2022学年高二上学期期末联考化学试题山东省菏泽市2021-2022学年高二上学期期末教学质量检测化学试题(已下线)二轮拔高卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)重庆市缙云教育联盟2022届高三第二次诊断性检测化学试题(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)上海市宜川中学2021-2022学年高一下学期期末考试化学试题湖南省益阳市2022-2023学年高三上学期 9月质量检测化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题湖南省祁东县育贤中学2022-2023学年高二上学期第一次月考化学试题湖南省益阳市2020-2021学年高二上学期期末考试化学试题陕西师范大学附属中学2022-2023学年高一下学期6月期末考试化学试题河北省昌黎第一中学2023届高三下学期第七次调研考试化学试题山东省菏泽第一中学2022-2023学年高二上学期期末考试模拟检测化学试题(已下线)第2讲 化学平衡状态及化学平衡的移动北京市东直门中学2022-2023学年高二上学期期中考试化学试题广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题云南省中央民族大学附属中学昆明五华实验学校2023-2024学年高二上学期期中考试化学试题四川省绵阳南山实验中学2023-2024学年高二上学期期中考试化学试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷四川省广安市华蓥中学2023-2024学年高二上学期11月月考化学试题2023-2024学年高二化学下学期月考1试卷 四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题陕西省宝鸡市扶风县法门高中2023-2024学年高二上学期期中考试化学试题贵州神贵阳市2023-2024学年清镇市博雅实验学校高二上学期第四次月考化学试卷
名校
10 . 工业生产硝酸过程中,反应I、II均会在氧化炉内发生。不同温度下,反应I、II的化学平衡常数如下表所示。下列说法正确的是
| 温度 (K) | 化学平衡常数 | |
| 反应I:4NH3+5O2⇌4NO+6H2O | 反应II:4NH3+3O2⇌2N2+6H2O | |
| 500 | 1.1×1026 | 7.1×1034 |
| 700 | 2.1×1019 | 2.6×1025 |
| A.反应I、II的ΔH均大于0 |
| B.氧化炉内NH3主要发生反应II |
| C.改变氧化炉的压强可促进反应I而抑制反应II |
| D.使用选择性催化反应I的催化剂,可增大氧化炉中NO的含量 |
您最近一年使用:0次
2021-11-12更新
|
257次组卷
|
3卷引用:山东省潍坊市2021-2022学年高二上学期第一学段期中监测化学试题



