氙的氟化物是优良的氟化剂,稀有气体Xe和F2混合在催化剂作用下同时存在如下反应:
反应I:
反应Ⅱ: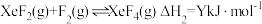
反应Ⅲ: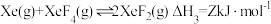
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
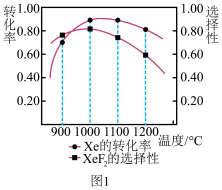
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为_______ ;当超过1000℃,XeF2选择性随着温度升高而降低的可能原因是_______ 。
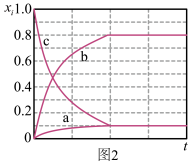
(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是_______ ,则反应过程能量变化为_______ kJ(用含X、Y的代数式表示),F2的转化率为_______ ,反应I以物质的量分数表示的平衡常数Kx=_______ 。
(3)在1000℃时,反应Ⅲ的平衡常数Kp=_______ ,保持初始其他条件不变,反应达平衡后增大体系压强,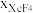 的变化趋势为
的变化趋势为_______ (填“增大”“减小”或“不变”)。
反应I:

反应Ⅱ:
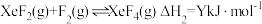
反应Ⅲ:
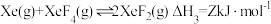
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为

(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是

(3)在1000℃时,反应Ⅲ的平衡常数Kp=
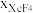 的变化趋势为
的变化趋势为
22-23高三上·山东潍坊·期末 查看更多[3]
山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题(已下线)化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)山东省潍坊市2022-2023学年高三上学期期末考试化学试题
更新时间:2023-01-15 09:40:26
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】氮元素能够形成多种化合物。请回答下列问题:
 联氨
联氨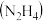 常温下为液态,在空气中迅速完全燃烧生成
常温下为液态,在空气中迅速完全燃烧生成 ,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知: 的燃烧热为
的燃烧热为
 ;
;
 ;
;
则 在空气中燃烧生成气态水的热化学方程式为
在空气中燃烧生成气态水的热化学方程式为______ 。
 工业上利用氨气生产氢氰酸
工业上利用氨气生产氢氰酸 的反应为
的反应为
 。
。
 一定温度下,向2L恒容容器中充入1mol
一定温度下,向2L恒容容器中充入1mol  和2mol
和2mol  发生上述反应,8min达到平衡时,测得
发生上述反应,8min达到平衡时,测得 的转化率为
的转化率为 ,
, 内,用
内,用 表示的该反应速率v
表示的该反应速率v 
______ 。
保持温度和容积不变,再向平衡后的容器中充入
 和
和 HCN,此时
HCN,此时
______  选填“
选填“ ”“
”“ ”或“
”或“ ”
” 。
。
 在
在 下,将a
下,将a 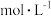 的NaCN溶液与
的NaCN溶液与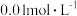 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液 ,则a
,则a______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;用含a的代数式表示HCN的电离常数
;用含a的代数式表示HCN的电离常数
______ 。
 能够和
能够和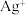 形成
形成 。
。
 溶液中存在
溶液中存在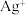



 时,其平衡常数的表达式为
时,其平衡常数的表达式为
______ 。
 常温下,
常温下, ,反应AgCl
,反应AgCl 


 的化学平衡常数
的化学平衡常数 ,则
,则
______ 。
 高剂量的亚硝酸盐有很大毒性,电化学降解
高剂量的亚硝酸盐有很大毒性,电化学降解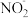 的原理如图:
的原理如图:

 阴极反应式为
阴极反应式为______ 。
 若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差
若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差 为
为______ g。
 联氨
联氨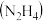 常温下为液态,在空气中迅速完全燃烧生成
常温下为液态,在空气中迅速完全燃烧生成 ,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。已知:
 的燃烧热为
的燃烧热为
 ;
;
 ;
;
则
 在空气中燃烧生成气态水的热化学方程式为
在空气中燃烧生成气态水的热化学方程式为 工业上利用氨气生产氢氰酸
工业上利用氨气生产氢氰酸 的反应为
的反应为
 。
。 一定温度下,向2L恒容容器中充入1mol
一定温度下,向2L恒容容器中充入1mol  和2mol
和2mol  发生上述反应,8min达到平衡时,测得
发生上述反应,8min达到平衡时,测得 的转化率为
的转化率为 ,
, 内,用
内,用 表示的该反应速率v
表示的该反应速率v 
保持温度和容积不变,再向平衡后的容器中充入

 和
和 HCN,此时
HCN,此时
 选填“
选填“ ”“
”“ ”或“
”或“ ”
” 。
。 在
在 下,将a
下,将a 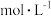 的NaCN溶液与
的NaCN溶液与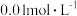 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液 ,则a
,则a 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;用含a的代数式表示HCN的电离常数
;用含a的代数式表示HCN的电离常数
 能够和
能够和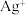 形成
形成 。
。 溶液中存在
溶液中存在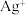



 时,其平衡常数的表达式为
时,其平衡常数的表达式为
 常温下,
常温下, ,反应AgCl
,反应AgCl 


 的化学平衡常数
的化学平衡常数 ,则
,则
 高剂量的亚硝酸盐有很大毒性,电化学降解
高剂量的亚硝酸盐有很大毒性,电化学降解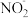 的原理如图:
的原理如图:
 阴极反应式为
阴极反应式为 若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差
若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差 为
为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】汽车尾气中含有上百种不同的化合物,其中的污染物有固体悬浮颗粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等,一辆轿车一年排放的有害废气比自身重量大3倍。其中NO气体是由于内燃机燃烧的高温引起N2和O2反应所致:N2(g)+O2(g) 2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向4L密闭容器中充入N2和O2各4mol,平衡时,5分钟后O2的物质的量为1mol,则N2的反应速率是____________ 。
(2)恒容条件下,判断该反应达到平衡的标志是________ 。(填字母序号)。
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
(4)可逆反应N2(g)+O2(g) 2NO(g)的平衡常数表达式为
2NO(g)的平衡常数表达式为____________ 。温度升高,平衡常数将会_____________ (填“增大、或“减小”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应___________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(6)火箭燃料N2H4(肼)在NO2中燃烧,生成N2、液态水。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+67kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
由此请写出发射火箭时燃烧反应的热化学方程式____________________ 。
 2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:(1)某温度下,向4L密闭容器中充入N2和O2各4mol,平衡时,5分钟后O2的物质的量为1mol,则N2的反应速率是
(2)恒容条件下,判断该反应达到平衡的标志是
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是
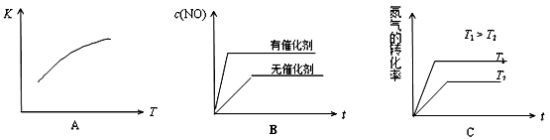
(4)可逆反应N2(g)+O2(g)
 2NO(g)的平衡常数表达式为
2NO(g)的平衡常数表达式为(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应
(6)火箭燃料N2H4(肼)在NO2中燃烧,生成N2、液态水。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+67kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
由此请写出发射火箭时燃烧反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】 乙烷裂解制乙烯具有成本低。收率高、投资少、污染小等优点。目前裂解方法有电催化、光催化裂解、直接裂解、氧气或二氧化碳氧化乙烷裂解等。回答下列问题:
(1)乙烷直接裂解时温度、压强及平衡转化率的关系如图所示:

①反应的ΔH_______ 0,p1______ p2(填“>”、“<”或 “=”)。
②T°C时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m% )通入一密闭容器中发生反应C2H6(g) C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为
C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为______ KPa,反应的平衡常数Kp=______ KPa(用分压表示,分乐=总压×物质的量分数)。
(2)已知乙烷直接裂解、CO2氧化裂解和O2氧化裂解反应如下:
(I) C2H6(g) C2H4(g)+H2(g) ΔH1
C2H4(g)+H2(g) ΔH1
(II) CO2(g)+C2H6(g) C2H4(g)+CO(g)+H2O(g) ΔH2
C2H4(g)+CO(g)+H2O(g) ΔH2
(III) 2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g) ΔH3
2C2H4(g)+2H2O(g) ΔH3
①反应(I)、(II)的平衡常数分别为K1、K2,则反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数为K=
CO(g)+H2O(g)的平衡常数为K=_______ (用含K1、K2的代数式表示)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的有______ 。
A.加入反应(I)的催化剂,可降低反应的焓变
B.恒压掺入Ar能提高反应(II)的平衡产率
C.降低温度,反应(III)的正反应速率降低、逆反应速率增大
D.增加乙烷的浓度,反应(I) (II)(III)的平衡均向右移动
③在800°C时发生反应(III),乙烷的转化率、乙烯的选择性和收率随投料比 的变化关系如图所示,控制
的变化关系如图所示,控制 =2,而不采用选择性更高的
=2,而不采用选择性更高的 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是_____ ; <2时,
<2时, 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是______ 。
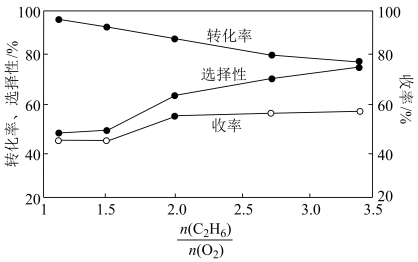
(1)乙烷直接裂解时温度、压强及平衡转化率的关系如图所示:

①反应的ΔH
②T°C时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m% )通入一密闭容器中发生反应C2H6(g)
 C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为
C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为(2)已知乙烷直接裂解、CO2氧化裂解和O2氧化裂解反应如下:
(I) C2H6(g)
 C2H4(g)+H2(g) ΔH1
C2H4(g)+H2(g) ΔH1(II) CO2(g)+C2H6(g)
 C2H4(g)+CO(g)+H2O(g) ΔH2
C2H4(g)+CO(g)+H2O(g) ΔH2(III) 2C2H6(g)+O2(g)
 2C2H4(g)+2H2O(g) ΔH3
2C2H4(g)+2H2O(g) ΔH3①反应(I)、(II)的平衡常数分别为K1、K2,则反应CO2(g)+H2(g)
 CO(g)+H2O(g)的平衡常数为K=
CO(g)+H2O(g)的平衡常数为K=②上述反应体系在一定条件下建立平衡后,下列说法正确的有
A.加入反应(I)的催化剂,可降低反应的焓变
B.恒压掺入Ar能提高反应(II)的平衡产率
C.降低温度,反应(III)的正反应速率降低、逆反应速率增大
D.增加乙烷的浓度,反应(I) (II)(III)的平衡均向右移动
③在800°C时发生反应(III),乙烷的转化率、乙烯的选择性和收率随投料比
 的变化关系如图所示,控制
的变化关系如图所示,控制 =2,而不采用选择性更高的
=2,而不采用选择性更高的 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是 <2时,
<2时, 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】聚丙烯是生产医用无纺布口罩及防护服的材料。丙烯是制造聚丙烯的单体。工业上制备丙烯的方法有多种,回答下列问题:
Ⅰ.以异丙醇为原料制备丙烯。已知:
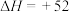 kJ⋅mol
kJ⋅mol 。
。
已知几种共价键键能如表所示:
(1)该反应在______ (填“较高”“较低”或“任意”)温度下能自发进行。
(2)C=C键键能为______ kJ⋅mol 。
。
Ⅱ.中国某课题组开发富含硼氧活性位点的热稳定层柱状框架类材料助力丙烷氧化脱氢。
有关反应如下:
反应1: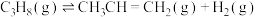

反应2: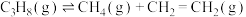

(3)向密闭容器中充入1 mol ,同时发生反应1和反应2,升高温度,氢气的体积分数增大。
,同时发生反应1和反应2,升高温度,氢气的体积分数增大。
当达到平衡时,测得丙烯的体积分数与温度、压强的关系如图1所示。
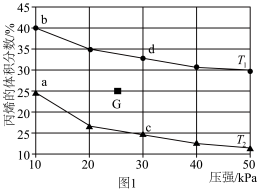
①其他条件相同,增大压强,丙烯体积分数减小的原因是____________ 。
②b点时丙烯与乙烯的体积之比为10∶1,丙烷的平衡转化率为______ (保留3位有效数字)。
③下列物理量中,图中c点大于d点的是______ (填标号)。
A.正反应速率 B.对应温度下反应1的平衡常数
C.逆反应速率 D.平均摩尔质量
④当降温的同时,缩小容器的体积,G点对应的平衡体系达到新平衡时丙烯的体积分数可能对应图中的______ (填“a”“b”“c”或“d”)点。
(4)一定温度下,总压保持为p时,向反应器中充入 和
和 ,发生反应1和反应2,测得丙烷的平衡转化率与投料比
,发生反应1和反应2,测得丙烷的平衡转化率与投料比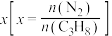 的关系如图2所示。
的关系如图2所示。
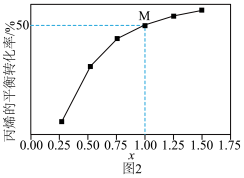
①向反应器中充入 的目的是
的目的是____________ 。
②该温度下,M点丙烯的选择性为66.7%,此时反应1的平衡常数 为
为______ 。
提示:(ⅰ)用分压计算的平衡常数为 ,分压=总压×物质的量分数。
,分压=总压×物质的量分数。
(ⅱ)丙烯的选择性 。
。
Ⅰ.以异丙醇为原料制备丙烯。已知:

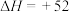 kJ⋅mol
kJ⋅mol 。
。已知几种共价键键能如表所示:
| 共价键 | H-C | C-C | C-C | C-O | H-O |
键能/(kJ⋅mol ) ) | 413 | 347 | E | 326 | 467 |
(1)该反应在
(2)C=C键键能为
 。
。Ⅱ.中国某课题组开发富含硼氧活性位点的热稳定层柱状框架类材料助力丙烷氧化脱氢。
有关反应如下:
反应1:
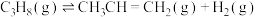

反应2:
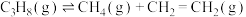

(3)向密闭容器中充入1 mol
 ,同时发生反应1和反应2,升高温度,氢气的体积分数增大。
,同时发生反应1和反应2,升高温度,氢气的体积分数增大。当达到平衡时,测得丙烯的体积分数与温度、压强的关系如图1所示。

①其他条件相同,增大压强,丙烯体积分数减小的原因是
②b点时丙烯与乙烯的体积之比为10∶1,丙烷的平衡转化率为
③下列物理量中,图中c点大于d点的是
A.正反应速率 B.对应温度下反应1的平衡常数
C.逆反应速率 D.平均摩尔质量
④当降温的同时,缩小容器的体积,G点对应的平衡体系达到新平衡时丙烯的体积分数可能对应图中的
(4)一定温度下,总压保持为p时,向反应器中充入
 和
和 ,发生反应1和反应2,测得丙烷的平衡转化率与投料比
,发生反应1和反应2,测得丙烷的平衡转化率与投料比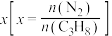 的关系如图2所示。
的关系如图2所示。
①向反应器中充入
 的目的是
的目的是②该温度下,M点丙烯的选择性为66.7%,此时反应1的平衡常数
 为
为提示:(ⅰ)用分压计算的平衡常数为
 ,分压=总压×物质的量分数。
,分压=总压×物质的量分数。(ⅱ)丙烯的选择性
 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】甲醚(CH3OCH3)是一种重要的新型能源,用CO和H2合成甲醚的有关反应如下:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1;
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1;
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41 kJ·mol-1。
回答下列问题:
(1)3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g) ΔH=_____ kJ·mol-1。
(2)下列措施能提高反应CO(g)+H2O(g)⇌CO2(g)+H2(g)中CO平衡转化率的有_____ (填序号)。
A.使用高效催化剂 B.增加H2O(g)的浓度 C.增大压强 D.升高温度
(3)下列叙述中能说明反应3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g)处于平衡状态的是_______ (填序号)。
A.生成3 mol H—H键的同时生成6 mol C—H键
B.混合气体的总物质的量不变
C.正逆反应速率相等,且都等于零
D.二氧化碳和甲醚的物质的量相等
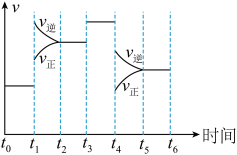
(4)如图为反应CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1达到平衡后,在t1、t3、t4时刻改变某一条件反应速率随时间的变化曲线图。t4时改变的条件是______ ;在t1~t6时间段内,CH3OH物质的量分数最少的一段时间是______ 。
(5)对于反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1,在T℃时,向体积不变的密闭容器中投入一定量CH3OH气体,气体混合物中CH3OCH3的物质的量分数φ(CH3OCH3)与反应时间t的关系如表所示:
①30 min时,CH3OH的转化率为_____ ;根据表中数据,T℃时,该反应的平衡常数为_____ 。
②上述反应中,反应速率v=v正-v逆=k正φ2(CH3OH)-k逆φ(CH3OCH3)·φ(H2O),k正和k逆分别为正向、逆向反应速率常数,φ为物质的量分数。计算15 min时 =
=________ (结果保留2位小数)。
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1;
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1;
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41 kJ·mol-1。
回答下列问题:
(1)3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g) ΔH=
(2)下列措施能提高反应CO(g)+H2O(g)⇌CO2(g)+H2(g)中CO平衡转化率的有
A.使用高效催化剂 B.增加H2O(g)的浓度 C.增大压强 D.升高温度
(3)下列叙述中能说明反应3CO(g)+3H2(g)⇌CO2(g)+CH3OCH3(g)处于平衡状态的是
A.生成3 mol H—H键的同时生成6 mol C—H键
B.混合气体的总物质的量不变
C.正逆反应速率相等,且都等于零
D.二氧化碳和甲醚的物质的量相等
(4)如图为反应CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99 kJ·mol-1达到平衡后,在t1、t3、t4时刻改变某一条件反应速率随时间的变化曲线图。t4时改变的条件是

(5)对于反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24 kJ·mol-1,在T℃时,向体积不变的密闭容器中投入一定量CH3OH气体,气体混合物中CH3OCH3的物质的量分数φ(CH3OCH3)与反应时间t的关系如表所示:
| t/min | 0 | 15 | 30 | 45 | 80 | 100 |
| φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
②上述反应中,反应速率v=v正-v逆=k正φ2(CH3OH)-k逆φ(CH3OCH3)·φ(H2O),k正和k逆分别为正向、逆向反应速率常数,φ为物质的量分数。计算15 min时
 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】一氧化二氮(Nitrous oxide),无色有甜味气体,又称笑气,“笑气”的名称是由于吸入它会感到欣快,并能致人发笑。1799年,英国化学家汉弗莱·戴维发现了该气体。一氧化二氮早期被用于牙科手术的麻醉,现用在外科手术和牙科起麻醉和镇痛作用。
(1)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) △H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2
△H=________ (用含△H1、△H2的代数式表示)。
(2)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO(g) CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O
CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O FeO++N2;第二步为
FeO++N2;第二步为____________________ (写化学方程式)。第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_____ (填“大于”“小于”或“等于”)第一步反应活化能。
(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应:2N2O(g) 2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:

①该反应的△H______ (填“>”或“<”)0。
②容器II的体积为0.5L,在470℃下进行反应,30s后达到平衡,0~30s内容器II中O2的反应速率为_______ mol·L-1·s-1。
③已知容器I的体积为1L,370℃时,该反应的平衡常数k=________ (保留两位有效数字)。
④图中A、B、C三点处容器内密度最大的点是________ (填“A”“B”或“C”)。
(1)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) △H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2
△H=
(2)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO(g)
 CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O
CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O FeO++N2;第二步为
FeO++N2;第二步为(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应:2N2O(g)
 2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
①该反应的△H
②容器II的体积为0.5L,在470℃下进行反应,30s后达到平衡,0~30s内容器II中O2的反应速率为
③已知容器I的体积为1L,370℃时,该反应的平衡常数k=
④图中A、B、C三点处容器内密度最大的点是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知在水中存在以下平衡: ,
, 。
。
①常温下 溶液的
溶液的
_______ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加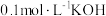 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是_______ 。
A.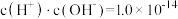 B.
B. 
C. D.
D. 
③已知常温下 的钙盐
的钙盐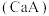 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: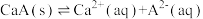
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有_______ 。
A.升高温度 B.降低温度 C.加入 晶体 D.加入
晶体 D.加入 固体
固体
(2)联氨(又称肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为_______ 。
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是_______ 。
(3)工业废水中含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:

若平衡体系的 ,则溶液显
,则溶液显_______ 色。
②能说明第①步反应达平衡状态的是_______ 。
A. 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变
③第③步生成的 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: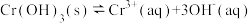 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至_______ 。
(1)已知在水中存在以下平衡:
 ,
, 。
。①常温下
 溶液的
溶液的
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加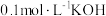 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是A.
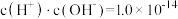 B.
B. 
C.
 D.
D. 
③已知常温下
 的钙盐
的钙盐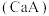 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: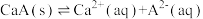
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有A.升高温度 B.降低温度 C.加入
 晶体 D.加入
晶体 D.加入 固体
固体(2)联氨(又称肼,
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的
 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是(3)工业废水中含有一定量的
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
若平衡体系的
 ,则溶液显
,则溶液显②能说明第①步反应达平衡状态的是
A.
 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变③第③步生成的
 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: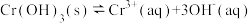 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至
您最近一年使用:0次
【推荐2】研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到化学平衡的是___________ 。
A.2v(NH3)=c(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数:___________ 。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量___________ (填“增加”、“减小”或“不变”)。
④氨基甲酸铵分解反应的焓变△H___________ 0,熵变△S___________ 0(填>、<或=)。
(2)某温度下,等物质的量的碘和环戊烯( )在恒容容器内发生反应
)在恒容容器内发生反应 (g)+I2(g)
(g)+I2(g)
 (g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=
(g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=_______ Pa。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是
A.2v(NH3)=c(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数:
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量
④氨基甲酸铵分解反应的焓变△H
(2)某温度下,等物质的量的碘和环戊烯(
 )在恒容容器内发生反应
)在恒容容器内发生反应 (g)+I2(g)
(g)+I2(g)
 (g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=
(g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):
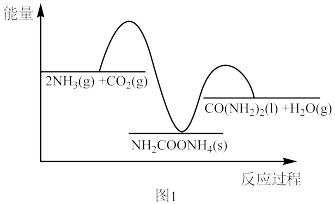
已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施___________ 。
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是___________ 。
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是___________ 。
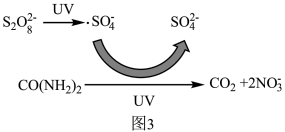
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为___________ 。
(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,
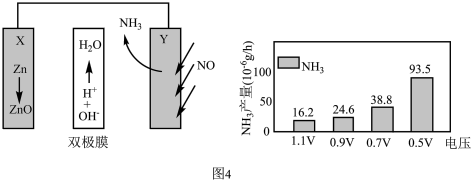
已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率= ×100%
×100%
①写出正极的电极反应式___________ 。
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为___________ 。(保留两位小数)
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):

已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为

(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,

已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率=
 ×100%
×100%①写出正极的电极反应式
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为
您最近一年使用:0次
【推荐1】利用工业废气CO2制甲醇I:CO2(g)+3H2(g CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。
CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。
(1)上述反应
_______ 0,该反应能自发进行,则△H1_______ 0(填“>”或“<”)。
(2)在VL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生上述反应,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势_______ 。

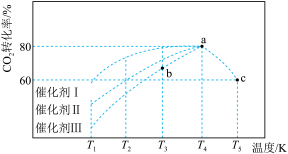
(3)将1.0molCO2和3.0molH2充入2L恒容密闭容器中,使其按反应I进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______。
(4)现向恒温恒压(0.1MPa)的密闭容器中充入1molCO2,3molH2和6molHe,上述反应达平衡时,测得CO2的转化率为0.2,则该反应的Kp=_______ MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果保留小数点后1位)。
(5)CO2制备CH3OH的过程中,往往伴随着另一反应发生:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3=+40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:_______ 。
(其中:CH3OH的选择性= ×100%)
×100%)
 CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。
CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。(1)上述反应
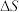
(2)在VL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生上述反应,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势

(3)将1.0molCO2和3.0molH2充入2L恒容密闭容器中,使其按反应I进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______。

| A.T3对应的平衡常数小于T4对应的平衡常数 |
| B.根据图中曲线分析,催化剂Ⅰ的催化效果好 |
| C.b点v(正)可能等于v(逆) |
| D.a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低 |
(5)CO2制备CH3OH的过程中,往往伴随着另一反应发生:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3=+40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:
(其中:CH3OH的选择性=
 ×100%)
×100%)
您最近一年使用:0次
【推荐2】第五届联合国环境大会(UNEA-5)于2021年2月份在肯尼亚举行,会议主题为“加大力度保护自然,实现可持续发展”。有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2.氨水脱硫的相关热化学方程式如下:
2NH3(g)+H2O(1)+SO2(g)=(NH4)2SO3(aq)∆H=akJ∙mol-1
(NH4)2SO3(aq)t+H2O(l)+SO2(g)=2NH4HSO3(aq)∆H=bkJ∙mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)∆H=ckJ∙mol-1
反应NH3(g)+NH4HSO3(aq)+ O2(g)=(NH4)2SO4(aq)的∆H=
O2(g)=(NH4)2SO4(aq)的∆H=_______ 。(用含a、b、c的代数式表示)kJ∙mol-1)。
(2)SO2可被NO2氧化:SO2(g)+NO2(g)⇌SO3(g)+NO(g)。当温度高于225℃时,反应速率v正=k正∙c(SO2)∙c(NO2),v逆=k逆∙c(SO3)∙c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_______ 。
(3)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g)⇌2CO2(g)+S(g) ∆H>0。其他条件相同、以γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图1所示。下列有关SO2大除率的说法正确的是_______ (填标号)。

A.240°C以下,SO2能够被催化剂吸附,温度升高,吸附能力减弱,SO2去除率降低
B.以γ-Al2O3作为催化剂,SO2去除率最高只能达到80%
C.温度高于500℃,SO2去除率降低是因为催化剂的活性降低
(4)在气体总压强分别为p1和p2时,反应2SO3(g)⇌2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图2所示:

①压强:p1_______ (填“>”或“<”)p2。
②若p1=0.81MPa,起始时充入一定虽的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)MPa。
(5)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图3所示。碱性条件下,HS-首先被氧化生成中间产物S ,S
,S 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。

①阳极HS-氧化为S 的电极反应式为
的电极反应式为_______ 。
②电解一段时间后,阳极的石墨电极会出现电极饨化,导致电极反应不能持续有效进行,其原因是_______ 。
(1)氨水可以脱除烟气中的SO2.氨水脱硫的相关热化学方程式如下:
2NH3(g)+H2O(1)+SO2(g)=(NH4)2SO3(aq)∆H=akJ∙mol-1
(NH4)2SO3(aq)t+H2O(l)+SO2(g)=2NH4HSO3(aq)∆H=bkJ∙mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)∆H=ckJ∙mol-1
反应NH3(g)+NH4HSO3(aq)+
 O2(g)=(NH4)2SO4(aq)的∆H=
O2(g)=(NH4)2SO4(aq)的∆H=(2)SO2可被NO2氧化:SO2(g)+NO2(g)⇌SO3(g)+NO(g)。当温度高于225℃时,反应速率v正=k正∙c(SO2)∙c(NO2),v逆=k逆∙c(SO3)∙c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
(3)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g)⇌2CO2(g)+S(g) ∆H>0。其他条件相同、以γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图1所示。下列有关SO2大除率的说法正确的是

A.240°C以下,SO2能够被催化剂吸附,温度升高,吸附能力减弱,SO2去除率降低
B.以γ-Al2O3作为催化剂,SO2去除率最高只能达到80%
C.温度高于500℃,SO2去除率降低是因为催化剂的活性降低
(4)在气体总压强分别为p1和p2时,反应2SO3(g)⇌2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图2所示:

①压强:p1
②若p1=0.81MPa,起始时充入一定虽的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=
(5)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图3所示。碱性条件下,HS-首先被氧化生成中间产物S
 ,S
,S 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。
①阳极HS-氧化为S
 的电极反应式为
的电极反应式为②电解一段时间后,阳极的石墨电极会出现电极饨化,导致电极反应不能持续有效进行,其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】硫的氧化物是形成酸雨的罪魁祸首,含硫烟气(主要成分为 )的处理可用水煤气还原法。
)的处理可用水煤气还原法。
已知:ⅰ.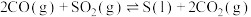

ⅱ.

(1)写出CO(g)与 反应生成
反应生成 、
、 的热化学方程式:
的热化学方程式:_______ 。若该反应在恒温、恒容体系中进行,达到平衡的标志为_______ (填选项字母)
A.单位时间内,生成n mol CO的同时生成n mol
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D. 与
与 的体积比保持不变
的体积比保持不变
(2)反应ⅱ的正反应的活化能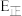
_______ (填“>”“<”或“=”)逆反应的活化能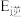 。
。
(3)T℃,向10 L恒容密闭容器中充入2 mol CO(g)、2 mol 和2 mol
和2 mol  ,发生反应ⅰ和反应ⅱ,5 min达到平衡时,
,发生反应ⅰ和反应ⅱ,5 min达到平衡时, 和
和 的物质的量分别为1.6 mol、1.8 mol。
的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应ⅱ的平衡常数K=_______
②其他条件不变,6 min时缩小容器体积。 的转化率
的转化率_______ (填“增大”“减小”或“不变”)
(4)二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。

①该电池放电时质子从_______ (填“b→a”或“a→b”)
②该电池负极反应为_______
 )的处理可用水煤气还原法。
)的处理可用水煤气还原法。已知:ⅰ.
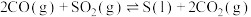

ⅱ.


(1)写出CO(g)与
 反应生成
反应生成 、
、 的热化学方程式:
的热化学方程式:A.单位时间内,生成n mol CO的同时生成n mol

B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.
 与
与 的体积比保持不变
的体积比保持不变(2)反应ⅱ的正反应的活化能
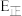
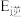 。
。(3)T℃,向10 L恒容密闭容器中充入2 mol CO(g)、2 mol
 和2 mol
和2 mol  ,发生反应ⅰ和反应ⅱ,5 min达到平衡时,
,发生反应ⅰ和反应ⅱ,5 min达到平衡时, 和
和 的物质的量分别为1.6 mol、1.8 mol。
的物质的量分别为1.6 mol、1.8 mol。①该温度下,反应ⅱ的平衡常数K=
②其他条件不变,6 min时缩小容器体积。
 的转化率
的转化率(4)二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。

①该电池放电时质子从
②该电池负极反应为
您最近一年使用:0次



