乙烷裂解制乙烯具有成本低。收率高、投资少、污染小等优点。目前裂解方法有电催化、光催化裂解、直接裂解、氧气或二氧化碳氧化乙烷裂解等。回答下列问题:
(1)乙烷直接裂解时温度、压强及平衡转化率的关系如图所示:

①反应的ΔH_______ 0,p1______ p2(填“>”、“<”或 “=”)。
②T°C时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m% )通入一密闭容器中发生反应C2H6(g) C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为
C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为______ KPa,反应的平衡常数Kp=______ KPa(用分压表示,分乐=总压×物质的量分数)。
(2)已知乙烷直接裂解、CO2氧化裂解和O2氧化裂解反应如下:
(I) C2H6(g) C2H4(g)+H2(g) ΔH1
C2H4(g)+H2(g) ΔH1
(II) CO2(g)+C2H6(g) C2H4(g)+CO(g)+H2O(g) ΔH2
C2H4(g)+CO(g)+H2O(g) ΔH2
(III) 2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g) ΔH3
2C2H4(g)+2H2O(g) ΔH3
①反应(I)、(II)的平衡常数分别为K1、K2,则反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数为K=
CO(g)+H2O(g)的平衡常数为K=_______ (用含K1、K2的代数式表示)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的有______ 。
A.加入反应(I)的催化剂,可降低反应的焓变
B.恒压掺入Ar能提高反应(II)的平衡产率
C.降低温度,反应(III)的正反应速率降低、逆反应速率增大
D.增加乙烷的浓度,反应(I) (II)(III)的平衡均向右移动
③在800°C时发生反应(III),乙烷的转化率、乙烯的选择性和收率随投料比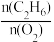 的变化关系如图所示,控制
的变化关系如图所示,控制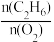 =2,而不采用选择性更高的
=2,而不采用选择性更高的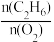 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是_____ ;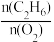 <2时,
<2时,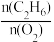 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是______ 。
(1)乙烷直接裂解时温度、压强及平衡转化率的关系如图所示:

①反应的ΔH
②T°C时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m% )通入一密闭容器中发生反应C2H6(g)
 C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为
C2H4(g)+H2(g)。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为(2)已知乙烷直接裂解、CO2氧化裂解和O2氧化裂解反应如下:
(I) C2H6(g)
 C2H4(g)+H2(g) ΔH1
C2H4(g)+H2(g) ΔH1(II) CO2(g)+C2H6(g)
 C2H4(g)+CO(g)+H2O(g) ΔH2
C2H4(g)+CO(g)+H2O(g) ΔH2(III) 2C2H6(g)+O2(g)
 2C2H4(g)+2H2O(g) ΔH3
2C2H4(g)+2H2O(g) ΔH3①反应(I)、(II)的平衡常数分别为K1、K2,则反应CO2(g)+H2(g)
 CO(g)+H2O(g)的平衡常数为K=
CO(g)+H2O(g)的平衡常数为K=②上述反应体系在一定条件下建立平衡后,下列说法正确的有
A.加入反应(I)的催化剂,可降低反应的焓变
B.恒压掺入Ar能提高反应(II)的平衡产率
C.降低温度,反应(III)的正反应速率降低、逆反应速率增大
D.增加乙烷的浓度,反应(I) (II)(III)的平衡均向右移动
③在800°C时发生反应(III),乙烷的转化率、乙烯的选择性和收率随投料比
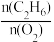 的变化关系如图所示,控制
的变化关系如图所示,控制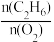 =2,而不采用选择性更高的
=2,而不采用选择性更高的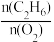 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是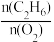 <2时,
<2时,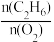 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
更新时间:2022-08-16 16:45:22
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
回答下列问题:
(1)操作①的名称为__________ ,沉淀C的化学式为______________ 。
(2)在滤渣B中滴加稀硫酸时,发现反应速率比同浓度硫酸与纯铁粉反应要快,原因是_______________________ 。
(3)在滤渣B中滴加的硫酸可用SO2制取,可按以下三步进行:
已知25℃、101kPa时:
2SO2(g)+O2(g)⇋2SO3(g) △H1=-197kJ/mol
H2O(g)=H2O(l) △H2=-44kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=-545kJ/mol
则SO3(g)与H2O(l)反应的热化学方程式是_________________ 。
(4)设计实验方案,检测滤液D中含有的金属离子(试剂自选)________________________ 。
(5)常温下,乙同学将绿矾配成约0.1mol•L-1FeSO4溶液,测得溶液的pH=3,请用离子方程式解释其原因_______ ,该溶液中c(SO42-)-c(Fe2+)=______ mol•L-1(填近似数值)。
(6)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,则反应④的总反应化学方程式为______________ 。

回答下列问题:
(1)操作①的名称为
(2)在滤渣B中滴加稀硫酸时,发现反应速率比同浓度硫酸与纯铁粉反应要快,原因是
(3)在滤渣B中滴加的硫酸可用SO2制取,可按以下三步进行:
已知25℃、101kPa时:
2SO2(g)+O2(g)⇋2SO3(g) △H1=-197kJ/mol
H2O(g)=H2O(l) △H2=-44kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=-545kJ/mol
则SO3(g)与H2O(l)反应的热化学方程式是
(4)设计实验方案,检测滤液D中含有的金属离子(试剂自选)
(5)常温下,乙同学将绿矾配成约0.1mol•L-1FeSO4溶液,测得溶液的pH=3,请用离子方程式解释其原因
(6)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,则反应④的总反应化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H=+49 kJ•mol-1
CO2(g)+3H2(g) △H=+49 kJ•mol-1
副反应:H2(g)+CO2(g) CO(g)+H2O(g) △H=+41 kJ•mol-1
CO(g)+H2O(g) △H=+41 kJ•mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_________________________ ,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________ 。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处_________________________ 。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________ 。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________ L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl_____ P2(填“大于”或“小于”)温度T3_______ T4(填“大于”或“小于”);压强为P1时,在N点; v正_______ v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数 K=_____________________ 。

(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H=+49 kJ•mol-1
CO2(g)+3H2(g) △H=+49 kJ•mol-1副反应:H2(g)+CO2(g)
 CO(g)+H2O(g) △H=+41 kJ•mol-1
CO(g)+H2O(g) △H=+41 kJ•mol-1①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
| 0.05 | C1 | 4.8 |
| c2 | C1 | 19.2 |
| c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k 为
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
①由表中数据判断ΔH1_________ 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=_______ mol·L-1·min-1,该温度下此反应的平衡常数为___________ ,此时的温度为________ (从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________ 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

A.则上表中剩余的实验条件数据:a=________ 、b=_______ 。
B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=______ MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:__________________________ 。
反应I:CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应II:CO2(g)+3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
①由表中数据判断ΔH1
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

| 实验编号 | 温度(℃) | n(CO)/n(H2) | 压强(MPa) |
| 1 | a | 1/2 | 0.2 |
| 2 | 200 | b | 5 |
| 3 | 350 | 1/2 | 0.2 |
A.则上表中剩余的实验条件数据:a=
B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:
您最近一年使用:0次
【推荐1】由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。
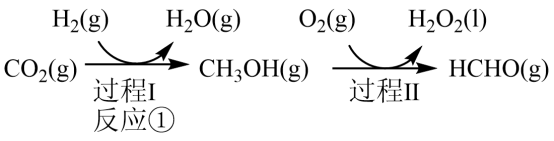
已知:
反应②: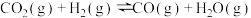
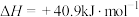 ;
;
反应③:
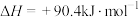 。
。
(1)反应①的热化学方程式为_______ ;若过程II中 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成_______ mol HCHO。
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
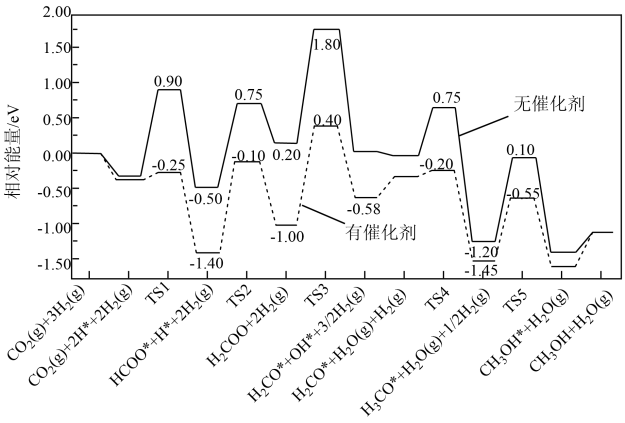
该反应历程中决速步骤的化学方程式为_______ ,催化剂使该步骤的活化能降低_______ eV。
(3)某研究小组采用上述催化剂,向密闭容器中通入 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。

i.下列说法正确的是_______ (填标号)。
A.曲线a为等压线,曲线b为等温线
B.增大 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大
C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中 为
为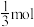 ,CO为
,CO为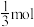 ,则此时
,则此时 的分压为
的分压为_______ kPa,反应①的压强平衡常数
_______  (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
iii.图中M点的 高于N点的原因是
高于N点的原因是_______ 。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。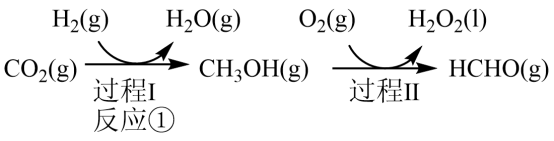
已知:
反应②:
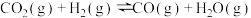
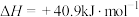 ;
;反应③:

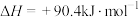 。
。(1)反应①的热化学方程式为
 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中决速步骤的化学方程式为
(3)某研究小组采用上述催化剂,向密闭容器中通入
 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。
i.下列说法正确的是
A.曲线a为等压线,曲线b为等温线
B.增大
 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中
 为
为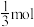 ,CO为
,CO为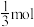 ,则此时
,则此时 的分压为
的分压为
 (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。iii.图中M点的
 高于N点的原因是
高于N点的原因是
您最近一年使用:0次
【推荐2】燃煤烟气中SO2和NOx是大气污染物的主要来源,脱硫脱硝技术是烟气治理技术的研究热点。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原制,具有弱碱性。60°C时在一定浓度的尿素/ H2O溶液中通入含有SO2和NO的烟气。烟气中有毒气体被一定程度吸收。
①尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为_________________________________________ 。
②尿素/H2O2溶液对NO的吸收去除效果不如SO2吸收去除效果,原因是____________________________ 。
③脱硝时H2O2能将NO氧化为NO2及HNO3等,促进2HNO3+CO(NH2)2=2N2↑+CO2↑+ 3H2O等氧化还原反应的发生。尿素/H2O2溶液脱硫脱硝一般控制温度为50°C~ 70°C,过高的温度会导致NO去除率降低的原因是______________________________________________________________ 。
(2)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。单一炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2被炭表面的含氧官能团催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为_____________________________________________ 。
②V2O5/炭基材料脱硫脱硝时,控制一定气体流量和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示:
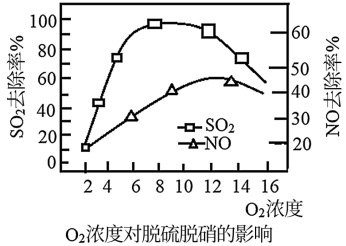
当氧气浓度过高时,去除效率下降,其可能原因是___________________ 。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原制,具有弱碱性。60°C时在一定浓度的尿素/ H2O溶液中通入含有SO2和NO的烟气。烟气中有毒气体被一定程度吸收。
①尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为
②尿素/H2O2溶液对NO的吸收去除效果不如SO2吸收去除效果,原因是
③脱硝时H2O2能将NO氧化为NO2及HNO3等,促进2HNO3+CO(NH2)2=2N2↑+CO2↑+ 3H2O等氧化还原反应的发生。尿素/H2O2溶液脱硫脱硝一般控制温度为50°C~ 70°C,过高的温度会导致NO去除率降低的原因是
(2)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。单一炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2被炭表面的含氧官能团催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为
②V2O5/炭基材料脱硫脱硝时,控制一定气体流量和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示:

当氧气浓度过高时,去除效率下降,其可能原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】铝及其化合物在生产、生活中有广泛应用。
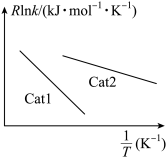
(1)四氢铝锂( )是重要的还原剂,在有机合成中有广泛应用。已知几种热化学方程式如下:
)是重要的还原剂,在有机合成中有广泛应用。已知几种热化学方程式如下:
i.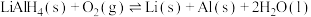
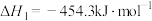
ii.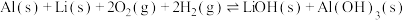
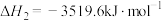
①

_______  。
。
②在一密闭容器中投入足量的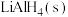 和
和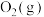 ,一定温度下只发生反应i,达到平衡后
,一定温度下只发生反应i,达到平衡后 。保持温度不变,将体积缩小至原来的三分之一,达到第二次平衡,下列叙述错误的是
。保持温度不变,将体积缩小至原来的三分之一,达到第二次平衡,下列叙述错误的是_______ (填标号)。
A.气体压强保持不变时达到平衡状态
B.第一次平衡到第二次平衡,平衡常数增大
C.达到第二次平衡时,
D.第一次平衡到第二次平衡, 保持不变
保持不变
(2)氮化铝(AlN)是一种新型无机非金属材料。工业上制备AlN的化学反应原理为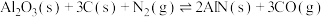
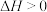 。向一体积为2 L的恒容密闭容器中加入和充入足量的
。向一体积为2 L的恒容密闭容器中加入和充入足量的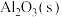 、C(s)和2 mol
、C(s)和2 mol 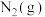 ,测得平衡时CO的体积分数与温度、压强的关系如图1所示。
,测得平衡时CO的体积分数与温度、压强的关系如图1所示。

①X代表_______ (填“温度”或“压强”),判断的依据是_______ 。
②Y1_______ (填“>”、“<”或“=”)Y2。
③M点对应的条件下,平衡常数K=_______ 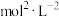 。
。
(3)已知:Arrhenius经验公式为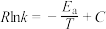 (
( 为活化能,k为速率常数,R和C为常数)。为探究Cat1、Cat2两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息可知催化效能较高的催化剂是
为活化能,k为速率常数,R和C为常数)。为探究Cat1、Cat2两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息可知催化效能较高的催化剂是_______ (填“Cat1”或“Cat2”),判断的依据是_______ 。(已知速率常数变化值越大,活化能越大)
(1)四氢铝锂(
 )是重要的还原剂,在有机合成中有广泛应用。已知几种热化学方程式如下:
)是重要的还原剂,在有机合成中有广泛应用。已知几种热化学方程式如下:i.
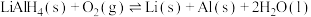
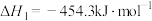
ii.
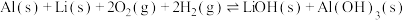
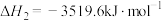
①


 。
。②在一密闭容器中投入足量的
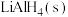 和
和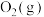 ,一定温度下只发生反应i,达到平衡后
,一定温度下只发生反应i,达到平衡后 。保持温度不变,将体积缩小至原来的三分之一,达到第二次平衡,下列叙述错误的是
。保持温度不变,将体积缩小至原来的三分之一,达到第二次平衡,下列叙述错误的是A.气体压强保持不变时达到平衡状态
B.第一次平衡到第二次平衡,平衡常数增大
C.达到第二次平衡时,

D.第一次平衡到第二次平衡,
 保持不变
保持不变(2)氮化铝(AlN)是一种新型无机非金属材料。工业上制备AlN的化学反应原理为
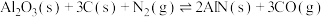
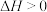 。向一体积为2 L的恒容密闭容器中加入和充入足量的
。向一体积为2 L的恒容密闭容器中加入和充入足量的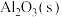 、C(s)和2 mol
、C(s)和2 mol 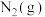 ,测得平衡时CO的体积分数与温度、压强的关系如图1所示。
,测得平衡时CO的体积分数与温度、压强的关系如图1所示。
①X代表
②Y1
③M点对应的条件下,平衡常数K=
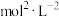 。
。(3)已知:Arrhenius经验公式为
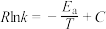 (
( 为活化能,k为速率常数,R和C为常数)。为探究Cat1、Cat2两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息可知催化效能较高的催化剂是
为活化能,k为速率常数,R和C为常数)。为探究Cat1、Cat2两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息可知催化效能较高的催化剂是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】研发CO2利用技术成为了研究热点,某科研团队采用一种类似“搭积木”的方式,在实验室中首次实现从二氧化碳到淀粉分子的全合成,“积木”中涉及如下两个反应:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ②CH3OH(g)+O2(g)⇌HCHO(g)+H2O2(l)。完成下列填空:
(1)一定温度下,往5L反应釜中充入1molCO2、3molH2,反应5min,气体总的物质的量减少了20%,则0~5min内,H2的平均反应速率v=_______ 。
(2)反应②的平衡表达式K=_______ 。将同体积的CH3OH(g)与O2(g)充入反应器中,当以下数值不变时,不能说明该反应达到平衡的是_______ (选填序号)。
a.气体密度 b.气体总压 c.CH3OH与O2体积比 d.O2的体积分数
(3)将同体积的CH3OH(g)与O2(g)充入反应器中,平衡时v正(O2)、c(O2)与温度的关系如图所示:

反应②为_______ 反应(选填:放热或吸热)。55~100℃时,O2的物质的量浓度随温度升高而增大的原因是_______ 。
(4)反应②常会有副产物HCOOH产生,将NaOH溶液逐滴加入HCOOH溶液至恰好完全反应,溶液中存在:c(OH–)-c(H+)=_______ 。继续加入HCl溶液至中性,此时c(HCOOH)_______ c(Cl–)(选填“>”“<”或“=”)。
(5)写出检验HCOOH中是否含醛基的实验方法_______ 。
(1)一定温度下,往5L反应釜中充入1molCO2、3molH2,反应5min,气体总的物质的量减少了20%,则0~5min内,H2的平均反应速率v=
(2)反应②的平衡表达式K=
a.气体密度 b.气体总压 c.CH3OH与O2体积比 d.O2的体积分数
(3)将同体积的CH3OH(g)与O2(g)充入反应器中,平衡时v正(O2)、c(O2)与温度的关系如图所示:

反应②为
(4)反应②常会有副产物HCOOH产生,将NaOH溶液逐滴加入HCOOH溶液至恰好完全反应,溶液中存在:c(OH–)-c(H+)=
(5)写出检验HCOOH中是否含醛基的实验方法
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】乙烯是石油化工最基本原料之一。
I.乙烷在一定条件下可脱氢制得乙烯:C2H6(g) C2H4(g)+H2(g) △H1>0
C2H4(g)+H2(g) △H1>0
(1)提高乙烷平衡转化率的措施有____ 、____ 。
(2)一定温度下,向恒容密闭容器通入等物质的量的C2H6和H2,初始压强为100kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为___ kPa,该反应的平衡常数Kp=___ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
II.在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:
a.2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) △H2<0
b.2C2H6(g)+5O2(g)=4CO(g)+6H2O(g) △H3<0
c.C2H4(g)+2O2(g)=2CO(g)+2H2O(g) △H4<0
(3)根据盖斯定律,反应a的△H2=____ (写出用含有△H3、△H4表示的代数式)。
(4)氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应____ (选填“a”、“b”或“c”)的活化能。
(5)常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
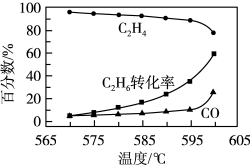
①乙烯的物质的量百分数随温度升高而降低的,原因是____ 。
②在570~600℃温度范围内,下列说法正确的有____ (填字母)。
A.H2O的含量随温度升高而增大.
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
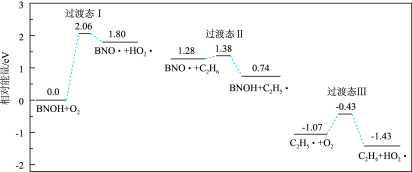
③某学者研究了生成C2H4的部分反应历程如图所示,写出该部分反应历程的总反应方程式____ 。该历程的催化剂是____ 。
I.乙烷在一定条件下可脱氢制得乙烯:C2H6(g)
 C2H4(g)+H2(g) △H1>0
C2H4(g)+H2(g) △H1>0(1)提高乙烷平衡转化率的措施有
(2)一定温度下,向恒容密闭容器通入等物质的量的C2H6和H2,初始压强为100kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为
II.在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:
a.2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) △H2<0
b.2C2H6(g)+5O2(g)=4CO(g)+6H2O(g) △H3<0
c.C2H4(g)+2O2(g)=2CO(g)+2H2O(g) △H4<0
(3)根据盖斯定律,反应a的△H2=
(4)氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应
(5)常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。

①乙烯的物质的量百分数随温度升高而降低的,原因是
②在570~600℃温度范围内,下列说法正确的有
A.H2O的含量随温度升高而增大.
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
③某学者研究了生成C2H4的部分反应历程如图所示,写出该部分反应历程的总反应方程式

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
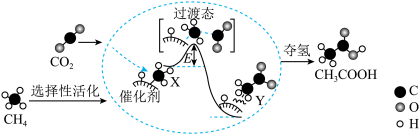
①在合成CH3COOH的反应历程中,下列有关说法正确的是_____ 。(填字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为_____ 。
II.电解法转化CO2制HCOOH的原理如图。
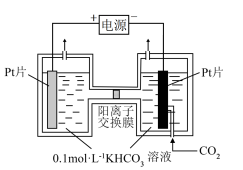
①写出阴极CO2还原为HCOO-的电极反应式:_____ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____ 。
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_____ 。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比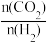
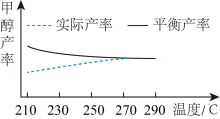
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH____ 0(填“>”或“<”),其依据是____ 。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。

①在合成CH3COOH的反应历程中,下列有关说法正确的是
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为
II.电解法转化CO2制HCOOH的原理如图。

①写出阴极CO2还原为HCOO-的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有
a.使用催化剂 b.加压 c.增大初始投料比
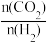
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】燃油汽车尾气中含有 等有毒气体造成大气污染,可在汽车尾气排放装置加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:
等有毒气体造成大气污染,可在汽车尾气排放装置加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:
①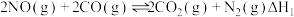
②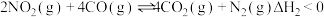
回答下列问题:
(1)已知: 物质中的化学键断裂时所需能量如下表。
物质中的化学键断裂时所需能量如下表。
 燃烧热
燃烧热 ,则反应①的
,则反应①的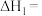
___________  。
。
(2)下列措施有助于消除汽车尾气污染的是___________(填标号)。
(3)一定温度下,恒压为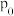 的密闭容器中充入
的密闭容器中充入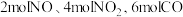 ,催化发生上述两个反应,平衡后测得生成
,催化发生上述两个反应,平衡后测得生成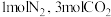 ,则平衡时
,则平衡时 的转化率为
的转化率为___________ ,反应②的压强平衡常数
___________ 。
(4)在三元催化剂(铂、铑、钯)条件下,不同温度下相同时间各气体的消除率如图所示,温度高于 时,
时, 的消除率降低的原因可能是
的消除率降低的原因可能是___________ 。 生成
生成 的电极反应式为
的电极反应式为___________ 。
②已知三种气体分别在某新型催化剂下电还原的历程如下图所示;___________ 。
 等有毒气体造成大气污染,可在汽车尾气排放装置加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:
等有毒气体造成大气污染,可在汽车尾气排放装置加催化转化装置,将有毒气体转化为无毒气体。反应原理如下:①
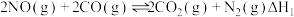
②
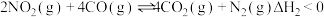
回答下列问题:
(1)已知:
 物质中的化学键断裂时所需能量如下表。
物质中的化学键断裂时所需能量如下表。| 物质 | 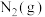 | 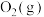 | 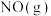 |
能量 | 945 | 498 | 631 |
 燃烧热
燃烧热 ,则反应①的
,则反应①的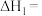
 。
。(2)下列措施有助于消除汽车尾气污染的是___________(填标号)。
| A.缩小体积 | B.升高温度 | C.移除 | D.改变反应物比例 |
(3)一定温度下,恒压为
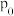 的密闭容器中充入
的密闭容器中充入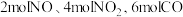 ,催化发生上述两个反应,平衡后测得生成
,催化发生上述两个反应,平衡后测得生成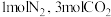 ,则平衡时
,则平衡时 的转化率为
的转化率为
(4)在三元催化剂(铂、铑、钯)条件下,不同温度下相同时间各气体的消除率如图所示,温度高于
 时,
时, 的消除率降低的原因可能是
的消除率降低的原因可能是

 生成
生成 的电极反应式为
的电极反应式为②已知三种气体分别在某新型催化剂下电还原的历程如下图所示;

您最近一年使用:0次
【推荐2】NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2 2NH3,测得平衡体系中NH3的物质的量分数如右图。
2NH3,测得平衡体系中NH3的物质的量分数如右图。

① 下列途径可提高氨气产率的是________ (填字母)。
a. 采用常温条件 b. 采用高温条件
c. 将原料气加压 d. 将氨液化,不断移去液氨
② 右图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1________ (填“>”“<”或“=”)K2。
(2)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
① 反应2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的ΔH=________ kJ·mol-1。
② 氨气与次氯酸钠溶液反应生成肼的离子方程式为__________________________ 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如右图。

① 阴极的电极反应式为____________________________________ 。
② 将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________ 。
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果(已知:NH2Cl+H2O≒NH3+HClO),其原因是__________________________________________ 。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2
 2NH3,测得平衡体系中NH3的物质的量分数如右图。
2NH3,测得平衡体系中NH3的物质的量分数如右图。
① 下列途径可提高氨气产率的是
a. 采用常温条件 b. 采用高温条件
c. 将原料气加压 d. 将氨液化,不断移去液氨
② 右图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1
(2)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
① 反应2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的ΔH=
② 氨气与次氯酸钠溶液反应生成肼的离子方程式为
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如右图。

① 阴极的电极反应式为
② 将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果(已知:NH2Cl+H2O≒NH3+HClO),其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果于北京时间 9 月 24 日由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用 CH4与 CO2制备“合成气”(CO、H2),合成气可直接制备甲醇,反应原理为:
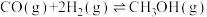
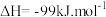 。
。
(1)已知: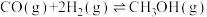
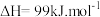 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)
计算 C—H 的键能 x= ______________ kJ/mol,(保留一位小数)。
(2)若要该反应自发进行,_______ (填“高温”或“低温”)更有利,该反应必须在高温下才能启动,原因是_______ 。
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式____________ 。
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:_______ 。
②T1℃时,该反应的化学平衡常数 K=_______ 。
③10min 时,改变的外界条件可能是_______ 。
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将_______ (填“向左进行”“向右进行”“达到平衡”或“无法判断”)。
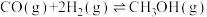
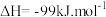 。
。(1)已知:
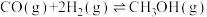
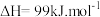 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)| 共价键 | C≡O | C—O | C—H | O—H | H—H |
| 键能/(kJ/mol) | 1072 | 326 | 464 | 436 |
(2)若要该反应自发进行,
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
| C.CO 的百分含量不再变化 |
| D.CO、H2、CH3OH 的物质的量之比为 1∶2∶1 |
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:
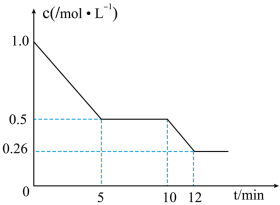
②T1℃时,该反应的化学平衡常数 K=
③10min 时,改变的外界条件可能是
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将
您最近一年使用:0次



