1 . 利用页岩气中丰富的丙烷制丙烯已成为化工原料丙烯生产的重要渠道。
Ⅰ.丙烷直接脱氢法: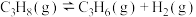
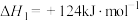
总压分别为100kPa、10kPa时发生该反应,平衡体系中 和
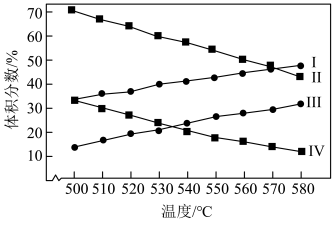
和 的体积分数随温度、压强的变化如下图。
的体积分数随温度、压强的变化如下图。
(1)丙烷直接脱氢反应的化学平衡常数表达式为
___________ 。
(2)总压由10kPa变为100kPa时,化学平衡常数___________ (填“变大”“变小”或“不变”)。
(3)图中,曲线Ⅰ、Ⅲ表示 的体积分数随温度的变化,判断依据是
的体积分数随温度的变化,判断依据是___________ 。
(4)图中,表示100kPa时 的体积分数随温度变化的曲线是
的体积分数随温度变化的曲线是___________ (填“Ⅱ”或“Ⅳ”)。
Ⅱ.丙烷氧化脱氢法:
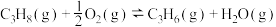

我国科学家制备了一种新型高效催化剂用于丙烷氧化脱氢。在催化剂作用下,相同时间内,不同温度下的转化率和C3H6的产率如下:
(5)表中,C3H8的转化率随温度升高而上升的原因是___________ (答出1点即可)。
(6)已知:C3H6选择性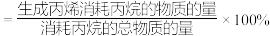 。随着温度升高,C3H6的选择性
。随着温度升高,C3H6的选择性___________ (填“升高”“降低”或“不变”),可能的原因是___________ 。
Ⅰ.丙烷直接脱氢法:
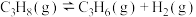
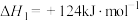
总压分别为100kPa、10kPa时发生该反应,平衡体系中
 和
和 的体积分数随温度、压强的变化如下图。
的体积分数随温度、压强的变化如下图。
(1)丙烷直接脱氢反应的化学平衡常数表达式为

(2)总压由10kPa变为100kPa时,化学平衡常数
(3)图中,曲线Ⅰ、Ⅲ表示
 的体积分数随温度的变化,判断依据是
的体积分数随温度的变化,判断依据是(4)图中,表示100kPa时
 的体积分数随温度变化的曲线是
的体积分数随温度变化的曲线是Ⅱ.丙烷氧化脱氢法:
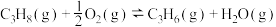

我国科学家制备了一种新型高效催化剂用于丙烷氧化脱氢。在催化剂作用下,相同时间内,不同温度下的转化率和C3H6的产率如下:
| 反应温度/℃ | 465 | 480 | 495 | 510 |
| C3H8的转化率/% | 5.5 | 12.1 | 17.3 | 28.4 |
| C3H6的产率/% | 4.7 | 9.5 | 12.8 | 18.5 |
(5)表中,C3H8的转化率随温度升高而上升的原因是
(6)已知:C3H6选择性
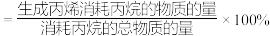 。随着温度升高,C3H6的选择性
。随着温度升高,C3H6的选择性
您最近一年使用:0次
2023-11-02更新
|
408次组卷
|
6卷引用:北京市海淀区2023-2024学年高三上学期期中测试化学试题
2 . 某学习小组研究可逆反应
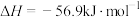 ,请回答下列问题。
,请回答下列问题。
(1)将一定量的NO2和N2O4混合气体充入恒容密闭容器中,反应一段时间,能说明该反应达到化学平衡状态的是_______(填字母)。
(2)将玻璃球分别浸泡在甲、乙两个烧杯中,向甲中加入NH4NO3晶体,此烧杯中NO2球的红棕色变浅,说明平衡 向
向_______ (填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是_______ (填“放热”或“吸热”)过程。
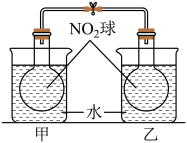
(3)将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。
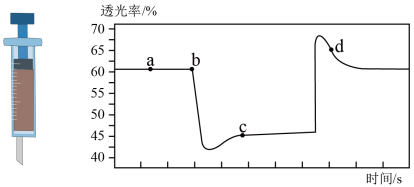
①b点的操作是_______ 注射器(填“压缩”或“拉伸”)。
②c点与a点相比,c(NO2)_______ ,c(N2O4)_______ (填“增大”或“减小”)。
③若不忽略体系温度变化,且没有能量损失,则温度Tb_______ Tc(填“>”、“<”或“=”)。

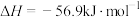 ,请回答下列问题。
,请回答下列问题。(1)将一定量的NO2和N2O4混合气体充入恒容密闭容器中,反应一段时间,能说明该反应达到化学平衡状态的是_______(填字母)。
| A.容器内气体颜色保持不变 |
| B.单位时间内消耗2n mol NO2,同时生成n mol N2O4 |
| C.容器内气体的压强不随时间变化 |
| D.容器内气体质量不随时间变化 |
 向
向
(3)将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。

①b点的操作是
②c点与a点相比,c(NO2)
③若不忽略体系温度变化,且没有能量损失,则温度Tb
您最近一年使用:0次
名校
3 . 现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______ 热反应,且m+n ______ p (填“>”、“<”或“=”)。
(2)减压时,A 的质量分数_______ (填“增大”、“减小”或“不变”,下同)。
(3)若加入 B(体积不变),则A的转化率__________ 。
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将_______ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_______ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应为
(2)减压时,A 的质量分数
(3)若加入 B(体积不变),则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将
(5)若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
2023-02-07更新
|
243次组卷
|
7卷引用:北京市第五十中学2022-2023学年高二上学期期中考试化学试题
名校
4 . 合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应 的化学平衡常数表达式为
的化学平衡常数表达式为___________ 。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是___________ 。
(3)对于反应 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。
①下列条件既能提高反应速率,又能升高氨的平衡含量的是___________ (填字母序号)。
a.加催化剂
b.升高温度至400-550度
c.采取10 MPa-30 MPa的高压条件
②哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是___________ 。
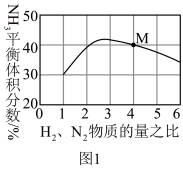
(4)图1表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M(4,40%)点数据计算)N2的平衡体积分数___________ 。
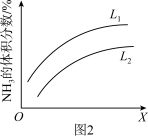
(5)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是___________ (填“温度”或“压强”);判断L1、L2的大小关系并说明理由___________ 。
(1)反应
 的化学平衡常数表达式为
的化学平衡常数表达式为(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① | 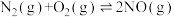 |  |
| ② |  | 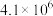 |
(3)对于反应
 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。| 温度/℃ | 压强/Mpa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
a.加催化剂
b.升高温度至400-550度
c.采取10 MPa-30 MPa的高压条件
②哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是
(4)图1表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M(4,40%)点数据计算)N2的平衡体积分数

(5)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是

您最近一年使用:0次
名校
5 . 某化学科研小组研究在其他条件不变时,改变某一条件对反应aA(g)+bB(g)⇌cC(g)化学平衡的影响,得到如下图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):分析图像,回答下列问题:
(1)在图像反应Ⅰ中,该正反应为___________ (填“吸热”或“放热”)反应,若p1>p2,a+b___________ c(填“>”“<”或“=”)。
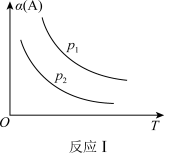
(2)在图像反应Ⅱ中,T1___________ T2(填“>”“<”或“=”),该正反应为___________ (填“吸热”或“放热”)反应。

(1)在图像反应Ⅰ中,该正反应为

(2)在图像反应Ⅱ中,T1

您最近一年使用:0次
名校
解题方法
6 . 处理再利用 有多种方法。
有多种方法。
(1)碱法脱硫:
用 溶液吸收
溶液吸收 。已知:氢硫酸和碳酸的电离常数如表。
。已知:氢硫酸和碳酸的电离常数如表。
①用化学用语表示 溶液显碱性的原因:
溶液显碱性的原因:_______ 。
②用过量的 溶液吸收
溶液吸收 的离子方程式是
的离子方程式是_______ 。
(2)热分解法脱硫
在密闭容器中发生反应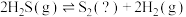 。其他条件不变时,
。其他条件不变时, 的平衡转化率随温度和压强的变化如图。
的平衡转化率随温度和压强的变化如图。
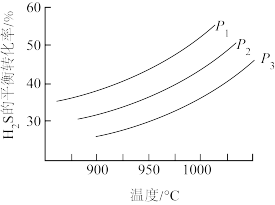
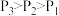 ,反应中
,反应中
_______ (填“是”或“不是”)气态,理由是_______ 。
(3)间接电解法脱硫
间接电解法脱硫过程的示意图如图。
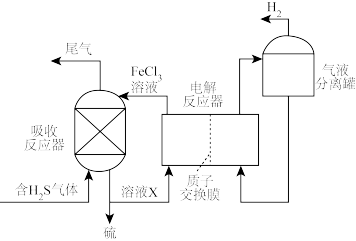
①溶液X的主要溶质是_______ 。
②简述在电解反应器中 溶液再生的原理:
溶液再生的原理:_______ 。
 有多种方法。
有多种方法。(1)碱法脱硫:
用
 溶液吸收
溶液吸收 。已知:氢硫酸和碳酸的电离常数如表。
。已知:氢硫酸和碳酸的电离常数如表。 |  | |
 | 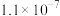 | 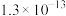 |
 | 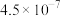 | 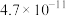 |
 溶液显碱性的原因:
溶液显碱性的原因:②用过量的
 溶液吸收
溶液吸收 的离子方程式是
的离子方程式是(2)热分解法脱硫
在密闭容器中发生反应
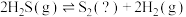 。其他条件不变时,
。其他条件不变时, 的平衡转化率随温度和压强的变化如图。
的平衡转化率随温度和压强的变化如图。
 ,反应中
,反应中
(3)间接电解法脱硫
间接电解法脱硫过程的示意图如图。

①溶液X的主要溶质是
②简述在电解反应器中
 溶液再生的原理:
溶液再生的原理:
您最近一年使用:0次
2023-10-15更新
|
94次组卷
|
2卷引用:北京市第一○一中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
7 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。

(1)反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ•mol-1
反应III:S(s)+O2(g)=SO2(g) ΔH3=-297kJ•mol-1
反应II的热化学方程式:_____ 。
(2)对反应II,在同一投料比,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2____ p1(填“>”或“<”),得出该结论的理由是_____ 。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=____ +SO +2I-
+2I-

(1)反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ•mol-1
反应III:S(s)+O2(g)=SO2(g) ΔH3=-297kJ•mol-1
反应II的热化学方程式:
(2)对反应II,在同一投料比,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=
 +2I-
+2I-
您最近一年使用:0次



