名校
解题方法
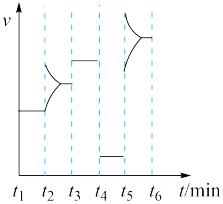
1 . 现有一定条件下某反应mA(g) +nB(g)  pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。
pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。

回答下列问题:
(1)该反应是___________ 热反应,且m+n___________ (填“>” “<”或“=”)p。
(2)降温时,混合体系中C的质量分数___________ (填“增大”“减小”或“不变”,下同)。
(3)若增加A的用量(A、B的总体积不变),则B的转化率___________ 。
(4)若升高温度,则平衡时,B、C的浓度之比 将
将___________ 。
 pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。
pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。| 温度/℃ | 250 | 300 | 350 |
| K | K1 | K2 | K3 |

回答下列问题:
(1)该反应是
(2)降温时,混合体系中C的质量分数
(3)若增加A的用量(A、B的总体积不变),则B的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
 将
将
您最近一年使用:0次
2021-11-18更新
|
543次组卷
|
3卷引用:黑龙江省牡丹江市第三高级中学2021-2022学年高二上学期期末考试化学试题
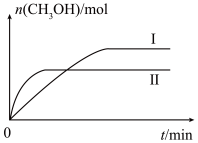
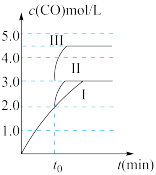
2 . 某实验将 和
和 充入一定体积的密闭容器中,在不同温度下发生反应:
充入一定体积的密闭容器中,在不同温度下发生反应:
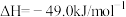 ,测得
,测得 的物质的量随时间变化如下图所示,回答问题:
的物质的量随时间变化如下图所示,回答问题:
(1)该反应的平衡常数表达式为
_______ 。
(2)曲线I、Ⅱ对应的温度
_______  (填“>”或“<”)。
(填“>”或“<”)。
平衡常数关系为
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)其他条件不变时,下列措施能提高 转化率的是_______(填字母代号)。
转化率的是_______(填字母代号)。
(4)其他条件不变时,将容器体积扩大一倍,平衡向_______ 移动(填“正向”、“逆向”或“不”)
 和
和 充入一定体积的密闭容器中,在不同温度下发生反应:
充入一定体积的密闭容器中,在不同温度下发生反应:
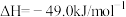 ,测得
,测得 的物质的量随时间变化如下图所示,回答问题:
的物质的量随时间变化如下图所示,回答问题:
(1)该反应的平衡常数表达式为

(2)曲线I、Ⅱ对应的温度

 (填“>”或“<”)。
(填“>”或“<”)。平衡常数关系为

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)其他条件不变时,下列措施能提高
 转化率的是_______(填字母代号)。
转化率的是_______(填字母代号)。A.减小 的浓度 的浓度 | B.降低温度 |
C.增加 的浓度 的浓度 | D.增大压强 |
您最近一年使用:0次
名校
3 . 完成下列问题
(1)密闭容器中发生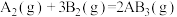 反应,若
反应,若 ,则正反应一定是
,则正反应一定是__________ 反应(填“放热”或“吸热”)。在其他条件不变的情况下,只改变起始 的物质的量,在a、b、c三点达到平衡时,
的物质的量,在a、b、c三点达到平衡时,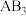 的物质的量由大到小的顺序为
的物质的量由大到小的顺序为_____ 。

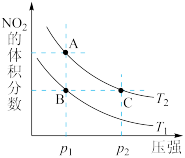
(2)已知反应
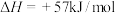 ,在温度为
,在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。A、C两点气体的颜色
的体积分数随压强变化曲线如图所示。A、C两点气体的颜色_____ 点深。(填“A”或“C”)A、B两点的平均相对分子质量:A_____ B(填“>”“=”或“<”)。
(3)在容积可变的密闭容器中发生反应 ,
, 随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在
随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在 时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为
时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为__________ L实现。
(4)某密闭容器中发生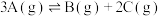 ,
,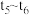 阶段,容器内A的物质的量减少了
阶段,容器内A的物质的量减少了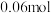 ,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式
,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式__________ 。
(1)密闭容器中发生
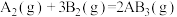 反应,若
反应,若 ,则正反应一定是
,则正反应一定是 的物质的量,在a、b、c三点达到平衡时,
的物质的量,在a、b、c三点达到平衡时,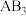 的物质的量由大到小的顺序为
的物质的量由大到小的顺序为
(2)已知反应

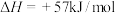 ,在温度为
,在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。A、C两点气体的颜色
的体积分数随压强变化曲线如图所示。A、C两点气体的颜色
(3)在容积可变的密闭容器中发生反应
 ,
, 随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在
随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在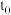 时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为
时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为
(4)某密闭容器中发生
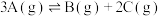 ,
,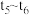 阶段,容器内A的物质的量减少了
阶段,容器内A的物质的量减少了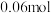 ,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式
,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式
您最近一年使用:0次
4 . 回答下列问题。
(1)某学习小组同学研究过氧化氢溶液与氢碘酸反应,查到一组室温下的实验数据,如下表所示:
回答下列问题:
①过氧化氢与氢碘酸反应的化学方程式为___________ 。
②该反应的速率方程可表示为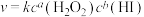 ,对比表中数据可知a=
,对比表中数据可知a=___________ ,b=___________ 。
③该小组同学将实验④的温度升高,发现加热到一定温度下,溶液出现棕黄色所需时间变长,可能的原因是___________ 。
(2)工业上用CH4催化还原NO2可以消除氮氧化物的污染,反应原理为:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
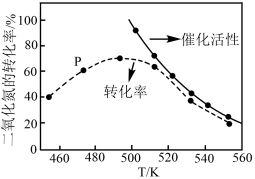
①温度为470K时,图中P点___________ (填“处于”或“不处于”)平衡状态。判断理由是___________ 。490K之后,二氧化氮的转化率随温度升高而减小的原因可能是___________ 。
A.催化剂的活性降低 B.平衡常数变大 C.反应活化能增大
②为提高反应中的二氧化氮的转化率,有人提出可以采取在恒压条件下充入稀有气体,解释其原因:___________ 。
(1)某学习小组同学研究过氧化氢溶液与氢碘酸反应,查到一组室温下的实验数据,如下表所示:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(H2O2) mol/L | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
| c(HI) mol/L | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 从混合至溶液出现棕黄色的时间/s | 13 | 6.5 | 4.3 | 6.6 | 4.4 |
①过氧化氢与氢碘酸反应的化学方程式为
②该反应的速率方程可表示为
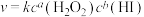 ,对比表中数据可知a=
,对比表中数据可知a=③该小组同学将实验④的温度升高,发现加热到一定温度下,溶液出现棕黄色所需时间变长,可能的原因是
(2)工业上用CH4催化还原NO2可以消除氮氧化物的污染,反应原理为:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
①温度为470K时,图中P点
A.催化剂的活性降低 B.平衡常数变大 C.反应活化能增大
②为提高反应中的二氧化氮的转化率,有人提出可以采取在恒压条件下充入稀有气体,解释其原因:
您最近一年使用:0次
2023-10-10更新
|
168次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
5 . 现有反应

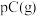 ,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:
,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:
(1)该反应的逆反应为________ (填“放热”或“吸热”)反应,且
________ (填“>”“=”或“<”)p。
(2)在恒容条件下加入B,则A的转化率________ (填“增大”“减小”或“不变”,下同),B的转化率________ 。
(3)若升高温度,则平衡时B、C的浓度之比 将
将________ (填“增大”“减小”或“不变”)。
(4)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色________ (填“变深”“变浅”或“不变”,下同);而维持容器内压强不变,充入氖气时,混合物的颜色________ 。


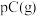 ,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:
,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:(1)该反应的逆反应为

(2)在恒容条件下加入B,则A的转化率
(3)若升高温度,则平衡时B、C的浓度之比
 将
将(4)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色
您最近一年使用:0次
2020-10-06更新
|
445次组卷
|
5卷引用:黑龙江嫩江市高级中学等八校2021-2022学年高二上学期9月联合考试化学试题
黑龙江嫩江市高级中学等八校2021-2022学年高二上学期9月联合考试化学试题步步为赢 高二化学寒假作业:作业四 化学平衡移动原理人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)辽宁师范大学附属中学2021-2022学年高二上学期10月月考化学试题
6 . 在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)______ (填“>”“<”或“=”)v(逆),随后v(正)逐渐______ (填“增大”或“减小”,下同),v(逆)逐渐______ ,反应达到平衡时,v(正)______ (填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=____ v’(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是______ (填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是______________________________________ 。
(5)写出合成氨反应N2+3H2 2NH3的平衡常数表达式:
2NH3的平衡常数表达式:____________________ ,升高温度时K值______ (填“增大”“减小”或“不变”)。
 2NH3 △H<0。
2NH3 △H<0。(1)反应开始阶段,v(正)
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=
(3)下列措施中能加快反应速率并提高氢气的转化率的是
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是
(5)写出合成氨反应N2+3H2
 2NH3的平衡常数表达式:
2NH3的平衡常数表达式:
您最近一年使用:0次
2019-12-13更新
|
599次组卷
|
4卷引用:黑龙江省大兴安岭漠河县第一中学2018-2019学年高二上学期新高考教学质量检测化学试题
名校
7 . 现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。
pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。
(1)该反应的逆反应为___________ 反应(填“吸热”或“放热”)。
(2)恒温压缩体积时,A的质量将___________ (填“增大”“减小”或“不变”,下同)。
(3)若恒容条件下加入B,则A的转化率___________ ,B的转化率___________ 。
(4)若升高温度,则平衡时B、C的浓度之比 将
将___________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。
pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。(1)该反应的逆反应为
(2)恒温压缩体积时,A的质量将
(3)若恒容条件下加入B,则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比
 将
将(5)若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
2021-10-28更新
|
176次组卷
|
2卷引用:黑龙江省密山市第四中学2021-2022学年高二上学期期中考试化学(理)试题
8 . 某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g) 2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
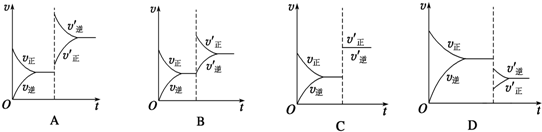
(1)加催化剂对反应速率影响的图象是____ (填序号,下同)
(2)升高温度对反应速率影响的图象是____ 。
(3)增大反应容器体积对反应速率影响的图象是____ 。
(4)增大O2的浓度对反应速率影响的图象是____ 。
 2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
(1)加催化剂对反应速率影响的图象是
(2)升高温度对反应速率影响的图象是
(3)增大反应容器体积对反应速率影响的图象是
(4)增大O2的浓度对反应速率影响的图象是
您最近一年使用:0次
名校
9 . 可逆反应3A(g) 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量______ ;
②若B、C都不是气体,气体的平均相对分子质量______ ;
③若B是气体,C不是气体,气体的平均相对分子质量______ ;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是__________ 态,C的状态是__________ 态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2 N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________ 。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量
②若B、C都不是气体,气体的平均相对分子质量
③若B是气体,C不是气体,气体的平均相对分子质量
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是
(3)某密闭容器中放入一定量的NO2,发生反应2NO2
 N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
您最近一年使用:0次
2019-09-02更新
|
357次组卷
|
3卷引用:黑龙江省牡丹江市第三高级中学2019-2020学年高二10月月考化学试题
9-10高一下·黑龙江鹤岗·期末
名校
解题方法
10 . 在一定条件下,可逆反应mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是___ 。
(2)A、C是气体,增加B的量,平衡不移动,则B为___ 。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是___ 。
(4)加热后,可使 的质量增加,则正反应是
的质量增加,则正反应是___ (填“放热”或“吸热”)反应。
 pC达到平衡,若:
pC达到平衡,若:(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是
(2)A、C是气体,增加B的量,平衡不移动,则B为
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使
 的质量增加,则正反应是
的质量增加,则正反应是
您最近一年使用:0次
2021-10-24更新
|
108次组卷
|
31卷引用:09~10年鹤岗一中高一下学期期末考试化学卷
(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷黑龙江省齐齐哈尔市龙江二中2019-2020学年高二12月月考化学试题黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题(已下线)2010年江苏省启东中学高二上学期期中考试化学卷(已下线)2010-2011学年广东省深圳高级中学高二下学期期中考试化学试卷(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试题(理)(已下线)2011-2012年河北省南宫中学高二上学期9月份月考化学(理)试卷(已下线)2011-2012年安徽红星中安工大附中高二下学期期中联考理科化学试卷(已下线)2011-2012学年广东始兴县风度中学高二下学期期中考试理综化学试卷(已下线)2011-2012学年广东省始兴县风度中学高二下学期期末考试理综化学卷(已下线)2012-2013学年甘肃省兰州一中高二上学期期末考试化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷2014-2015学年天津市宝坻区四校高二11月联考化学试卷2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2015-2016学年天津市和平区高二上学期期末考试化学试卷2015-2016学年湖南省怀化市会同三中高二上12月月考化学试卷2016-2017学年吉林省汪清六中高二上第一次月考化学试卷内蒙古阿拉善左旗高级中学2017-2018学年高二上学期期末考试化学试题甘肃省武威第五中学2017-2018学年高二下学期第二次月考化学试题甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期9月月考化学试题西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期第一次月考化学试题



