现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。
pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。
(1)该反应的逆反应为___________ 反应(填“吸热”或“放热”)。
(2)恒温压缩体积时,A的质量将___________ (填“增大”“减小”或“不变”,下同)。
(3)若恒容条件下加入B,则A的转化率___________ ,B的转化率___________ 。
(4)若升高温度,则平衡时B、C的浓度之比 将
将___________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。
pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小。(1)该反应的逆反应为
(2)恒温压缩体积时,A的质量将
(3)若恒容条件下加入B,则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比
 将
将(5)若加入催化剂,平衡时气体混合物的总物质的量
更新时间:2021-10-28 08:27:05
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)  2NH3(g) △H=−92.4 kJ∙mol−1,请回答下列问题:
2NH3(g) △H=−92.4 kJ∙mol−1,请回答下列问题:
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
则从反应开始到25min时,以H2表示的平均反应速率=_______ 。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。
2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。
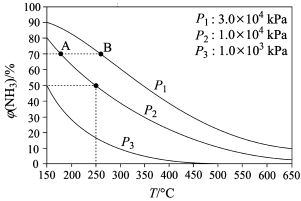
则:随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;_______ 。
(3)工业上可以利用氨气生产氢氰酸(HCN)的反应为:NH3(g)+CH4(g) 3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表
3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表_______ (填字母代号)。

A.原料中CH4与NH3的体积比 B.温度 C.压强
(4)我国科研人员发现在反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。
CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。

上述能垒(活化能)为1.15eV的反应为_______ 。
 2NH3(g) △H=−92.4 kJ∙mol−1,请回答下列问题:
2NH3(g) △H=−92.4 kJ∙mol−1,请回答下列问题:(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(2)合成氨反应N2(g)+3H2(g)
 2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。
2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。
则:随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;
(3)工业上可以利用氨气生产氢氰酸(HCN)的反应为:NH3(g)+CH4(g)
 3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表
3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表
A.原料中CH4与NH3的体积比 B.温度 C.压强
(4)我国科研人员发现在反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。
CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。
上述能垒(活化能)为1.15eV的反应为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】一定温度下,在体积固定的密闭容器中发生如下反应:H2(g)+I2(g) 2HI(g)。达到平衡时,H2(g)、I2(g)的物质的量浓度均为0.01mol·L-1,HI(g)的物质的量浓度为0.06mol·L-1.现分别对平衡混合物进行下列操作,计算操作后反应的浓度商,并判断平衡移动的方向。
2HI(g)。达到平衡时,H2(g)、I2(g)的物质的量浓度均为0.01mol·L-1,HI(g)的物质的量浓度为0.06mol·L-1.现分别对平衡混合物进行下列操作,计算操作后反应的浓度商,并判断平衡移动的方向。
(1)保持其他条件不变,向容器中通入H2(g),使其浓度达到0.02mol·L-1___________ ;
(2)保持其他条件不变,向容器中通入HI(g),使其浓度达到0.08mol·L-1___________ ;
(3)保持其他条件不变,向容器中通入Ar(g),使其浓度达到0.01mol·L-1___________ 。
 2HI(g)。达到平衡时,H2(g)、I2(g)的物质的量浓度均为0.01mol·L-1,HI(g)的物质的量浓度为0.06mol·L-1.现分别对平衡混合物进行下列操作,计算操作后反应的浓度商,并判断平衡移动的方向。
2HI(g)。达到平衡时,H2(g)、I2(g)的物质的量浓度均为0.01mol·L-1,HI(g)的物质的量浓度为0.06mol·L-1.现分别对平衡混合物进行下列操作,计算操作后反应的浓度商,并判断平衡移动的方向。(1)保持其他条件不变,向容器中通入H2(g),使其浓度达到0.02mol·L-1
(2)保持其他条件不变,向容器中通入HI(g),使其浓度达到0.08mol·L-1
(3)保持其他条件不变,向容器中通入Ar(g),使其浓度达到0.01mol·L-1
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】科学家一直致力于“人工固氮”新方法的研究。
(1)传统“人工固氮”的反应为N2(g)+3H2(g) 2NH3(g)。一定温度下,将1molN2和3molH2通入体积为0.5L的密闭容器中,达到平衡状态时H2的转化率为50%,该温度下该反应的平衡常数K=
2NH3(g)。一定温度下,将1molN2和3molH2通入体积为0.5L的密闭容器中,达到平衡状态时H2的转化率为50%,该温度下该反应的平衡常数K=___________ (保留两位有效数字)。
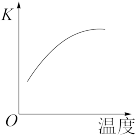
(2)最新“人工固氮”的研究报道,常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=QkJ·mol-1.已知该反应的平衡常数K与温度的关系如图所示,则此反应为
4NH3(g)+3O2(g) ΔH=QkJ·mol-1.已知该反应的平衡常数K与温度的关系如图所示,则此反应为___________ (填“放热”或“吸热”)反应。
(3)氨催化氧化法制硝酸的主要反应为4NH3(g)+5O2(g)⇋4NO(g)+6H2O(g) ΔH<0;在容积为1L的密闭容器中发生该反应,容器内部分物质的含量如下表:
①反应在第2min到第4min时,NH3的平均反应速率为___________ mol·(L·min)-1。
②下列对于上述反应的判断,正确的是___________ (填序号,下列选项中X%表示X的物质的量百分含量)。
A.若升高反应体系的温度,平衡时体系中NH3%将减小
B.若增大反应体系的压强,平衡时体系中NO%将增大
C.若升高反应体系的温度,平衡时体系中H2O(g)%将增大
D.加入催化剂,平衡时体系中O2%保持不变
(1)传统“人工固氮”的反应为N2(g)+3H2(g)
 2NH3(g)。一定温度下,将1molN2和3molH2通入体积为0.5L的密闭容器中,达到平衡状态时H2的转化率为50%,该温度下该反应的平衡常数K=
2NH3(g)。一定温度下,将1molN2和3molH2通入体积为0.5L的密闭容器中,达到平衡状态时H2的转化率为50%,该温度下该反应的平衡常数K=
(2)最新“人工固氮”的研究报道,常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g) ΔH=QkJ·mol-1.已知该反应的平衡常数K与温度的关系如图所示,则此反应为
4NH3(g)+3O2(g) ΔH=QkJ·mol-1.已知该反应的平衡常数K与温度的关系如图所示,则此反应为(3)氨催化氧化法制硝酸的主要反应为4NH3(g)+5O2(g)⇋4NO(g)+6H2O(g) ΔH<0;在容积为1L的密闭容器中发生该反应,容器内部分物质的含量如下表:
| 物质的量 时间 | n(NH3) (mol) | n(O2) (mol) | n(NO) (mol) |
| 起始 | 1.60 | 3.20 | 0.00 |
| 第2min | a | 2.70 | 0.40 |
| 第4min | 0.60 | 1.95 | 1.00 |
| 第6min | 0.60 | 1.95 | 1.00 |
②下列对于上述反应的判断,正确的是
A.若升高反应体系的温度,平衡时体系中NH3%将减小
B.若增大反应体系的压强,平衡时体系中NO%将增大
C.若升高反应体系的温度,平衡时体系中H2O(g)%将增大
D.加入催化剂,平衡时体系中O2%保持不变
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
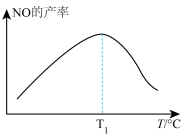
【推荐1】向一体积恒定盛有催化剂的密闭容器中充入一定量的NH3和O2,测得一定时间内NO的产率与温度(T)的关系如图所示,该反应的ΔH___________ 0(填“>”或“<”),温度低于T1℃时,NO的产率___________ (填“是”或“不是”)对应温度下的平衡产率,理由为___________ 。

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在容积不变的密闭容器中,一定量的SO2、O2发生反应: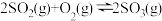 。温度分别为t1和t2时,
。温度分别为t1和t2时, 的体积分数随时间的变化如图。该反应的
的体积分数随时间的变化如图。该反应的
___________ 0(填“>”“<”或“=”,下同);若t1、t2时该反应的化学平衡常数分别为K1、K2,则K1___________ K2。

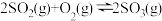 。温度分别为t1和t2时,
。温度分别为t1和t2时, 的体积分数随时间的变化如图。该反应的
的体积分数随时间的变化如图。该反应的

您最近一年使用:0次
填空题
|
较易
(0.85)
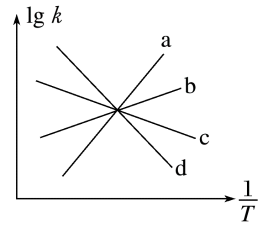
【推荐3】活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s)+2NO2(g)  N2(g)+ 2CO2(g) ΔH<0。已知该反应的正反应速率方程为v正=k正·p2(NO2),逆反应速率方程为v逆=k逆·p(N2)·p2(CO2),其中k正、k逆分别为正、逆反应速率常数。则如图(lg k表示速率常数的对数,
N2(g)+ 2CO2(g) ΔH<0。已知该反应的正反应速率方程为v正=k正·p2(NO2),逆反应速率方程为v逆=k逆·p(N2)·p2(CO2),其中k正、k逆分别为正、逆反应速率常数。则如图(lg k表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示lg k正随
表示温度的倒数)所示a、b、c、d四条斜线中,能表示lg k正随 变化关系的斜线是
变化关系的斜线是___________ ,能表示lg k逆随 变化关系的斜线是
变化关系的斜线是___________
 N2(g)+ 2CO2(g) ΔH<0。已知该反应的正反应速率方程为v正=k正·p2(NO2),逆反应速率方程为v逆=k逆·p(N2)·p2(CO2),其中k正、k逆分别为正、逆反应速率常数。则如图(lg k表示速率常数的对数,
N2(g)+ 2CO2(g) ΔH<0。已知该反应的正反应速率方程为v正=k正·p2(NO2),逆反应速率方程为v逆=k逆·p(N2)·p2(CO2),其中k正、k逆分别为正、逆反应速率常数。则如图(lg k表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示lg k正随
表示温度的倒数)所示a、b、c、d四条斜线中,能表示lg k正随 变化关系的斜线是
变化关系的斜线是 变化关系的斜线是
变化关系的斜线是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】在一定条件下,xA + yB⇌zC,反应达到平衡,试填写下列空白:
(1)若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是_______ 。
(2)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向_______ 方向移动,且A、B的状态中至少有一种是_______ 。
(3)加热后C的百分含量减少,则正反应是_______ 反应(选填“吸热”、“放热”)。
(1)若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是
(2)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向
(3)加热后C的百分含量减少,则正反应是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】恒温恒容下,A容器中加入1g 和1g
和1g 反应达到平衡,
反应达到平衡, 的转化率为a%,另一同温同容的B容器中加入2g
的转化率为a%,另一同温同容的B容器中加入2g 和2g
和2g 反应达到平衡,
反应达到平衡, 的转化率为b%,则比较大小:a%
的转化率为b%,则比较大小:a% ___________ b%。
 和1g
和1g 反应达到平衡,
反应达到平衡, 的转化率为a%,另一同温同容的B容器中加入2g
的转化率为a%,另一同温同容的B容器中加入2g 和2g
和2g 反应达到平衡,
反应达到平衡, 的转化率为b%,则比较大小:a%
的转化率为b%,则比较大小:a%
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】现有反应aA(g)+bB(g) pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是_______ 热反应,且a+b _______ p (填”>““<“或”=“)。
(2)减压时,A的质量分数_______ (填”增大”“减小”或”不变”,下同),正反应速率_______ 。
(3)若加入B(体积不变),则A的转化率_______ ,B的转化率_______ 。
(4)若升高温度,则平衡时,B、C的浓度之比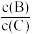 将
将_______ 。
(5)若加入催化剂,平衡时气体压强_______ 。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色_______ ,而维持容器体积不变,充入氖气时,混合物的颜色_______ 。(填”变浅”“变深”或”不变”)
 pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应是
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
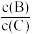 将
将(5)若加入催化剂,平衡时气体压强
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】合成氨N2(g)+3H2(g)⇌2NH3(g) ΔH = -92.4 kJ·mol-1。
(1)该反应的化学平衡常数表达式是K=_______ 。
(2)该反应的化学平衡常数K与温度T的关系如表所示:
其中,K1_______ K2(填“>”、“=”或“<”)。
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是_______(填字母)。
(4)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2 及固体催化剂,平衡时,容器内气体压强为起始时的80%。反应达到平衡时,则N2的转化率是_______ ,此时反应放出的热量_______ (填“>”、“=”或“<”)92.4 kJ。
(1)该反应的化学平衡常数表达式是K=
(2)该反应的化学平衡常数K与温度T的关系如表所示:
| T / K | 473 | 573 | 673 | …… |
| K | 4.4×10-2 | K1 | K2 | …… |
其中,K1
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是_______(填字母)。
| A.用铁触媒加快化学反应速率 | B.采用较高压强(20 MPa~50 MPa) |
| C.采用较高温度(400℃~500℃) | D.将生成的氨液化并及时从体系中分离出来 |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】今年是勒夏特列(LeChatelier1850-1936)诞生150周年。请用勒夏特列原理解释如下生活中的常见现象:打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫__________ 。
您最近一年使用:0次



