1 . 完成下列问题
(1)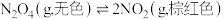 的平衡体系,降低温度,气体颜色变浅,则正反应是
的平衡体系,降低温度,气体颜色变浅,则正反应是___________ 热反应;若增大压强,平衡向___________ 移动(填“正反应方向”、“逆反应方向”或“不”),正反应速率___________ (填“增大”或“减小”)。
(2)某温度下,纯水的 为
为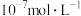 ,则此时
,则此时 为
为___________  ,若温度不变,滴入稀
,若温度不变,滴入稀 使
使 ,则由水电离出的
,则由水电离出的 为
为___________  ,某温度(T0℃)时,水的
,某温度(T0℃)时,水的 ,则该温度
,则该温度___________ (填“高于”、“低于”或“等于”)25℃其理由是___________ 。碳酸氢钠溶液显___________ 性,水解方程式表示为___________ 。
(1)
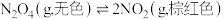 的平衡体系,降低温度,气体颜色变浅,则正反应是
的平衡体系,降低温度,气体颜色变浅,则正反应是(2)某温度下,纯水的
 为
为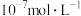 ,则此时
,则此时 为
为 ,若温度不变,滴入稀
,若温度不变,滴入稀 使
使 ,则由水电离出的
,则由水电离出的 为
为 ,某温度(T0℃)时,水的
,某温度(T0℃)时,水的 ,则该温度
,则该温度
您最近一年使用:0次
2 . CO2的回收与利用是科学家研究的热点课题。工业上有一种用 CO2生产甲醇燃料的方法:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。将6mol CO2和8mol H2充入2L的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线)。

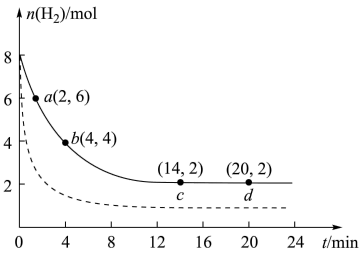
(1)a点正反应速率___________ (填大于、等于或小于)b点逆反应速率,前4min内,用CH3OH表示的平均反应速率为___________ mol/(L·min)(保留两位有效数字)。
(2)平衡时CO2的转化率为___________ ,该条件下反应的平衡常数K=___________ 。
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正___________ v逆(填“大于”,“小于”或者“等于”)。
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是___________ 。
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有___________ (写任意两个即可)。


(1)a点正反应速率
(2)平衡时CO2的转化率为
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有
您最近一年使用:0次
名校
3 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前生产苯乙烯的方法主要是乙苯催化脱氢法,反应方程式为:

(1)实际生产过程中,通常向乙苯中掺混氮气(N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1:0、1:1、1:5、1:9)。
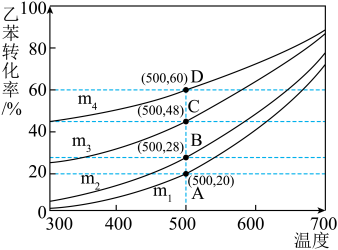
①乙苯催化脱氢反应的∆H______ 0(填“>”或“<”).
②投料比m为1:9的曲线是______ (填m1、m2、m3或m4).
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
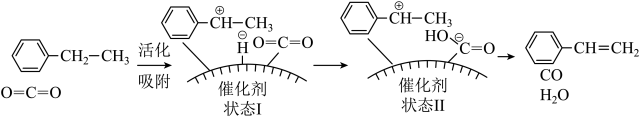
①该过程中发生的总反应化学方程式为______ .
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,乙苯的转化率______ (填“升高”或“降低”)。
(3)苯乙烯与溴苯在一定条件下发生Heck反应:

根据上表数据,下列说法正确的是______。

(1)实际生产过程中,通常向乙苯中掺混氮气(N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1:0、1:1、1:5、1:9)。

①乙苯催化脱氢反应的∆H
②投料比m为1:9的曲线是
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:

①该过程中发生的总反应化学方程式为
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,乙苯的转化率
(3)苯乙烯与溴苯在一定条件下发生Heck反应:

| 溴苯用量(mmol) | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| 催化剂用量(mmol) | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| 反应温度(℃) | 100 | 100 | 100 | 100 | 120 | 140 | 160 |
| 反应时间(h) | 10 | 12 | 14 | 16 | 14 | 14 | 14 |
| 4产率(%) | 81.2 | 84.4 | 86.6 | 86.2 | 93.5 | 96.6 | 89.0 |
| A.最佳反应温度为100℃ | B.最佳反应时间为16h |
| C.温度过高时催化剂活性可能降低 | D.反应产物是顺式结构 |
您最近一年使用:0次
名校
4 . 工业上常用CO和 合成甲醇,反应方程式为:
合成甲醇,反应方程式为:
 。在
。在 时,体积为2L的恒容容器中充入物质的量之和为3mol的
时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数(V%)与
的体积分数(V%)与 的关系如图所示。
的关系如图所示。
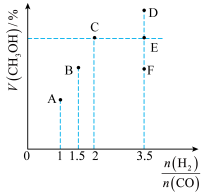
(1)当起始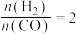 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
___________ 。
(2)B点的平衡常数为_______ (计算结果保留两位小数)。
(3)当起始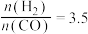 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图像中的
的体积分数可能是图像中的___________ 点(填“D”“E”或“F”)。
(4)由下图可知:
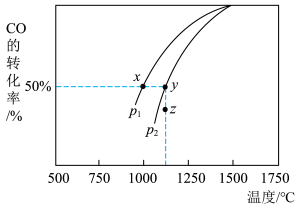
①该反应的
______ 0(填“>”“<”或“=”,下同)。
②相同起始量达到x、y时,容器内气体密度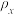
_______  。
。
③当压强为 时,在z点:
时,在z点:
_______  。
。
 合成甲醇,反应方程式为:
合成甲醇,反应方程式为:
 。在
。在 时,体积为2L的恒容容器中充入物质的量之和为3mol的
时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数(V%)与
的体积分数(V%)与 的关系如图所示。
的关系如图所示。
(1)当起始
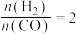 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
(2)B点的平衡常数为
(3)当起始
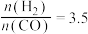 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图像中的
的体积分数可能是图像中的(4)由下图可知:

①该反应的

②相同起始量达到x、y时,容器内气体密度
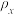
 。
。③当压强为
 时,在z点:
时,在z点:
 。
。
您最近一年使用:0次
名校
5 . 某温度下的密闭容器中:
①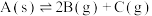 ;
;
②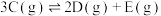
以上2个反应同时发生,10S后达平衡时, ,
,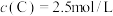 。
。
(1)加压时反应②的平衡___________ 移动。
A.向正反应方向 B.向逆反应方向 C.不移动
(2)该温度下反应①的平衡常数数值为___________ 。
①
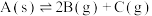 ;
;②
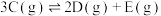
以上2个反应同时发生,10S后达平衡时,
 ,
,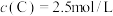 。
。(1)加压时反应②的平衡
A.向正反应方向 B.向逆反应方向 C.不移动
(2)该温度下反应①的平衡常数数值为
您最近一年使用:0次
名校
6 . 氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。
(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量_______ 92.4kJ(填“小于”、“大于”或“等于”)。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不移动”)。
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将_______ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________ (填“大于”、“小于”或“等于”)原来的2倍。
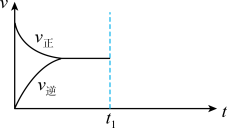
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
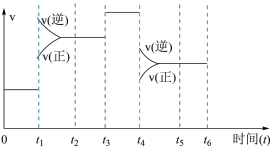
t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:________ 。
t3:________ 。
t4:________ 。
 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:
t3:
t4:
您最近一年使用:0次
名校
7 . 合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应 的化学平衡常数表达式为
的化学平衡常数表达式为___________ 。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是___________ 。
(3)对于反应 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。
①下列条件既能提高反应速率,又能升高氨的平衡含量的是___________ (填字母序号)。
a.加催化剂
b.升高温度至400-550度
c.采取10 MPa-30 MPa的高压条件
②哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是___________ 。
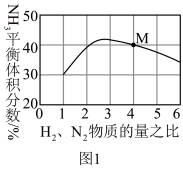
(4)图1表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M(4,40%)点数据计算)N2的平衡体积分数___________ 。
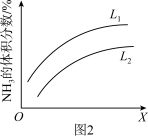
(5)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是___________ (填“温度”或“压强”);判断L1、L2的大小关系并说明理由___________ 。
(1)反应
 的化学平衡常数表达式为
的化学平衡常数表达式为(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① | 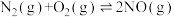 |  |
| ② |  | 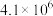 |
(3)对于反应
 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。| 温度/℃ | 压强/Mpa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
a.加催化剂
b.升高温度至400-550度
c.采取10 MPa-30 MPa的高压条件
②哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是
(4)图1表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M(4,40%)点数据计算)N2的平衡体积分数

(5)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是

您最近一年使用:0次
名校
8 . I.一定温度下,某容器中加入足量的碳酸钙发生反应: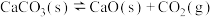 △H>0;一段时间后达到平衡。
△H>0;一段时间后达到平衡。
(1)该反应的化学平衡常数表达式为K=___________ ,为了提高CO2的生成率,可采取的措施___________ 。
A.减压 B.升温 C.增加碳酸钙的量 D.转移出CO2
(2)对于该反应,下列说法正确的是___________ 。
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B.将容器缩小为原来的一半,平衡不移动
C.将容器扩大为原来的两倍,平衡发生移动,再次平衡后,气体密度不变
D.增大压强,平衡逆向移动,K值减小
E.将体积增大为原来的2倍,再次达到平衡时,体系内压强不变
F.保持容器体积不变,充入He,平衡不移动
Ⅱ.
(3)在恒温恒压密闭容器中通入CO和H2O各1 发生反应
发生反应 ,当反应达到平衡后,维持温度与压强不变,
,当反应达到平衡后,维持温度与压强不变, 时再通入各1
时再通入各1 的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在
的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在 后随时间t变化的曲线图
后随时间t变化的曲线图___________ 。
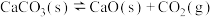 △H>0;一段时间后达到平衡。
△H>0;一段时间后达到平衡。(1)该反应的化学平衡常数表达式为K=
A.减压 B.升温 C.增加碳酸钙的量 D.转移出CO2
(2)对于该反应,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B.将容器缩小为原来的一半,平衡不移动
C.将容器扩大为原来的两倍,平衡发生移动,再次平衡后,气体密度不变
D.增大压强,平衡逆向移动,K值减小
E.将体积增大为原来的2倍,再次达到平衡时,体系内压强不变
F.保持容器体积不变,充入He,平衡不移动
Ⅱ.
(3)在恒温恒压密闭容器中通入CO和H2O各1
 发生反应
发生反应 ,当反应达到平衡后,维持温度与压强不变,
,当反应达到平衡后,维持温度与压强不变, 时再通入各1
时再通入各1 的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在
的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在 后随时间t变化的曲线图
后随时间t变化的曲线图
您最近一年使用:0次
名校
9 . 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中, 催化氧化生成
催化氧化生成 ,
,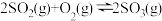 ,混合体系中
,混合体系中 的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
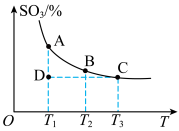
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___________ (填“向左“向右”或“不”)移动。
②若反应进行到状态D时,
___________ (填“>”“<”或“=”) 。
。
(2)课本里介绍的合成氨技术叫哈伯法: ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________ (填字母)。
A.使用更高效的催化剂 B.升高温度
C.及时分离出氨 D.充入氮气,增大氮气的浓度(保持容器体积不变)
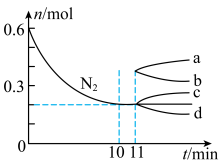
②若在某温度下,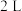 的密闭容器中发生合成氨的反应,下图表示
的密闭容器中发生合成氨的反应,下图表示 的物质的量随时间的变化曲线。从第
的物质的量随时间的变化曲线。从第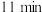 起,压缩容器的体积为
起,压缩容器的体积为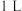 ,则
,则 的变化曲线为
的变化曲线为___________ (填字母)。
(1)硫酸生产中,
 催化氧化生成
催化氧化生成 ,
,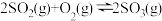 ,混合体系中
,混合体系中 的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
②若反应进行到状态D时,

 。
。(2)课本里介绍的合成氨技术叫哈伯法:
 ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂 B.升高温度
C.及时分离出氨 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,
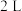 的密闭容器中发生合成氨的反应,下图表示
的密闭容器中发生合成氨的反应,下图表示 的物质的量随时间的变化曲线。从第
的物质的量随时间的变化曲线。从第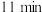 起,压缩容器的体积为
起,压缩容器的体积为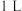 ,则
,则 的变化曲线为
的变化曲线为
您最近一年使用:0次
名校
10 . 合成氨工艺是人工固氮最重要的途径。请回答:
(1)合成氨时压强越大,原料的转化率越高,我国合成氨厂采用的压强为10Mpa-30Mpa,没有采用过大的压强的原因是___________ 。
(2)当温度、压强一定时,在原料气( 和
和 的比例不变)中添加少量惰性气体,
的比例不变)中添加少量惰性气体,_______ 利于提高平衡转化率(填“是”或“不”)。
(3)合成氨的原料气 可以通过天然气和二氧化碳转化制备,已知
可以通过天然气和二氧化碳转化制备,已知 、
、 和CO的燃烧热(△H)分别为
和CO的燃烧热(△H)分别为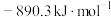 、
、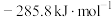 、
、 。则制备
。则制备 的热化学反应方程式为
的热化学反应方程式为___________________ ;合成氨前,原料气必须经过净化处理,以防止___________ 和安全事故发生。
(4)若将2.0mol 和6.0mol
和6.0mol  通入体积为1L的密闭容器中,分别在
通入体积为1L的密闭容器中,分别在 和
和 温度下进行反应。曲线A表示
温度下进行反应。曲线A表示 温度下
温度下 的变化,曲线B表示
的变化,曲线B表示 温度下
温度下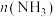 的变化,
的变化, 温度下反应到a点恰好达到平衡。
温度下反应到a点恰好达到平衡。

①温度
___________ (填“>”“<”或“=”下同) 。
。 温度下曲线B上的点
温度下曲线B上的点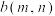 为恰好平衡时的点,则m
为恰好平衡时的点,则m___________ 12,n___________ 2;
② 温度下,若某时刻容器内气体的压强为起始时的80%,则此时v(正)
温度下,若某时刻容器内气体的压强为起始时的80%,则此时v(正)___________ (填“>”“<”或“=”)v(逆)。
(1)合成氨时压强越大,原料的转化率越高,我国合成氨厂采用的压强为10Mpa-30Mpa,没有采用过大的压强的原因是
(2)当温度、压强一定时,在原料气(
 和
和 的比例不变)中添加少量惰性气体,
的比例不变)中添加少量惰性气体,(3)合成氨的原料气
 可以通过天然气和二氧化碳转化制备,已知
可以通过天然气和二氧化碳转化制备,已知 、
、 和CO的燃烧热(△H)分别为
和CO的燃烧热(△H)分别为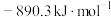 、
、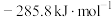 、
、 。则制备
。则制备 的热化学反应方程式为
的热化学反应方程式为(4)若将2.0mol
 和6.0mol
和6.0mol  通入体积为1L的密闭容器中,分别在
通入体积为1L的密闭容器中,分别在 和
和 温度下进行反应。曲线A表示
温度下进行反应。曲线A表示 温度下
温度下 的变化,曲线B表示
的变化,曲线B表示 温度下
温度下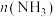 的变化,
的变化, 温度下反应到a点恰好达到平衡。
温度下反应到a点恰好达到平衡。
①温度

 。
。 温度下曲线B上的点
温度下曲线B上的点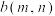 为恰好平衡时的点,则m
为恰好平衡时的点,则m②
 温度下,若某时刻容器内气体的压强为起始时的80%,则此时v(正)
温度下,若某时刻容器内气体的压强为起始时的80%,则此时v(正)
您最近一年使用:0次
2023-10-23更新
|
195次组卷
|
2卷引用:辽宁省实验中学2023-2024学年高二上学期10月月考化学试题



