名校
1 . 我国提出2060年达“碳中和”目标,将CO2转化为高附加值产品是实现该目标的一种方式,如:CH3OH、HCOOH等。回答下列问题:
(1)下列措施有利于“碳中和”的是_____。
CO2和H2在催化剂作用下发生反应可合成清洁能源甲醇:
(2)已知该反应的正反应率 (k为正反应的速率常数),某温度时测得数据如表中所示。则此温度下表中a=
(k为正反应的速率常数),某温度时测得数据如表中所示。则此温度下表中a=_____ 。
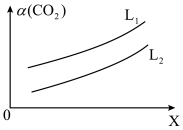
(3)在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图所示,该反应为放热反应,L和X分别表示温度或压强。X表示的物理量是_____ (填“温度”或“压强”),L1_____ L2(填“>”或“<”)。
(1)下列措施有利于“碳中和”的是_____。
| A.植树造林,发展绿色经济 | B.通过裂化将重油转化为汽油 |
| C.在燃煤中添加CaO或CaCO3 | D.大力开采和使用可燃冰 |
CO2和H2在催化剂作用下发生反应可合成清洁能源甲醇:

(2)已知该反应的正反应率
 (k为正反应的速率常数),某温度时测得数据如表中所示。则此温度下表中a=
(k为正反应的速率常数),某温度时测得数据如表中所示。则此温度下表中a=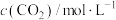 | 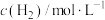 |  | |
| 1 | 0.02 | 0.01 | 2.0×10-4 |
| 2 | 0.04 | 0.01 | a |
(3)在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图所示,该反应为放热反应,L和X分别表示温度或压强。X表示的物理量是

您最近半年使用:0次
2 . 完成下列问题
(1)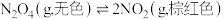 的平衡体系,降低温度,气体颜色变浅,则正反应是
的平衡体系,降低温度,气体颜色变浅,则正反应是___________ 热反应;若增大压强,平衡向___________ 移动(填“正反应方向”、“逆反应方向”或“不”),正反应速率___________ (填“增大”或“减小”)。
(2)某温度下,纯水的 为
为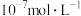 ,则此时
,则此时 为
为___________  ,若温度不变,滴入稀
,若温度不变,滴入稀 使
使 ,则由水电离出的
,则由水电离出的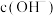 为
为___________  ,某温度(T0℃)时,水的
,某温度(T0℃)时,水的 ,则该温度
,则该温度___________ (填“高于”、“低于”或“等于”)25℃其理由是___________ 。碳酸氢钠溶液显___________ 性,水解方程式表示为___________ 。
(1)
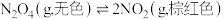 的平衡体系,降低温度,气体颜色变浅,则正反应是
的平衡体系,降低温度,气体颜色变浅,则正反应是(2)某温度下,纯水的
 为
为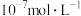 ,则此时
,则此时 为
为 ,若温度不变,滴入稀
,若温度不变,滴入稀 使
使 ,则由水电离出的
,则由水电离出的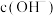 为
为 ,某温度(T0℃)时,水的
,某温度(T0℃)时,水的 ,则该温度
,则该温度
您最近半年使用:0次
3 . 卤素化合物在生产生活中应用广泛,回答下列问题
(1)研究表明 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: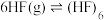 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是____________ ;在测定 相对分子质量的实验中,
相对分子质量的实验中,____________ (填“低压”或“高压”)有利于测定的准确性.
(2) 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为__________ ;产物中的另一种气体可以起到的作用是________________ .
(3) 与
与 以共价键形成
以共价键形成 ,其中
,其中________ 显负电性, 与水反应的方程式是
与水反应的方程式是____________ .
(4)利用 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: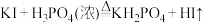 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:________ (“强酸性”“强氧化性”“高沸点”).
(1)研究表明
 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: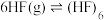 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是 相对分子质量的实验中,
相对分子质量的实验中,(2)
 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为(3)
 与
与 以共价键形成
以共价键形成 ,其中
,其中 与水反应的方程式是
与水反应的方程式是(4)利用
 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:
您最近半年使用:0次
4 . CO2的回收与利用是科学家研究的热点课题。工业上有一种用 CO2生产甲醇燃料的方法:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。将6mol CO2和8mol H2充入2L的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线)。

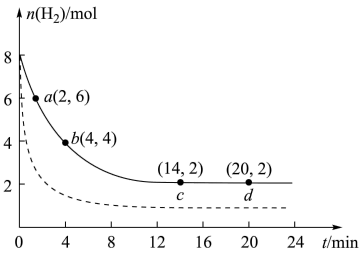
(1)a点正反应速率___________ (填大于、等于或小于)b点逆反应速率,前4min内,用CH3OH表示的平均反应速率为___________ mol/(L·min)(保留两位有效数字)。
(2)平衡时CO2的转化率为___________ ,该条件下反应的平衡常数K=___________ 。
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正___________ v逆(填“大于”,“小于”或者“等于”)。
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是___________ 。
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有___________ (写任意两个即可)。


(1)a点正反应速率
(2)平衡时CO2的转化率为
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有
您最近半年使用:0次
名校
5 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前生产苯乙烯的方法主要是乙苯催化脱氢法,反应方程式为:

(1)实际生产过程中,通常向乙苯中掺混氮气(N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1:0、1:1、1:5、1:9)。
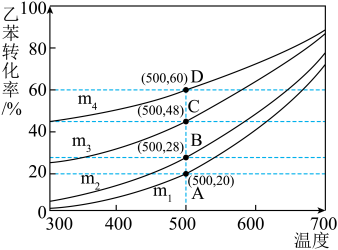
①乙苯催化脱氢反应的∆H______ 0(填“>”或“<”).
②投料比m为1:9的曲线是______ (填m1、m2、m3或m4).
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
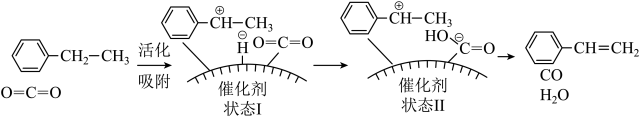
①该过程中发生的总反应化学方程式为______ .
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,乙苯的转化率______ (填“升高”或“降低”)。
(3)苯乙烯与溴苯在一定条件下发生Heck反应:

根据上表数据,下列说法正确的是______。

(1)实际生产过程中,通常向乙苯中掺混氮气(N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1:0、1:1、1:5、1:9)。

①乙苯催化脱氢反应的∆H
②投料比m为1:9的曲线是
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:

①该过程中发生的总反应化学方程式为
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,乙苯的转化率
(3)苯乙烯与溴苯在一定条件下发生Heck反应:

| 溴苯用量(mmol) | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| 催化剂用量(mmol) | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| 反应温度(℃) | 100 | 100 | 100 | 100 | 120 | 140 | 160 |
| 反应时间(h) | 10 | 12 | 14 | 16 | 14 | 14 | 14 |
| 4产率(%) | 81.2 | 84.4 | 86.6 | 86.2 | 93.5 | 96.6 | 89.0 |
| A.最佳反应温度为100℃ | B.最佳反应时间为16h |
| C.温度过高时催化剂活性可能降低 | D.反应产物是顺式结构 |
您最近半年使用:0次
名校
解题方法
6 . 可逆反应: ;根据图回答:
;根据图回答: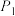
___________ 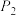 ;(a+b)
;(a+b) ___________ (c+d) (填“>”或“<”下同)。
(2)温度 ℃
℃___________  ℃:ΔH
℃:ΔH___________ 0。
(3)保持体积和温度不变,通入He,平衡会___________ 移动(填“正向”、“逆向”或“不”)。
 ;根据图回答:
;根据图回答: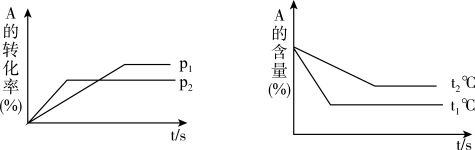
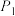
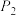 ;(a+b)
;(a+b) (2)温度
 ℃
℃ ℃:ΔH
℃:ΔH(3)保持体积和温度不变,通入He,平衡会
您最近半年使用:0次
2024-01-26更新
|
60次组卷
|
2卷引用:安徽省安庆市第二中学2022-2023学年高二下学期6月阶段性测试化学试题
名校
7 . 工业上常用CO和 合成甲醇,反应方程式为:
合成甲醇,反应方程式为:
 。在
。在 时,体积为2L的恒容容器中充入物质的量之和为3mol的
时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数(V%)与
的体积分数(V%)与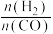 的关系如图所示。
的关系如图所示。
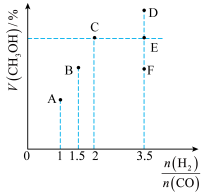
(1)当起始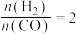 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
___________ 。
(2)B点的平衡常数为_______ (计算结果保留两位小数)。
(3)当起始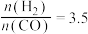 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图像中的
的体积分数可能是图像中的___________ 点(填“D”“E”或“F”)。
(4)由下图可知:
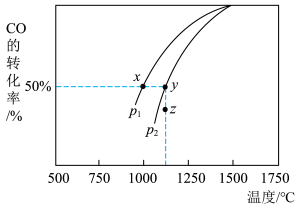
①该反应的
______ 0(填“>”“<”或“=”,下同)。
②相同起始量达到x、y时,容器内气体密度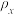
_______  。
。
③当压强为 时,在z点:
时,在z点:
_______  。
。
 合成甲醇,反应方程式为:
合成甲醇,反应方程式为:
 。在
。在 时,体积为2L的恒容容器中充入物质的量之和为3mol的
时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数(V%)与
的体积分数(V%)与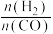 的关系如图所示。
的关系如图所示。
(1)当起始
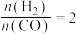 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
(2)B点的平衡常数为
(3)当起始
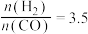 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图像中的
的体积分数可能是图像中的(4)由下图可知:

①该反应的

②相同起始量达到x、y时,容器内气体密度
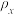
 。
。③当压强为
 时,在z点:
时,在z点:
 。
。
您最近半年使用:0次
名校
8 . 某温度下的密闭容器中:
①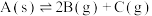 ;
;
②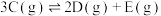
以上2个反应同时发生,10S后达平衡时, ,
,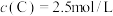 。
。
(1)加压时反应②的平衡___________ 移动。
A.向正反应方向 B.向逆反应方向 C.不移动
(2)该温度下反应①的平衡常数数值为___________ 。
①
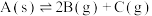 ;
;②
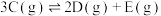
以上2个反应同时发生,10S后达平衡时,
 ,
,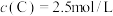 。
。(1)加压时反应②的平衡
A.向正反应方向 B.向逆反应方向 C.不移动
(2)该温度下反应①的平衡常数数值为
您最近半年使用:0次
名校
9 . 氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。
(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量_______ 92.4kJ(填“小于”、“大于”或“等于”)。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不移动”)。
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将_______ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________ (填“大于”、“小于”或“等于”)原来的2倍。
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:________ 。
t3:________ 。
t4:________ 。
 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:
t3:
t4:
您最近半年使用:0次
名校
10 . 合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应 的化学平衡常数表达式为
的化学平衡常数表达式为___________ 。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是___________ 。
(3)对于反应 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。
①下列条件既能提高反应速率,又能升高氨的平衡含量的是___________ (填字母序号)。
a.加催化剂
b.升高温度至400-550度
c.采取10 MPa-30 MPa的高压条件
②哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是___________ 。
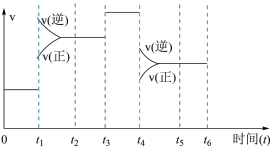
(4)图1表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M(4,40%)点数据计算)N2的平衡体积分数___________ 。
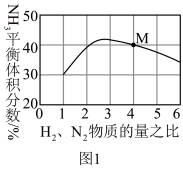
(5)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是___________ (填“温度”或“压强”);判断L1、L2的大小关系并说明理由___________ 。
(1)反应
 的化学平衡常数表达式为
的化学平衡常数表达式为(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① | 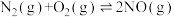 |  |
| ② |  | 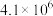 |
(3)对于反应
 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。| 温度/℃ | 压强/Mpa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
a.加催化剂
b.升高温度至400-550度
c.采取10 MPa-30 MPa的高压条件
②哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是
(4)图1表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M(4,40%)点数据计算)N2的平衡体积分数

(5)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是

您最近半年使用:0次



