名校
解题方法
1 . 在一定条件下,可逆反应mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是___ 。
(2)A、C是气体,增加B的量,平衡不移动,则B为___ 。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是___ 。
(4)加热后,可使 的质量增加,则正反应是
的质量增加,则正反应是___ (填“放热”或“吸热”)反应。
 pC达到平衡,若:
pC达到平衡,若:(1)A、B、C都是气体,减小压强,平衡正向移动,则m+n和p的关系是
(2)A、C是气体,增加B的量,平衡不移动,则B为
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使
 的质量增加,则正反应是
的质量增加,则正反应是
您最近一年使用:0次
2021-10-24更新
|
108次组卷
|
31卷引用:2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷
2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2010年江苏省启东中学高二上学期期中考试化学卷(已下线)2010-2011学年广东省深圳高级中学高二下学期期中考试化学试卷(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试题(理)(已下线)2011-2012年河北省南宫中学高二上学期9月份月考化学(理)试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷(已下线)2011-2012年安徽红星中安工大附中高二下学期期中联考理科化学试卷(已下线)2011-2012学年广东始兴县风度中学高二下学期期中考试理综化学试卷(已下线)2011-2012学年广东省始兴县风度中学高二下学期期末考试理综化学卷(已下线)2012-2013学年甘肃省兰州一中高二上学期期末考试化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷2014-2015学年天津市宝坻区四校高二11月联考化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2015-2016学年天津市和平区高二上学期期末考试化学试卷2015-2016学年湖南省怀化市会同三中高二上12月月考化学试卷2016-2017学年吉林省汪清六中高二上第一次月考化学试卷内蒙古阿拉善左旗高级中学2017-2018学年高二上学期期末考试化学试题甘肃省武威第五中学2017-2018学年高二下学期第二次月考化学试题甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题黑龙江省齐齐哈尔市龙江二中2019-2020学年高二12月月考化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期9月月考化学试题西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期第一次月考化学试题
2 . 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
①试比较K1、K2的大小,K1___ K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是___ (填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,2NH3(g) N2(g)+3H2(g)的K′=
N2(g)+3H2(g)的K′=___ (填数值)。
④400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正___ v(N2)逆(填“>”、“<”“=”或“不能确定”)。
⑤若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡___ (填“向左”、“向右”或“不”)移动;使用催化剂__ (填“增大”、“减小”或“不改变”)反应的ΔH。
在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)
 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,2NH3(g)
 N2(g)+3H2(g)的K′=
N2(g)+3H2(g)的K′=④400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
⑤若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡
您最近一年使用:0次
解题方法
3 . Ⅰ.反应N2(g)+3H2(g) 2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是_________________________ 。
(2)由第一次平衡到第二次平衡,采取的措施是______________________ 。
Ⅱ.在一定温度下,向一容积为5L的恒容密闭容器中充入0.4mol SO2和0.2mol O2,发生反应: 2SO2(g)+O2(g) 2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(3)上述反应达到平衡时反应放出的热量为__________ 。
(4)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1_____ T2(填“>”“<”或“=”)。

Ⅲ.一定温度下,在1L恒容密闭容器中充入一定量C2H4(g)和H2O(g),发生如下反应: C2H4(g)+H2O(g) CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。

(5)N点: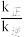
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(6)温度为T1时,测定平衡体系中c(H2O)=0.25 mol·L-1,则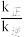 =
=______ L·mol -1。
 2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是
(2)由第一次平衡到第二次平衡,采取的措施是
Ⅱ.在一定温度下,向一容积为5L的恒容密闭容器中充入0.4mol SO2和0.2mol O2,发生反应: 2SO2(g)+O2(g)
 2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(3)上述反应达到平衡时反应放出的热量为
(4)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1

Ⅲ.一定温度下,在1L恒容密闭容器中充入一定量C2H4(g)和H2O(g),发生如下反应: C2H4(g)+H2O(g)
 CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
(5)N点:
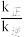
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(6)温度为T1时,测定平衡体系中c(H2O)=0.25 mol·L-1,则
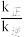 =
=
您最近一年使用:0次
名校
解题方法
4 . 现有反应

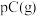 ,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:
,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:
(1)该反应的逆反应为________ (填“放热”或“吸热”)反应,且
________ (填“>”“=”或“<”)p。
(2)在恒容条件下加入B,则A的转化率________ (填“增大”“减小”或“不变”,下同),B的转化率________ 。
(3)若升高温度,则平衡时B、C的浓度之比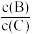 将
将________ (填“增大”“减小”或“不变”)。
(4)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色________ (填“变深”“变浅”或“不变”,下同);而维持容器内压强不变,充入氖气时,混合物的颜色________ 。


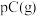 ,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:
,达到平衡后,升高温度,B的转化率变大;减小压强,混合物体系中C的质量分数减小,则:(1)该反应的逆反应为

(2)在恒容条件下加入B,则A的转化率
(3)若升高温度,则平衡时B、C的浓度之比
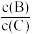 将
将(4)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色
您最近一年使用:0次
2020-10-06更新
|
445次组卷
|
5卷引用:步步为赢 高二化学寒假作业:作业四 化学平衡移动原理
步步为赢 高二化学寒假作业:作业四 化学平衡移动原理人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡辽宁师范大学附属中学2021-2022学年高二上学期10月月考化学试题(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)黑龙江嫩江市高级中学等八校2021-2022学年高二上学期9月联合考试化学试题
名校
5 . 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g) CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__ ;根据图,升高温度,K值将__ (填“增大”、“减小”或“不变”)。
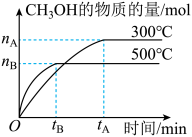
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__ (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__ (填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是____ 。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时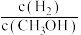 减小
减小
 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。(1)该反应的平衡常数表达式K=

(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是
(3)判断该可逆反应达到化学平衡状态的标志是
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的
 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时
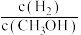 减小
减小
您最近一年使用:0次
2019-11-26更新
|
647次组卷
|
22卷引用:辽宁省瓦房店市高级中学2016-2017学年高一6月基础知识竞赛化学试题
辽宁省瓦房店市高级中学2016-2017学年高一6月基础知识竞赛化学试题2015-2016学年湖南省常德一中高二上学期期末理化学试卷2017届广东省韶关市六校高三上10月联考化学试卷山西省朔州市第一中学2017-2018学年高二8月月考化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】内蒙古集宁一中(西校区)2018-2019学年高二上学期第一次月考理科综合化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题内蒙古自治区通辽市开鲁县第一中学2019-2020学年高一下学期期末考试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学试题(普通版)(已下线)第10单元 化学反应速率与化学平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题安徽省安庆市九一六学校2020-2021学年高二3月月考化学试题四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题新疆疏勒县实验学校2021-2022学年高二上学期期末考试化学试题陕西省渭南市华州区咸林中学2023-2024学年高二上学期第二次月考化学试卷
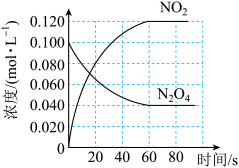
6 . 容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH__ 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___ mol/(L·s);反应的平衡常数K1为_____ 。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以平均速率0.002 0mol/(L·s)降低,经10s又达到平衡。
①T___ 100℃(填“大于”或“小于”)
②计算温度T时反应的平衡常数K2为_____ 。
(3)温度T时反应达平衡后,将反应容器的容积增大一倍。平衡向___ (填“正反应”或“逆反应”)方向移动,判断理由是___ 。
 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH

(2)100℃时达到平衡后,改变反应温度为T,N2O4以平均速率0.002 0mol/(L·s)降低,经10s又达到平衡。
①T
②计算温度T时反应的平衡常数K2为
(3)温度T时反应达平衡后,将反应容器的容积增大一倍。平衡向
您最近一年使用:0次
7 . 在一定条件下,aA+bB cC的可逆反应达到平衡:
cC的可逆反应达到平衡:
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则a、b、c的关系是:_____ 。
(2)已知A为固体、B为无色气体、C是有色气体,且(a+b)=c,在加压时,平衡向____ 方向移动,气体的颜色将___ (填“加深”或“变浅”或“不变”)。
(3)加热后C的质量分数减少,则正反应是___ 热反应。
 cC的可逆反应达到平衡:
cC的可逆反应达到平衡:(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则a、b、c的关系是:
(2)已知A为固体、B为无色气体、C是有色气体,且(a+b)=c,在加压时,平衡向
(3)加热后C的质量分数减少,则正反应是
您最近一年使用:0次
2018-12-21更新
|
108次组卷
|
3卷引用:辽宁省大连市普兰店市第一中学2019-2020学年高二上学期期末考试化学试题
8 . 2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________ ,4 min末CO的浓度为_____________ mol•L-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________ 。

 N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是

您最近一年使用:0次
2018-01-10更新
|
346次组卷
|
5卷引用:辽宁大石桥市第三高级中学2020-2021学年高二上学期期中考试化学试题
11-12高二上·辽宁沈阳·阶段练习
9 . 自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g)△H =-148.9 kJ·mol-1。
SiF4(g)+ 2H2O(g)△H =-148.9 kJ·mol-1。
根据题意完成下列填空:
(1)在地壳深处容易有________ 气体逸出,在地壳浅处容易有________ 沉积。
(2)如果上述反应的平衡常数K值变大,该反应________ (选填编号)。
a.一定向正反应方向移动b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动d.在平衡移动时逆反应速率先减小后增大
(3)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为___________ 。
 SiF4(g)+ 2H2O(g)△H =-148.9 kJ·mol-1。
SiF4(g)+ 2H2O(g)△H =-148.9 kJ·mol-1。根据题意完成下列填空:
(1)在地壳深处容易有
(2)如果上述反应的平衡常数K值变大,该反应
a.一定向正反应方向移动b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动d.在平衡移动时逆反应速率先减小后增大
(3)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为
您最近一年使用:0次



