1 . 氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
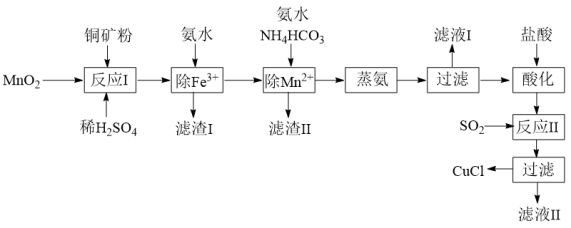
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:__________ 。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________ 。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
由表中信息可知蒸氨的条件应选_______ (填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________ 。
(4)反应Ⅱ的离子方程式___________________________ 。
(5)实验证明通过如图装置也可获得CuCl,现象为阴极:产生无色气体;阳极:有白色胶状沉淀生成且逐渐增多;U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
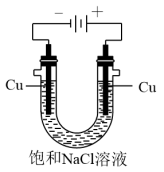
①生成CuCl的电极反应式为________________________________ 。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________ 。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3
 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式
(5)实验证明通过如图装置也可获得CuCl,现象为阴极:产生无色气体;阳极:有白色胶状沉淀生成且逐渐增多;U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。

①生成CuCl的电极反应式为
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
您最近半年使用:0次
2 . 化学是一门以实验为基础的学科,回答下列问题:
I.[Cu(NH3)4]SO4·H2O 晶体制备。
(1)向盛有 4 mL 0.1 mol/L CuSO4溶液的试管里滴加几滴 1 mol/L 氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为___________ ,写出难溶物与氨反应的离子方程式:___________ 。再向试管中加入极性较___________ 的试剂乙醇(填“大”或“小”),并用玻璃棒摩擦试管壁,可以观察到有___________ 色的[Cu(NH3)4]SO4·H2O 晶体析出。
(2)检验晶体中是否含有 SO 的方法是
的方法是___________ 。
II.温度对化学反应速率的影响。
(3)不同温度下分别进行硫代硫酸钠与硫酸的反应,写出该反应的化学方程式:___________ ,可以通过比较___________ ,判断该反应进行的快慢。
III.压强对化学平衡的影响。

(4)如上图所示,用 50 mL 注射器吸入 20 mL NO2和N2O4的混合气体(使注射器的活塞位于 I 处),将细管端用胶塞封闭。然后把活塞拉到Ⅱ处,观察到管内混合气体的颜色先变___________ (填“深”或“浅”),又逐渐变___________ (填“深”或“浅”),气体颜色变化的原因是___________ 。
I.[Cu(NH3)4]SO4·H2O 晶体制备。
(1)向盛有 4 mL 0.1 mol/L CuSO4溶液的试管里滴加几滴 1 mol/L 氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为
(2)检验晶体中是否含有 SO
 的方法是
的方法是II.温度对化学反应速率的影响。
(3)不同温度下分别进行硫代硫酸钠与硫酸的反应,写出该反应的化学方程式:
III.压强对化学平衡的影响。

(4)如上图所示,用 50 mL 注射器吸入 20 mL NO2和N2O4的混合气体(使注射器的活塞位于 I 处),将细管端用胶塞封闭。然后把活塞拉到Ⅱ处,观察到管内混合气体的颜色先变
您最近半年使用:0次
3 .  可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
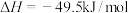
反应2:
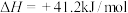 (副反应)
(副反应)
(1) ,该反应的
,该反应的
___________  。
。
(2)将 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (保留两位有效数字)。
④分子筛膜反应器可提高反应1的平衡转化率、且实现 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是___________ 。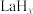 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
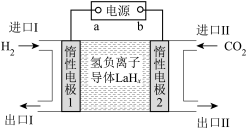
①电极a为电源的___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为___________ (
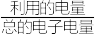 ×100%)。
×100%)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

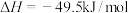
反应2:

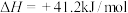 (副反应)
(副反应)(1)
 ,该反应的
,该反应的
 。
。(2)将
 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

④分子筛膜反应器可提高反应1的平衡转化率、且实现
 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是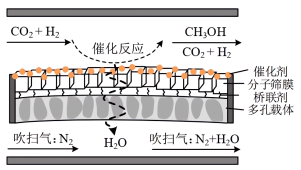
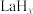 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
①电极a为电源的
②生成
 的电极反应式为
的电极反应式为③若反应2也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为
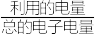 ×100%)。
×100%)。
您最近半年使用:0次
2023-06-03更新
|
674次组卷
|
5卷引用:重庆市巴蜀中学校2023学年高三模拟预测化学试题
重庆市巴蜀中学校2023学年高三模拟预测化学试题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)广西名校2023-2024学年高三上学期仿真卷(一)化学试题湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题湖南省宁乡市实验中学等多校联考2024届高三下学期一轮复习总结性考试(月考)化学试题
4 . 甲烷的直接转化具有较高的经济价值,因此备受科学家关注。请回答下列问题:
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I:CH4(g)+ O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1
方法II:CH4(g)+H2O(g) CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2
已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ•mol-1,则△H2=_______ 。
(2)某工厂采用方法Ⅰ生产甲醇。在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。
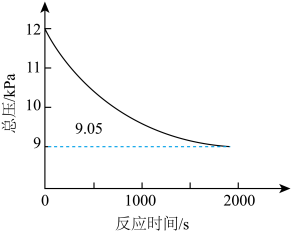
①下列措施可以提高CH4的平衡转化率的是_______ (填标号)。
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为_______ (精确到0.1%)。
③该反应温度下,方法I的标准压力平衡常数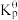 =
=_______ (列出计算式)。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g),
gG(g)+hH(g), 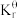 =
=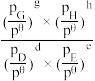 ,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是_______ 。
(3)为提高生产效率,利用方法Ⅱ进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。
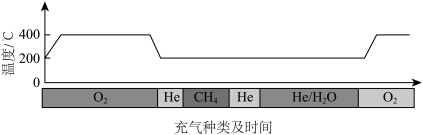
已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是_______ ;请从反应速率的角度说明,通入CH4后反应温度维持在200℃的原因:_______ 。
(4)用ZrO2/NiCo2O4作电解催化剂也可以实现甲烷的直接转化,装置如图所示。
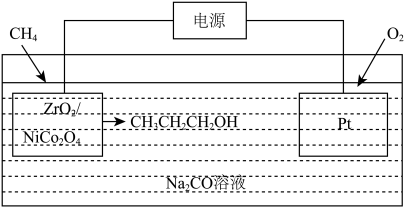
写出ZrO2/NiCo2O4电极的反应式:_______ 。
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I:CH4(g)+
 O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1方法II:CH4(g)+H2O(g)
 CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ•mol-1,则△H2=
(2)某工厂采用方法Ⅰ生产甲醇。在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。

①下列措施可以提高CH4的平衡转化率的是
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为
③该反应温度下,方法I的标准压力平衡常数
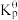 =
= gG(g)+hH(g),
gG(g)+hH(g), 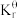 =
=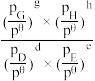 ,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是
(3)为提高生产效率,利用方法Ⅱ进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。

已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是
(4)用ZrO2/NiCo2O4作电解催化剂也可以实现甲烷的直接转化,装置如图所示。

写出ZrO2/NiCo2O4电极的反应式:
您最近半年使用:0次
名校
5 . 二氧化碳的排放越来越受到能源和环境领域的关注。其综合利用是目前研究的重要课题之一,试运用所学知识,解决以下问题:
(1)CO2加氢时主要发生以下两个反应:
反应 I CO2 (g)+4H2 (g) CH4 (g)+2H2O(g) ΔH=-165.0 kJ•mol-1
CH4 (g)+2H2O(g) ΔH=-165.0 kJ•mol-1
反应II CO2 (g)+H2 (g) CO(g)+H2O(g) ΔH=+41. 18 kJ•mol-1
CO(g)+H2O(g) ΔH=+41. 18 kJ•mol-1
在密闭容器中按H23mol、CO21mol 通入,初始体积均为 VL,分别在0. 1MPa和1 MPa下进行反应。分析温度对平衡体系中 CO2、CO、CH4的影响,设这三种气体物质的量分数之和为 1,其中CO 和 CH4的物质的量分数与温度变化关系如图所示。
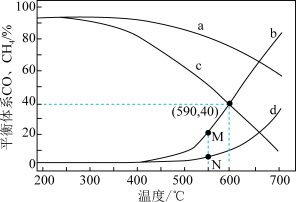
①表示0. 1 MPa 时CH4物质的量分数随温度变化关系的曲线是___________ (填序号) 。
② N点低于M点的原因是___________ 。
③ 590 ℃时反应 I的平衡常数K=___________ (用含 V 的代数式表示)
(2)利用电化学方法可以将CO2有效地转化为HCOO-,装置如下图所示。
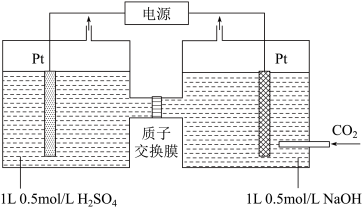
①在该装置中,右侧 Pt电极的电极反应式为___________ 。
②已知装置工作时,阴极除有 HCOO-生成外,还可能生成副产物 H2降低电解效率。
电解效率=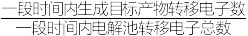 ×100%
×100%
测得阴极区内的 c(HCOO- )=0.015mol/L,电解效率为 75%,则阴极和阳极生成的气体在标准状况下的体积总共___________ mL。(忽略电解前后溶液的体积变化)
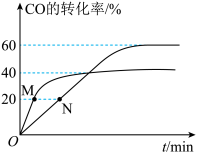
(3)已知水煤气法制备 H2的反应为 CO(g)+ H2O(g) CO2(g)+ H2(g),将等体积的 CO(g)和 H2O (g)充入恒容密闭容器中,反应速率v= v正-v逆= k正c(CO)∙c(H2O)-k逆c(CO2)∙c(H2),其中k正、k逆分别为正、逆反应的速率常数且只与温度有关,在 700℃和 800℃时,CO 的转化率随时间变化的曲线如图所示。M 点与N点对应的的
CO2(g)+ H2(g),将等体积的 CO(g)和 H2O (g)充入恒容密闭容器中,反应速率v= v正-v逆= k正c(CO)∙c(H2O)-k逆c(CO2)∙c(H2),其中k正、k逆分别为正、逆反应的速率常数且只与温度有关,在 700℃和 800℃时,CO 的转化率随时间变化的曲线如图所示。M 点与N点对应的的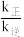 大小关系为:M
大小关系为:M_____ N(填“>” 、“<”或“=”)
(1)CO2加氢时主要发生以下两个反应:
反应 I CO2 (g)+4H2 (g)
 CH4 (g)+2H2O(g) ΔH=-165.0 kJ•mol-1
CH4 (g)+2H2O(g) ΔH=-165.0 kJ•mol-1反应II CO2 (g)+H2 (g)
 CO(g)+H2O(g) ΔH=+41. 18 kJ•mol-1
CO(g)+H2O(g) ΔH=+41. 18 kJ•mol-1在密闭容器中按H23mol、CO21mol 通入,初始体积均为 VL,分别在0. 1MPa和1 MPa下进行反应。分析温度对平衡体系中 CO2、CO、CH4的影响,设这三种气体物质的量分数之和为 1,其中CO 和 CH4的物质的量分数与温度变化关系如图所示。

①表示0. 1 MPa 时CH4物质的量分数随温度变化关系的曲线是
② N点低于M点的原因是
③ 590 ℃时反应 I的平衡常数K=
(2)利用电化学方法可以将CO2有效地转化为HCOO-,装置如下图所示。

①在该装置中,右侧 Pt电极的电极反应式为
②已知装置工作时,阴极除有 HCOO-生成外,还可能生成副产物 H2降低电解效率。
电解效率=
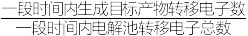 ×100%
×100%测得阴极区内的 c(HCOO- )=0.015mol/L,电解效率为 75%,则阴极和阳极生成的气体在标准状况下的体积总共
(3)已知水煤气法制备 H2的反应为 CO(g)+ H2O(g)
 CO2(g)+ H2(g),将等体积的 CO(g)和 H2O (g)充入恒容密闭容器中,反应速率v= v正-v逆= k正c(CO)∙c(H2O)-k逆c(CO2)∙c(H2),其中k正、k逆分别为正、逆反应的速率常数且只与温度有关,在 700℃和 800℃时,CO 的转化率随时间变化的曲线如图所示。M 点与N点对应的的
CO2(g)+ H2(g),将等体积的 CO(g)和 H2O (g)充入恒容密闭容器中,反应速率v= v正-v逆= k正c(CO)∙c(H2O)-k逆c(CO2)∙c(H2),其中k正、k逆分别为正、逆反应的速率常数且只与温度有关,在 700℃和 800℃时,CO 的转化率随时间变化的曲线如图所示。M 点与N点对应的的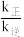 大小关系为:M
大小关系为:M
您最近半年使用:0次
6 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g) CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1
写出以甲醇为原料制取氢气的热化学方程式___________ 。
(2)理论上,能提高H2平衡产率的措施有___________ (写出一条即可)。
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式___________ 。
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是___________ 。

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。
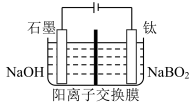
①钛电极的电极反应式是___________ ;
②电解过程中,阴极区溶液pH___________ 。(填“增大”“减小”或“不变”)
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g)
 CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1CO(g)+H2O(g)
 CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1写出以甲醇为原料制取氢气的热化学方程式
(2)理论上,能提高H2平衡产率的措施有
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。

①钛电极的电极反应式是
②电解过程中,阴极区溶液pH
您最近半年使用:0次
7 . 工业合成氨在人类历史上具有非常重要的意义。回答下列问题:
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
进行反应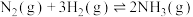 ,当生成2mol
,当生成2mol  时,将
时,将___________ (填“吸收”或“放出”)___________ kJ的热量。
(2)Bosch在研究合成氨工业的催化剂和装置时,发现氢气渗透到钢铁内部生成了一种能产生温室效应的气体,该气体为___________ (填名称),用铁催化氨合成时会产生FeN,氢气与FeN反应生成氨气,写出氢气与FeN反应的化学方程式___________ 。
(3)20世纪初、以Nernst和Haber为代表的研究小组研究不同反应条件下的合成氨反应、所得数据如下表:
试解释Haber采取的生产条件平衡混合气体中 所占体积分数高的原因
所占体积分数高的原因___________ 。
(4)以氨气和二氧化碳为原料制备尿素的化学方程式为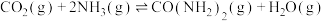 ,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比
,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比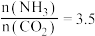 且初始压强为45MPa时,该反应的平衡常数
且初始压强为45MPa时,该反应的平衡常数
___________  。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

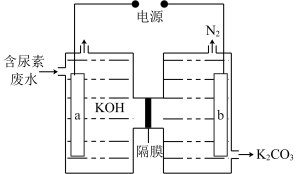
(5)尿素的过度使用会造成水体污染,科学家通过电解的方法处理含尿素的碱性废水、并向煤液化供氢。其装置如图所示,电极b上的电极反应式为___________ 。
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
| 共价键 | H-H | N-H | N≡N |
能量变化/( ) ) | 436.0 | 390.8 | 946.0 |
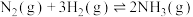 ,当生成2mol
,当生成2mol  时,将
时,将(2)Bosch在研究合成氨工业的催化剂和装置时,发现氢气渗透到钢铁内部生成了一种能产生温室效应的气体,该气体为
(3)20世纪初、以Nernst和Haber为代表的研究小组研究不同反应条件下的合成氨反应、所得数据如下表:
| 研究者 | 压强/atm | 温度/℃ | 催化剂 | 反应结果(平衡混合气体中 所占体积分数) 所占体积分数) |
| Nernst | 50 | 685 | 铂、锰 | 0.96% |
| Haber | 150~250 | 550 | 锇、铀 | 8.25% |
 所占体积分数高的原因
所占体积分数高的原因(4)以氨气和二氧化碳为原料制备尿素的化学方程式为
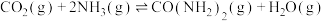 ,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比
,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比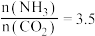 且初始压强为45MPa时,该反应的平衡常数
且初始压强为45MPa时,该反应的平衡常数
 。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)尿素的过度使用会造成水体污染,科学家通过电解的方法处理含尿素的碱性废水、并向煤液化供氢。其装置如图所示,电极b上的电极反应式为

您最近半年使用:0次
名校
解题方法
8 . 随着我国“碳达峰”、“碳中和”目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以 和
和 为原料合成尿素:
为原料合成尿素:
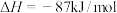 。
。
(1)有利于提高 平衡转化率的措施是_______(填标号)。
平衡转化率的措施是_______(填标号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如图甲所示。
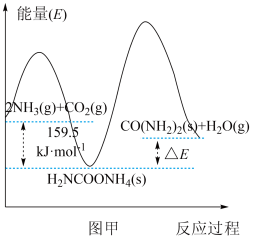
第一步: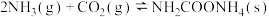

第二步: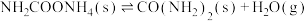

反应速率较快的是反应_______ (填“第一步”或“第二步”)。
Ⅱ.以和催化重整制备合成气: 。
。
(3)在密闭容器中通入物质的量均为0.2mol的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应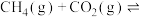
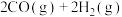 ,
, 的平衡转化率随温度、压强的变化关系如图乙所示:
的平衡转化率随温度、压强的变化关系如图乙所示:
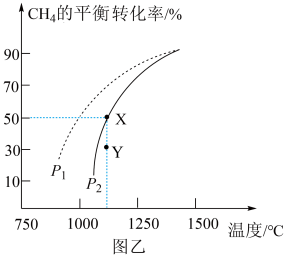
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填标号)。
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率: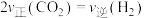 D.同时断裂2mol C—H和1mol H—H
D.同时断裂2mol C—H和1mol H—H
②由图乙可知,压强
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
_______ (用含 的代数式表示)。
的代数式表示)。
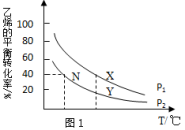
Ⅲ.电化学法还原二氧化碳制乙烯。
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应为_______ ;该装置中使用的是_______ (填“阳”或“阴”)离子交换膜。
Ⅰ.以
 和
和 为原料合成尿素:
为原料合成尿素:
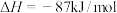 。
。(1)有利于提高
 平衡转化率的措施是_______(填标号)。
平衡转化率的措施是_______(填标号)。| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |

第一步:
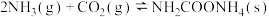

第二步:
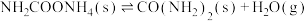

反应速率较快的是反应
Ⅱ.以和催化重整制备合成气:
 。
。(3)在密闭容器中通入物质的量均为0.2mol的
 和
和 ,在一定条件下发生反应
,在一定条件下发生反应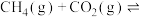
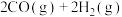 ,
, 的平衡转化率随温度、压强的变化关系如图乙所示:
的平衡转化率随温度、压强的变化关系如图乙所示:
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率:
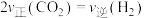 D.同时断裂2mol C—H和1mol H—H
D.同时断裂2mol C—H和1mol H—H②由图乙可知,压强

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,则X点对应温度下的
,则X点对应温度下的
 的代数式表示)。
的代数式表示)。Ⅲ.电化学法还原二氧化碳制乙烯。
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应为
您最近半年使用:0次
2023-02-06更新
|
340次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高三下学期月考卷(六)化学试题
9 . 甲醇、乙醇都可用作涂料、染料的化工原料,也可用作燃料。
I.工业上,在一定条件下可用乙烯气相水化法制备乙醇。其反应为:CH2=CH2(g)+H2O(g)=H3CH2OH(g) △H。
已知:①CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
②CH3CH2OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H2=-1289kJ·mol-1
(1)CH2=CH2(g)+H2O(g)=CH3CH2OH(g)反应的的活化能Ea(正)为102kJ·mol-1,则该反应的活化能Ea(逆)为_______ kJ∙mol-1。
(2)在密闭容器中充入CH2=CH2(g)、H2O(g)(两者物质的量之比为1:1)并加入催化剂发生反应,乙烯的平衡转化率与温度、压强的关系如图1所示。p1_______ p2(填“>”或“<”,下同),X、Y两点的速率v(X)_______ v(Y),试用碰撞理论解释:_______ 。
II.在一定条件下可用CO与H2合成甲醇。
(3)已知反应CO(g)+2H2(g)⇌CH3OH(g),一定温度下,向2L密闭容器中通2molCO和2molH2测得平衡时甲醇物质的量随时间关系变化如表所示。
①10~20min内,用CO表示的平均反应速率是_______ 。
②若起始压强为p0 Pa,则平衡时的平衡常数Kp=_______ (用含p0的代数式表示)。[用平衡分压p总代替平衡浓度计算。已知:气体分压(p分)=气体总压(p总)×物质的量分数]
(4)以稀硫酸为电解质,由甲醇、O2构成的原电池(图2)作电解饱和食盐水(图3)的电源。
①图3装置中溶液中阳离子由_______ (填"左向右"或"右向左")移动。
②a电极的电极反应式为:_______ 。
I.工业上,在一定条件下可用乙烯气相水化法制备乙醇。其反应为:CH2=CH2(g)+H2O(g)=H3CH2OH(g) △H。
已知:①CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
②CH3CH2OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H2=-1289kJ·mol-1
(1)CH2=CH2(g)+H2O(g)=CH3CH2OH(g)反应的的活化能Ea(正)为102kJ·mol-1,则该反应的活化能Ea(逆)为
(2)在密闭容器中充入CH2=CH2(g)、H2O(g)(两者物质的量之比为1:1)并加入催化剂发生反应,乙烯的平衡转化率与温度、压强的关系如图1所示。p1

II.在一定条件下可用CO与H2合成甲醇。
(3)已知反应CO(g)+2H2(g)⇌CH3OH(g),一定温度下,向2L密闭容器中通2molCO和2molH2测得平衡时甲醇物质的量随时间关系变化如表所示。
时间/min | 10 | 20 | 30 | 40 | |
CH3OH的物质的量/mol | 0.4 | 0.7 | 0.8 | 0.8 |
①10~20min内,用CO表示的平均反应速率是
②若起始压强为p0 Pa,则平衡时的平衡常数Kp=
(4)以稀硫酸为电解质,由甲醇、O2构成的原电池(图2)作电解饱和食盐水(图3)的电源。

①图3装置中溶液中阳离子由
②a电极的电极反应式为:
您最近半年使用:0次
名校
解题方法
10 . NH3经如图所示一系列反应可以得到HNO3。
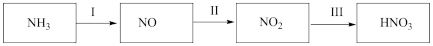
(1)步骤I中,NH3和O2在催化剂作用下反应,其化学方程式是___________ 。
(2)步骤II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:___________ 。
②随温度升高,该反应平衡常数变化的趋势是___________ 。
(3)步骤III中,先降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g) △H1
N2O4(g) △H1
2NO2(g) N2O4(l) △H2
N2O4(l) △H2
下列能量变化示意图中,正确的是___________ (填字母)。
A.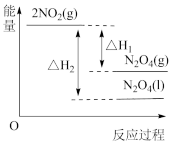 B.
B. 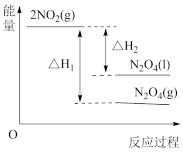 C.
C. 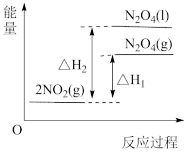
②N2O4与O2、H2O化合的化学方程式是___________ 。
(4)一种利用垃圾渗滤液中NH3、NH 发电的原理如图所示。
发电的原理如图所示。

①X为该装置的___________ 极。
②该装置工作时, Y电极周围溶液的pH___________ (填“ 升高”或“降低”。)
③写出该装置工作时的电池反应式:___________ 。

(1)步骤I中,NH3和O2在催化剂作用下反应,其化学方程式是
(2)步骤II中,2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。
①比较p1、p2的大小关系:
②随温度升高,该反应平衡常数变化的趋势是
(3)步骤III中,先降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)
 N2O4(g) △H1
N2O4(g) △H12NO2(g)
 N2O4(l) △H2
N2O4(l) △H2下列能量变化示意图中,正确的是
A.
 B.
B.  C.
C. 
②N2O4与O2、H2O化合的化学方程式是
(4)一种利用垃圾渗滤液中NH3、NH
 发电的原理如图所示。
发电的原理如图所示。
①X为该装置的
②该装置工作时, Y电极周围溶液的pH
③写出该装置工作时的电池反应式:
您最近半年使用:0次



