NH3经如图所示一系列反应可以得到HNO3。
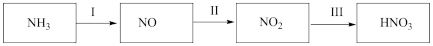
(1)步骤I中,NH3和O2在催化剂作用下反应,其化学方程式是___________ 。
(2)步骤II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:___________ 。
②随温度升高,该反应平衡常数变化的趋势是___________ 。
(3)步骤III中,先降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g) △H1
N2O4(g) △H1
2NO2(g) N2O4(l) △H2
N2O4(l) △H2
下列能量变化示意图中,正确的是___________ (填字母)。
A.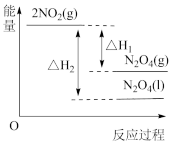 B.
B. 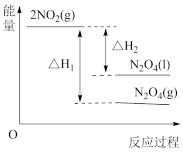 C.
C. 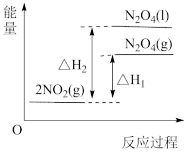
②N2O4与O2、H2O化合的化学方程式是___________ 。
(4)一种利用垃圾渗滤液中NH3、NH 发电的原理如图所示。
发电的原理如图所示。

①X为该装置的___________ 极。
②该装置工作时, Y电极周围溶液的pH___________ (填“ 升高”或“降低”。)
③写出该装置工作时的电池反应式:___________ 。

(1)步骤I中,NH3和O2在催化剂作用下反应,其化学方程式是
(2)步骤II中,2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强( p1、p2)下随温度变化的曲线(如图)。
①比较p1、p2的大小关系:
②随温度升高,该反应平衡常数变化的趋势是
(3)步骤III中,先降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)
 N2O4(g) △H1
N2O4(g) △H12NO2(g)
 N2O4(l) △H2
N2O4(l) △H2下列能量变化示意图中,正确的是
A.
 B.
B.  C.
C. 
②N2O4与O2、H2O化合的化学方程式是
(4)一种利用垃圾渗滤液中NH3、NH
 发电的原理如图所示。
发电的原理如图所示。
①X为该装置的
②该装置工作时, Y电极周围溶液的pH
③写出该装置工作时的电池反应式:
更新时间:2022-01-10 21:19:01
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=+169.8 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______ 。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48 LCH4还原NO2至N2整个过程中转移的电子总数为_______ (阿伏加德罗常数的值用NA表示),放出的热量为_______
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。

已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1。请回答下列问题:
①图中△H=_______ kJ·mol-1。
②将2 mol SO2和1 mol O2充入体积不变的密闭容器中,在一定条件下达平衡时,SO3为0.8 mol,如果此时移走1 mol SO2和0.5 mol O2,在相同温度下再达平衡时SO3的物质的量_______ (填选项)。
A.0.4 mol B.0.8 mol C.小于 0.4 mol D.大于0.4mol , 小于0.8 mol
(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=+169.8 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48 LCH4还原NO2至N2整个过程中转移的电子总数为
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。

已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1。请回答下列问题:
①图中△H=
②将2 mol SO2和1 mol O2充入体积不变的密闭容器中,在一定条件下达平衡时,SO3为0.8 mol,如果此时移走1 mol SO2和0.5 mol O2,在相同温度下再达平衡时SO3的物质的量
A.0.4 mol B.0.8 mol C.小于 0.4 mol D.大于0.4mol , 小于0.8 mol
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】(1)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,则该电池在充电时,阳极的电极反应式_________________ 放电时负极反应的物质是__________________ 。
(2)如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是__________
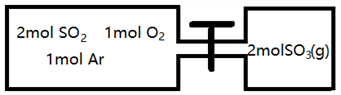
A.第一次平衡时,SO2的物质的量右室更多
B.第一次平衡时,左室内压强一定小于石室
C.第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数大
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,则溶液中c(CrO42-)=__________
(4)室温下,0.1mol/LNaHCO3溶液的pH值__________ 0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
室温下,在0.5mol/LNa2SO3溶液中加入少量水,由水电离出的c(H+) ×c(OH-)__________ 。(填“变大”、“变小”、“不变”)
(2)如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是

A.第一次平衡时,SO2的物质的量右室更多
B.第一次平衡时,左室内压强一定小于石室
C.第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数大
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,则溶液中c(CrO42-)=
(4)室温下,0.1mol/LNaHCO3溶液的pH值
| H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
室温下,在0.5mol/LNa2SO3溶液中加入少量水,由水电离出的c(H+) ×c(OH-)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)⇌Si(s)+2CO(g)
②Si(s)+2Cl2(g)⇌SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______ 种自旋方向;SiO2晶体中每个硅原子与______ 个氧原子直接相连.
(2)单质的还原性:碳______ 硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______ .
(3)反应②生成的化合物分子空间构型为;该分子为______ 分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______ b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______ (用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)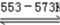 SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g) Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______ 、______ .
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)⇌Si(s)+2CO(g)
②Si(s)+2Cl2(g)⇌SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有
(2)单质的还原性:碳
(3)反应②生成的化合物分子空间构型为;该分子为
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a
(5)在t秒内,反应②中反应速率v(SiCl4)=
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)
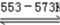 SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)⑤SiHCl3(g)+H2(g)
 Si(纯)+3HCl(g)
Si(纯)+3HCl(g)提高反应⑤中Si(纯)的产率,可采取的措施有:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在化学工业上,Na2SO3 、Na2S2O4(连二亚硫酸钠)是一种重要的还原剂,I2O5是一种重要的氧化剂。
(1)已知:2Na2SO3 (aq)+O2(aq)═2Na2SO4(aq)∆H=m kJ•mol-1,O2(g)⇌O2(aq)∆H=n kJ•mol-1,则Na2SO3溶液与O2(g)反应的热化学方程式为:_________ .
(2) Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区的速率方程式为v=k•ca(SO )•cb(O2),k为常数。当溶解氧浓度为4.0mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO
)•cb(O2),k为常数。当溶解氧浓度为4.0mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO )与速率数值关系如表所示,则a=
)与速率数值关系如表所示,则a=_________ .
(3)利用 I2O5 可消除 CO 污染,其反应为 I2O5(s)+5CO(g)  5CO2(g)+I2(s),不同温度下,向装有足量 I2O5 固体的 2 L 恒容密闭容器中通入 2 mol CO,测得 CO2 气体的体积分数φ(CO2)随时间 t 的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量 I2O5 固体的 2 L 恒容密闭容器中通入 2 mol CO,测得 CO2 气体的体积分数φ(CO2)随时间 t 的变化曲线如图所示。

①从反应开始至 a 点时的平均反应速率 v(CO)=___________ 。
②b 点时,CO 的转化率为___________ 。
③b 点和d点的化学平衡常数:Kb___________ (填“>”“<”或“=”)Kd,判断的理由是:___________ 。
(4)以连二亚硫酸根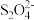 为媒介,使用间接电化学法也可处理燃煤烟气中的 NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的 NO,装置如图所示:

①阴极区的电极反应式为___________ 。
②图中交换膜是___________ (填写“阳离子”“阴离子”)交换膜,作用是:___________ 。
③NO 吸收转化后的主要产物为 若通电时电路中转移了 0.3 mol e- ,则此通电过程中理论上吸收的 NO 在标准状况下的体积为
若通电时电路中转移了 0.3 mol e- ,则此通电过程中理论上吸收的 NO 在标准状况下的体积为___________ mL。
(1)已知:2Na2SO3 (aq)+O2(aq)═2Na2SO4(aq)∆H=m kJ•mol-1,O2(g)⇌O2(aq)∆H=n kJ•mol-1,则Na2SO3溶液与O2(g)反应的热化学方程式为:
(2) Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区的速率方程式为v=k•ca(SO
 )•cb(O2),k为常数。当溶解氧浓度为4.0mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO
)•cb(O2),k为常数。当溶解氧浓度为4.0mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO )与速率数值关系如表所示,则a=
)与速率数值关系如表所示,则a=c(SO )/(×103) )/(×103) | 3.65 | 5.65 | 7.65 | 11.65 |
| v/(×106) | 10.2 | 24.4 | 44.7 | 103.6 |
 5CO2(g)+I2(s),不同温度下,向装有足量 I2O5 固体的 2 L 恒容密闭容器中通入 2 mol CO,测得 CO2 气体的体积分数φ(CO2)随时间 t 的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量 I2O5 固体的 2 L 恒容密闭容器中通入 2 mol CO,测得 CO2 气体的体积分数φ(CO2)随时间 t 的变化曲线如图所示。
①从反应开始至 a 点时的平均反应速率 v(CO)=
②b 点时,CO 的转化率为
③b 点和d点的化学平衡常数:Kb
(4)以连二亚硫酸根
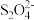 为媒介,使用间接电化学法也可处理燃煤烟气中的 NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的 NO,装置如图所示:
①阴极区的电极反应式为
②图中交换膜是
③NO 吸收转化后的主要产物为
 若通电时电路中转移了 0.3 mol e- ,则此通电过程中理论上吸收的 NO 在标准状况下的体积为
若通电时电路中转移了 0.3 mol e- ,则此通电过程中理论上吸收的 NO 在标准状况下的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1
2NH3(g) △H=-92.4kJ•mol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________ (填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________ 。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g) CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4的转化率为80%。则200℃时该反应的平衡常数K=
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4的转化率为80%。则200℃时该反应的平衡常数K=______________ (保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________ 。
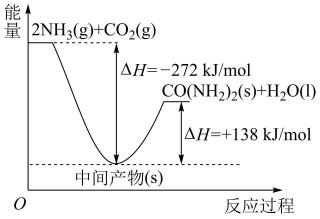
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________ 。
 2NH3(g) △H=-92.4kJ•mol-1
2NH3(g) △H=-92.4kJ•mol-1(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)
 CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4的转化率为80%。则200℃时该反应的平衡常数K=
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4的转化率为80%。则200℃时该反应的平衡常数K=(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)


(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】一定温度下,在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____ 。
(2)该反应为_____ 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将_____ (填“增大”、“减小”或“不变”,下同),CO2的转化率将____ 。
(3)若600℃时,向容器中充入1molCO、1molH2O,10min后反应达到平衡,从开始到达到平衡时H2的化学反应速率为____ ,CO的转化率是_____ 。
(4)在830℃时,容器中发生此反应,某时刻测得n(CO2)=3mol、n(H2)=2mol、n(CO)=4mol、n(H2O)=4mol,则此时v正____ v逆(填“大于”、“小于”或“等于”)。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 600 | 800 | 830 | 1000 | 1200 |
| K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)若600℃时,向容器中充入1molCO、1molH2O,10min后反应达到平衡,从开始到达到平衡时H2的化学反应速率为
(4)在830℃时,容器中发生此反应,某时刻测得n(CO2)=3mol、n(H2)=2mol、n(CO)=4mol、n(H2O)=4mol,则此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】能源是现代文明的原动力,通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。2SO2(g)+O2(g) 2SO3(g) ΔH=akJ·mol-1,反应过程的能量变化如图所示,已知1molSO2(g)完全转化为lmolSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ·mol-1,反应过程的能量变化如图所示,已知1molSO2(g)完全转化为lmolSO3(g)放热99kJ。请回答:

(1)a=_______ kJ·mol-1。
(2)Ea的大小对该反应的ΔH_______ (填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_______ (填“升高”、“降低”或“不变”)。
(3)由盖斯定律结合下述反应方程式,回答问题:
已知:①C(s)+O2(g)=CO2(g) ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)
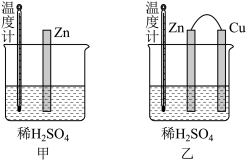
(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是_______(填字母)。
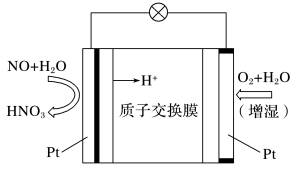
(5)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式:_______ ,若过程中产生2 mol HNO3,则消耗标准状况下O2的体积为_______ L。
(6)向某体积固定的密闭容器中加入0.3 A、0.1
A、0.1 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
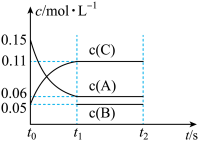
①若t1=15,则t0-t1内反应速率v(C)=_______ ;
②写出反应的化学方程式:_______ 。
(7)已知NO2(g)与SO2(g)发生可逆反应:NO2(g)+SO2(g) SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是
SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是_______ 。
a.只要经过足够长的时间,可使c(SO2)=0
b.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
c.达到平衡状态时,各物质的物质的量浓度相等
d.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
 2SO3(g) ΔH=akJ·mol-1,反应过程的能量变化如图所示,已知1molSO2(g)完全转化为lmolSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ·mol-1,反应过程的能量变化如图所示,已知1molSO2(g)完全转化为lmolSO3(g)放热99kJ。请回答:
(1)a=
(2)Ea的大小对该反应的ΔH
(3)由盖斯定律结合下述反应方程式,回答问题:
已知:①C(s)+O2(g)=CO2(g) ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是_______(填字母)。

| A.图甲和图乙的气泡均产生于锌棒表面 |
| B.图乙中产生气体的速率比图甲快 |
| C.图甲中温度计的示数高于图乙的示数 |
| D.图甲和图乙中温度计的示数相等,且均高于室温 |

(6)向某体积固定的密闭容器中加入0.3
 A、0.1
A、0.1 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若t1=15,则t0-t1内反应速率v(C)=
②写出反应的化学方程式:
(7)已知NO2(g)与SO2(g)发生可逆反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是
SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是a.只要经过足够长的时间,可使c(SO2)=0
b.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
c.达到平衡状态时,各物质的物质的量浓度相等
d.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】我国科学家开发的光催化剂硒化锌(ZnSe,不溶于水),可实现人工光合作用,利用CO2制备高附加值的产品,某小组设计一种以锌矿(主要成分是 ,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
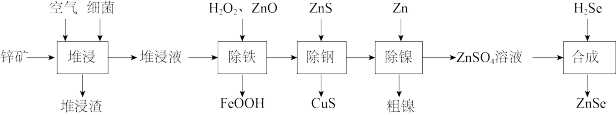
已知:①“堆浸液”中含ZnSO4、FeSO4、CuSO4、NiSO4。
②常温下,Ksp(CuS)≈1×10-36,Ksp(ZnS)≈1×10-25
③pH过高时,FeOOH沉淀会转化成胶体。
④Zn(OH)2是两性氢氧化物。
回答下列问题:
(1)下列有关“堆浸”的说法正确的是____ (填标号); “堆浸”过程中ZnS转化成ZnSO4的化学方程式为____ 。
A.将锌矿粉碎过筛,有利于加快“堆浸”的速率
B.“堆浸”时温度越高越好,温度高有利于加快“堆浸”的速率
C.“堆浸”时加入大量的硫酸
(2)“除铁”最佳pH为3.0,如果pH过高,会导致溶液中Zn2+的含量降低,其主要原因:
①部分Zn2+转化成Zn(OH)2,②____ 。
(3)分析“除铜”时加入ZnS的原因:_____ 。
(4)若以“除镍”时发生的化学反应为原理设计原电池,则该原电池中在负极放电的物质是____ (填物质名称),正极上的电极反应式为_____ 。
(5)“合成”ZnSe后,从反应体系中分离出ZnSe的操作依次为____ 、洗涤、干燥。
(6)传统方法通常用“灼烧”法将锌矿转化成金属氧化物,再进行酸浸等步骤来制备ZnSe,新工艺采用细菌“堆浸”,与传统的“灼烧”法对比,从环保角度分析采用细菌“堆浸”的优点是____ 。
 ,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
已知:①“堆浸液”中含ZnSO4、FeSO4、CuSO4、NiSO4。
②常温下,Ksp(CuS)≈1×10-36,Ksp(ZnS)≈1×10-25
③pH过高时,FeOOH沉淀会转化成胶体。
④Zn(OH)2是两性氢氧化物。
回答下列问题:
(1)下列有关“堆浸”的说法正确的是
A.将锌矿粉碎过筛,有利于加快“堆浸”的速率
B.“堆浸”时温度越高越好,温度高有利于加快“堆浸”的速率
C.“堆浸”时加入大量的硫酸
(2)“除铁”最佳pH为3.0,如果pH过高,会导致溶液中Zn2+的含量降低,其主要原因:
①部分Zn2+转化成Zn(OH)2,②
(3)分析“除铜”时加入ZnS的原因:
(4)若以“除镍”时发生的化学反应为原理设计原电池,则该原电池中在负极放电的物质是
(5)“合成”ZnSe后,从反应体系中分离出ZnSe的操作依次为
(6)传统方法通常用“灼烧”法将锌矿转化成金属氧化物,再进行酸浸等步骤来制备ZnSe,新工艺采用细菌“堆浸”,与传统的“灼烧”法对比,从环保角度分析采用细菌“堆浸”的优点是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。
②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式_____ 。
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃可能是_____ (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
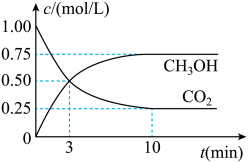
从反应开始到平衡,氢气的反应速率v(H2)=_____ ;氢气的转化率=_____ ;能使平衡体系中n(CH3OH)增大的措施有_____ 。(任写两种即可)
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是_____ 。
(4)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式_____ 。当电子转移的物质的量为_____ 时,参加反应的氧气的体积是6.72L(标准状况下)。
(5)某同学用沉淀法 测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
吸收CO2最合适的试剂是_____ [填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定_____ 。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。
②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃可能是
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,氢气的反应速率v(H2)=
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是
(4)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式
(5)某同学用
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
您最近一年使用:0次



