(1)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,则该电池在充电时,阳极的电极反应式_________________ 放电时负极反应的物质是__________________ 。
(2)如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是__________
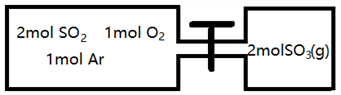
A.第一次平衡时,SO2的物质的量右室更多
B.第一次平衡时,左室内压强一定小于石室
C.第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数大
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,则溶液中c(CrO42-)=__________
(4)室温下,0.1mol/LNaHCO3溶液的pH值__________ 0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
室温下,在0.5mol/LNa2SO3溶液中加入少量水,由水电离出的c(H+) ×c(OH-)__________ 。(填“变大”、“变小”、“不变”)
(2)如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是

A.第一次平衡时,SO2的物质的量右室更多
B.第一次平衡时,左室内压强一定小于石室
C.第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数大
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,则溶液中c(CrO42-)=
(4)室温下,0.1mol/LNaHCO3溶液的pH值
| H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
室温下,在0.5mol/LNa2SO3溶液中加入少量水,由水电离出的c(H+) ×c(OH-)
更新时间:2018-04-25 15:41:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应2HI(g)  H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。

(1)0~2 min内的平均反应速率v(HI)=______________________ 。 该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K=
2HI(g)的平衡常数K=________ 。
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________ 原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________ 移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_______ ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是___________

A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
 H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。
(1)0~2 min内的平均反应速率v(HI)=
 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是

A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氢能是清洁能源,广泛利用氢能是实现双碳目标的重要手段。利用甲酸(HCOOH)分解制备氢气成为能源研究重点。
(1)已知:2HCOOH(g)+O2(g)=2H2O(1)+2CO2(g) ΔH1=-706kJ·mol-1
2H2(g)+O2(g)=2H2O(1) ΔH2=-486kJ·mol-1
甲酸分解制氢的反应HCOOH(g)=H2(g)+CO2(g) ΔH=_______ kJ·mol-1;有利于提高该分解反应平衡转化率的方法有_______ 、_______ ;用各物质的平衡分压表示甲酸分解制氢反应的平衡常数,表达式Kp=_______ (气体B的平衡分压用p(B)表示)。
(2)一定条件下,用PD/AC催化100mL0.1mol·L-1的甲酸水溶液制氢,一定温度下甲酸分解率与反应时间的关系、相同时间内甲酸分解率与反应温度的关系如图所示。
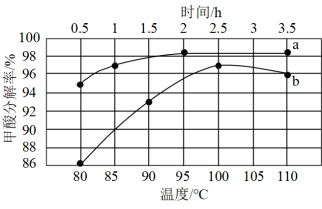
①图中表示相同时间内甲酸分解率随温度变化的曲线是_______ (填“a”或“b”),判断的理由是_______ 。
②当反应时间为0.5h时,甲酸转化率为95.7%,则0~0.5h内,甲酸分解的平均速率v=_______ mol·L-1·h-1(保留2位有效数字)。
(3)在Pd—Co@Pd核壳催化剂催化下,甲酸分解制氢的一种反应进程和相对能量的变化情况如图所示。该进程中,正反应最大能垒(活化能)为_______ eV,反应速率最慢的步骤为_______ (填标号)。
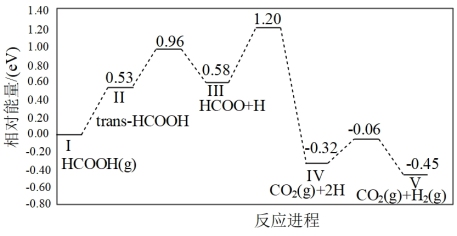
a.I→II b.II→III c.III→IV d.IV→V
(1)已知:2HCOOH(g)+O2(g)=2H2O(1)+2CO2(g) ΔH1=-706kJ·mol-1
2H2(g)+O2(g)=2H2O(1) ΔH2=-486kJ·mol-1
甲酸分解制氢的反应HCOOH(g)=H2(g)+CO2(g) ΔH=
(2)一定条件下,用PD/AC催化100mL0.1mol·L-1的甲酸水溶液制氢,一定温度下甲酸分解率与反应时间的关系、相同时间内甲酸分解率与反应温度的关系如图所示。

①图中表示相同时间内甲酸分解率随温度变化的曲线是
②当反应时间为0.5h时,甲酸转化率为95.7%,则0~0.5h内,甲酸分解的平均速率v=
(3)在Pd—Co@Pd核壳催化剂催化下,甲酸分解制氢的一种反应进程和相对能量的变化情况如图所示。该进程中,正反应最大能垒(活化能)为

a.I→II b.II→III c.III→IV d.IV→V
您最近一年使用:0次
【推荐3】甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g)ΔH1=+92.09kJ·mol-1
氧化法:CH3OH(g)+ O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64kJ·mol-1,则ΔH2=_______ 。
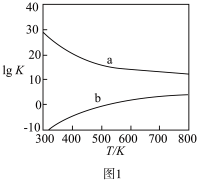
(2)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线_______ (填“a”或“b”)对应脱氢法,判断依据为_______ 。
II.甲醛的用途
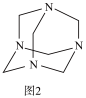
(3)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______ 。
(4)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为_______ 。
III.甲醛的检测
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_______ 。当电路中转移4×10-4mol电子时,传感器内参加反应的HCHO为_______ mg。

I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g)ΔH1=+92.09kJ·mol-1
氧化法:CH3OH(g)+
 O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64kJ·mol-1,则ΔH2=
(2)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线

II.甲醛的用途
(3)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

(4)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为
III.甲醛的检测
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为

您最近一年使用:0次
【推荐1】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40-50% CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH已知部分反应的热化学方程式如下:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2 =b kJ·mol-1
O2(g)=H2O(g) ΔH2 =b kJ·mol-1
H2O(g) = H2O(l) ΔH3=c kJ·mol-1
则CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=_______
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)⇌2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。

回答下列问题:
①压强P1、P2、P3的大小关系是_______ ;Ka、K b、Kc为a、b、c三点对应的平衡常数,则其大小关系是_______ 。
②900℃、1.0MPa时,足量碳与amol CO2反应达平衡后,CO2的转化率为_______ (保留三位有效数字 ),该反应的平衡常数Kp=
),该反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)⇌CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是_______ 。
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为_______ ;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_______ mol硫酸。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH已知部分反应的热化学方程式如下:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1H2(g)+
 O2(g)=H2O(g) ΔH2 =b kJ·mol-1
O2(g)=H2O(g) ΔH2 =b kJ·mol-1H2O(g) = H2O(l) ΔH3=c kJ·mol-1
则CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)⇌2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。

回答下列问题:
①压强P1、P2、P3的大小关系是
②900℃、1.0MPa时,足量碳与amol CO2反应达平衡后,CO2的转化率为
 ),该反应的平衡常数Kp=
),该反应的平衡常数Kp=③以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)⇌CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g)+ xB(g) ⇌C(g),4min时反应达到平衡状态(温度不变),剩余0.4mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)x_________ 。
(2)用A表示该反应的速率为_________ mol/(L·min)。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是_________ (填写选项字母符号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为_________ 反应(填“吸热”或“放热“),且m+n_________ p(填“>” “=”或“<”)。
②减压使容器体积增大时,A的质量分数_________ 。(填“增大少”“减小”或“不变”,下同)
③若加入B(维持体积不变),则A的转化率_________ 。
④若升高温度,则平衡时B、C的浓度之比将_________ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量_________ 。
(1)x
(2)用A表示该反应的速率为
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为
②减压使容器体积增大时,A的质量分数
③若加入B(维持体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比将
⑤若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是________ 。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:________ 。
②CH4不完全燃烧也可制得合成气:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为______ (填序号);原因是____________ 。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g) CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为________ ;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=_____ mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向_______ 反应方向移动(填“正”或“逆”);
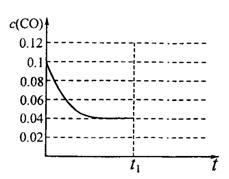
在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线_____ 。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。
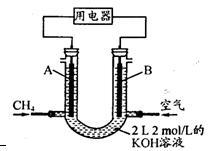
持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为____ ;
②44.8 L<V≤89.6 L时,负极电极反应为______ ;
③V=67.2 L时,溶液中离子浓度大小关系为______ ;
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:
②CH4不完全燃烧也可制得合成气:CH4(g)+
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g)
 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。I.H2的转化率为
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向

在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。

持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为
②44.8 L<V≤89.6 L时,负极电极反应为
③V=67.2 L时,溶液中离子浓度大小关系为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】饮用水中NO3-达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3-的浓度,某兴趣小组提出如下方案:

请回答下列问题:
(1)该方案中选用熟石灰调节pH,理由是_______ 、__________ 、________ , 在调节pH时,若pH过大或过小都会造成________ 的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________ 。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________ 。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
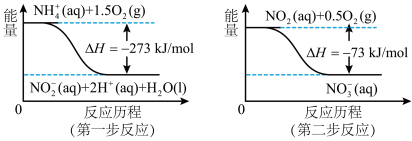
试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________ 。

请回答下列问题:
(1)该方案中选用熟石灰调节pH,理由是
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
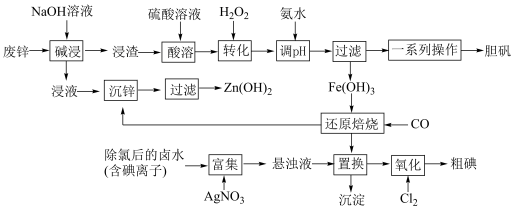
【推荐2】某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: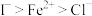
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为____________________ 。
(2)“转化”中,加入足量H2O2的目的是____________________ 。
(3)“调pH”时需控制该溶液的pH范围为______ 之间。“调pH”之后,需要加热煮沸10 min,冷却后再“过滤”。煮沸10 min的作用是____________________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为____________________ 。
(5)“氧化”过程中若反应物用量比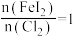 时,氧化产物为
时,氧化产物为______ (填化学式)
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
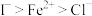
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量H2O2的目的是
(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“氧化”过程中若反应物用量比
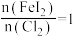 时,氧化产物为
时,氧化产物为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】工业上常用绿柱石(主要成分3BeO•Al2O3•6SiO2,还含有铁元素)冶炼铍,其简化的工艺流程如图所示:
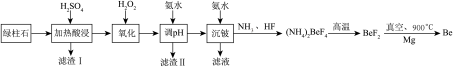
已知:Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表:
回答下列问题:
(1)滤渣Ⅰ的主要成分是______ ,加入H2O2的作用是______ 。
(2)得到滤渣Ⅱ的合理pH范围是______ 。
(3)用化学方程式解释不宜使用NaOH溶液来沉铍的原因是______ 。
(4)得到(NH4)2BeF4的化学方程式为______ 。
(5)由Mg还原BeF2得到Be需要真空的环境,其原因是______ 。
(6)若绿柱石中BeO的含量为a%,1吨绿柱石能生产含铍2%的合金b吨,则Be的利用率为______ 。(用含a、b的表达式表示)

已知:Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表:
| Be2+ | Al3+ | Fe3+ | Fe2+ | |
| 开始沉淀时 | 5.2 | 3.3 | 1.5 | 6.5 |
| 沉淀完全时 | 8.8 | 5.0 | 3.7 | 9.7 |
(1)滤渣Ⅰ的主要成分是
(2)得到滤渣Ⅱ的合理pH范围是
(3)用化学方程式解释不宜使用NaOH溶液来沉铍的原因是
(4)得到(NH4)2BeF4的化学方程式为
(5)由Mg还原BeF2得到Be需要真空的环境,其原因是
(6)若绿柱石中BeO的含量为a%,1吨绿柱石能生产含铍2%的合金b吨,则Be的利用率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】I.工业金属钛冶炼过程中有一步将原料金红石转化,其反应方程式为:TiO2(金红石)+2C+2Cl2=TiCl4+2CO
已知:
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ·mol-1;
(1)CO的燃烧热是___ 。
(2)请写出金红石转化的热化学方程式___ 。
II.如图所示的三套实验装置中,甲、乙两套装置的电池反应均为Zn+Cu2+=Zn2++Cu,盐桥内装有含琼脂的饱和KCl溶液,回答下列有关问题:

(1)甲装置中铜电极上的电极反应式为___ 。
(2)放电时盐桥中的Cl-将会出现在乙装置__ (填“左”或“右”)侧的容器中,X电极的成分不可能是__ (填字母)
a.铜 b.铁 c.石墨 d.铝
(3)用丙装置在铁上镀铜,则电极材料为铁的是__ (填“Y或Z”),负极上的电极反应式为___ 。
(4)当丙池中某电极的质量减少1.6g时,则消耗的O2在标况下的体积是___ 。
已知:
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ·mol-1;
(1)CO的燃烧热是
(2)请写出金红石转化的热化学方程式
II.如图所示的三套实验装置中,甲、乙两套装置的电池反应均为Zn+Cu2+=Zn2++Cu,盐桥内装有含琼脂的饱和KCl溶液,回答下列有关问题:

(1)甲装置中铜电极上的电极反应式为
(2)放电时盐桥中的Cl-将会出现在乙装置
a.铜 b.铁 c.石墨 d.铝
(3)用丙装置在铁上镀铜,则电极材料为铁的是
(4)当丙池中某电极的质量减少1.6g时,则消耗的O2在标况下的体积是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】碳和硫单质及其化合物在工农业生产中有着重要的应用,CO2的过渡排放会导致温室效应,而SO2 直接排放会对环境造成危害。
I.有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
① 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
② C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+113.4kJ/mol
则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=_______ 。
II. SO2的尾气处理通常有以下几种方法:
(l)活性炭还原法
反应原理:恒温恒容时,2C(s)+2SO2(g)===S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
①0~20min反应速率表示为v(SO2)=_________ ;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是________ ;
③4Omin时,平衡常数K=__________ 。
(2)亚硫酸钠吸收法
① Na2SO4溶液吸收SO2的化学方程式为______________ ;
② 常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定不正确的是_____ (填序号)。
a. c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b. c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c. c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-5mol/L
(3)电化学处理法
① 如图所示,Pt(II)电极的反应式为__________ ;
② 当电路中转移0.04mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____ mol离子。
I.有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
① 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
② C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+113.4kJ/mol
则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=
II. SO2的尾气处理通常有以下几种方法:
(l)活性炭还原法
反应原理:恒温恒容时,2C(s)+2SO2(g)===S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
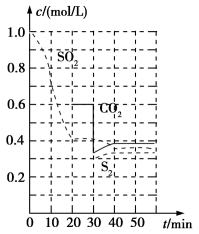
图16
①0~20min反应速率表示为v(SO2)=
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是
③4Omin时,平衡常数K=
(2)亚硫酸钠吸收法
① Na2SO4溶液吸收SO2的化学方程式为
② 常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定不正确的是
a. c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b. c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c. c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-5mol/L
(3)电化学处理法

图17
① 如图所示,Pt(II)电极的反应式为
② 当电路中转移0.04mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】某兴趣小组提出 具有一定氧化性,
具有一定氧化性, 具有一定的还原性,二者可以发生氧化还原反应。于是向盛有
具有一定的还原性,二者可以发生氧化还原反应。于是向盛有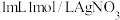 溶液(
溶液(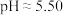 )的试管中加入1mL1mol/LKI溶液,振荡后,试管中出现黄色沉淀,向其中加入淀粉溶液,无明显变化。
)的试管中加入1mL1mol/LKI溶液,振荡后,试管中出现黄色沉淀,向其中加入淀粉溶液,无明显变化。
已知:AgCl为白色沉淀,AgI为黄色沉淀。
(1)成员甲初步认为 与
与 没有发生氧化还原反应,证据是
没有发生氧化还原反应,证据是___________ 。
(2)成员乙否定成员甲,并巧妙的设计原电池装置(如图所示),实验开始后,电流表指针发生偏转且示数为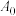 ,右侧溶液转为蓝色。电子的运动方向为
,右侧溶液转为蓝色。电子的运动方向为___________ (填“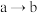 ”或“
”或“ ”)。成员乙认为
”)。成员乙认为 可以氧化
可以氧化 。
。

(3)成员丙对成员乙的实验产生质疑,认为仅凭借电流表偏转无法严谨说明,经过实验,电流计指针发生偏转示数为 ,成员丙经思考后认同成员乙。
,成员丙经思考后认同成员乙。

①完成成员丙的实验设计。
c为___________ ,d为___________ 。
②此时正极的电极反应式为___________ 。
(4)盐桥中阴、阳离子的选择要求有两项。首先是不能与两侧溶液发生化学反应,然后是电迁移率(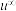 )尽可能相近。根据下表数据,应该选取
)尽可能相近。根据下表数据,应该选取___________ (填写化学式)的饱和溶液作为盐桥填充。
【结论】两个反应存在竞争,非氧还反应速率较快。
 具有一定氧化性,
具有一定氧化性, 具有一定的还原性,二者可以发生氧化还原反应。于是向盛有
具有一定的还原性,二者可以发生氧化还原反应。于是向盛有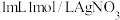 溶液(
溶液(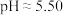 )的试管中加入1mL1mol/LKI溶液,振荡后,试管中出现黄色沉淀,向其中加入淀粉溶液,无明显变化。
)的试管中加入1mL1mol/LKI溶液,振荡后,试管中出现黄色沉淀,向其中加入淀粉溶液,无明显变化。已知:AgCl为白色沉淀,AgI为黄色沉淀。
(1)成员甲初步认为
 与
与 没有发生氧化还原反应,证据是
没有发生氧化还原反应,证据是(2)成员乙否定成员甲,并巧妙的设计原电池装置(如图所示),实验开始后,电流表指针发生偏转且示数为
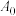 ,右侧溶液转为蓝色。电子的运动方向为
,右侧溶液转为蓝色。电子的运动方向为 ”或“
”或“ ”)。成员乙认为
”)。成员乙认为 可以氧化
可以氧化 。
。
(3)成员丙对成员乙的实验产生质疑,认为仅凭借电流表偏转无法严谨说明,经过实验,电流计指针发生偏转示数为
 ,成员丙经思考后认同成员乙。
,成员丙经思考后认同成员乙。
①完成成员丙的实验设计。
c为
②此时正极的电极反应式为
(4)盐桥中阴、阳离子的选择要求有两项。首先是不能与两侧溶液发生化学反应,然后是电迁移率(
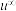 )尽可能相近。根据下表数据,应该选取
)尽可能相近。根据下表数据,应该选取| 阳离子 | 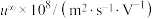 | 阴离子 | 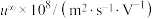 |
 | 4.07 |  | 4.61 |
 | 5.19 |  | 7.40 |
 | 6.59 |  | 7.91 |
 | 7.62 |  | 8.27 |
您最近一年使用:0次







