名校
1 . 2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼( )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。
(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成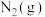 、
、 和
和 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式___________ 。
(2)对 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。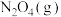 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是___________ 。
B.b点的操作是压缩注射器
C.c点与a点相比, 增大,
增大,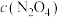 减小
减小
D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数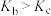
③反应 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: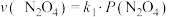 ,
,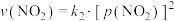 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是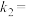
___________ 。(对于气相反应,用某组分B的平衡压强 代替物质的量浓度
代替物质的量浓度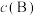 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)
④反应温度 时,
时,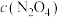 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段, 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
(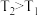 ),再次画出
),再次画出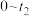 时段,
时段, 随t变化趋势的曲线。
随t变化趋势的曲线。_________
 )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成
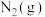 、
、 和
和 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式(2)对
 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。| A.偏二甲肼是比液氢更环保的燃料 | B. 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 |
| C.偏二甲基肼的燃烧热为2250kJ/mol | D.该反应是一个熵增的自发反应 |
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分
 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。①已知 和
和 的结构式分别是
的结构式分别是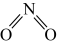 和
和 ,实验测得N-N的键能为167kJ/mol,
,实验测得N-N的键能为167kJ/mol, 中氮氧键(
中氮氧键( )的键能为466kJ/mol,
)的键能为466kJ/mol, 中氮氧键(
中氮氧键( )的键能为438.5kJ/mol;
)的键能为438.5kJ/mol; 转化为
转化为 的
的
 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是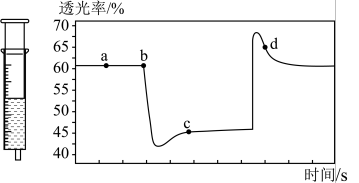

B.b点的操作是压缩注射器
C.c点与a点相比,
 增大,
增大,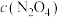 减小
减小D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数
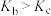
③反应
 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: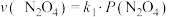 ,
,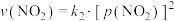 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是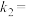
 代替物质的量浓度
代替物质的量浓度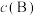 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)④反应温度
 时,
时,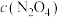 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段, 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
(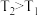 ),再次画出
),再次画出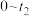 时段,
时段, 随t变化趋势的曲线。
随t变化趋势的曲线。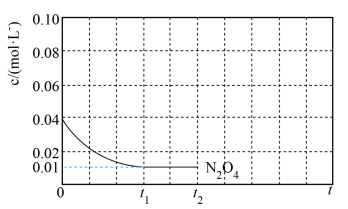
您最近一年使用:0次
名校
2 . 下图所示的实验,能 达到实验目的的是
| A | B | C | D |
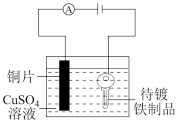 | 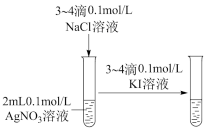 | 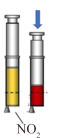  |  |
| 在铁件上镀铜 | 验证AgCl溶解度大于AgI | 推注射器,气体颜色变深,证明平衡逆向移动 | 由 制取无水 制取无水 固体 固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-30更新
|
379次组卷
|
2卷引用:北京市八一学校2022-2023学年高三上学期12月月考化学试题
解题方法
3 . 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)  2SO3(g) △H = -196.0 KJ/mol,测得反应的相关数据如下,下列说法正确的是
2SO3(g) △H = -196.0 KJ/mol,测得反应的相关数据如下,下列说法正确的是
 2SO3(g) △H = -196.0 KJ/mol,测得反应的相关数据如下,下列说法正确的是
2SO3(g) △H = -196.0 KJ/mol,测得反应的相关数据如下,下列说法正确的是| 容器1 | 容器2 | 容器3 | |
| 应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡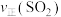 / /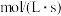 | v1 | v2 | v3 |
平衡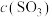 / / | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO3) |
| 平衡常数K | K1 | K2 | K3 |
A. , , | B.K1> K3,p2>2p3 |
C. ,a +b>196.0 ,a +b>196.0 | D. ,α2(SO3 )+α1(SO2 )=1 ,α2(SO3 )+α1(SO2 )=1 |
您最近一年使用:0次
4 . t℃时,将 和
和 气体通入体积为
气体通入体积为 的密闭容器中(容积不变),发生如下反应:
的密闭容器中(容积不变),发生如下反应: 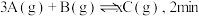 时反应达到平衡状态(温度不变),剩余
时反应达到平衡状态(温度不变),剩余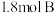 ,并测得C的浓度为
,并测得C的浓度为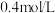 ,请填写下列空白:
,请填写下列空白:
(1)x=_______ 。
(2)比较达到平衡时,A、B两反应物的转化率: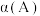
_______ 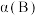 (填>、=或<)
(填>、=或<)
(3)若继续向原平衡混合物的容器中通入少量氨气(氨气和A、B、C都不反应)后,下列说法中正确的是_______(填写字母序号)
(4)若向原平衡混合物的容器中再充入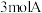 和
和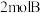 ,在
,在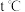 时达到新的平衡,此时B的物质的量为
时达到新的平衡,此时B的物质的量为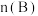
_______ 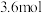 。(填“>”、“<”、或“=”)
。(填“>”、“<”、或“=”)
(5)如果将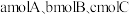 在相同温度和容器中进行反应。欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量
在相同温度和容器中进行反应。欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量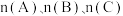 间应该满足的等量关系式:
间应该满足的等量关系式:_______ (a,b及c的关系式)
 和
和 气体通入体积为
气体通入体积为 的密闭容器中(容积不变),发生如下反应:
的密闭容器中(容积不变),发生如下反应: 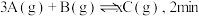 时反应达到平衡状态(温度不变),剩余
时反应达到平衡状态(温度不变),剩余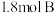 ,并测得C的浓度为
,并测得C的浓度为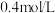 ,请填写下列空白:
,请填写下列空白:(1)x=
(2)比较达到平衡时,A、B两反应物的转化率:
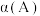
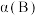 (填>、=或<)
(填>、=或<)(3)若继续向原平衡混合物的容器中通入少量氨气(氨气和A、B、C都不反应)后,下列说法中正确的是_______(填写字母序号)
| A.化学平衡向正反应方向移动 |
| B.化学平衡向逆反应方向移动 |
| C.化学平衡不会发生移动 |
| D.正、逆反应的化学反应速率将发生同等程度的改变 |
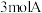 和
和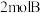 ,在
,在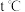 时达到新的平衡,此时B的物质的量为
时达到新的平衡,此时B的物质的量为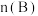
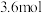 。(填“>”、“<”、或“=”)
。(填“>”、“<”、或“=”)(5)如果将
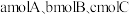 在相同温度和容器中进行反应。欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量
在相同温度和容器中进行反应。欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量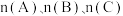 间应该满足的等量关系式:
间应该满足的等量关系式:
您最近一年使用:0次
名校
解题方法
5 . 以CO和CO2为原料合成乙烯、二甲醚(CH3OCH3)等有机物,一直是当前化学领域研究的热点。回答下列问题:
(1)已知相关物质能量变化示意图如下:
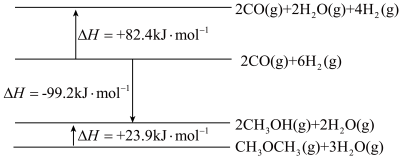
①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:_______ 。
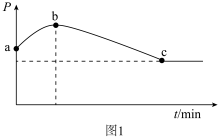
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g) C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是_______ 。
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
Ⅱ.CO2(g) +H2(g) CO(g) + H2O(g)。
CO(g) + H2O(g)。
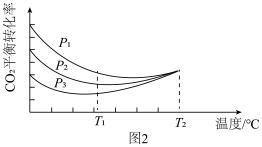
向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为_______ ;T2℃时主要发生反应_______ (填“Ⅰ”或“Ⅱ”),平衡转化率随温度变化先降后升的原因为_______ 。
(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g) CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=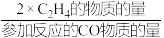 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=_______ MPa3(用含字母p的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),若要提高C2H4的选择性,则应考虑的因素是_______ 。
(1)已知相关物质能量变化示意图如下:

①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g)
 C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g)
 CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);Ⅱ.CO2(g) +H2(g)
 CO(g) + H2O(g)。
CO(g) + H2O(g)。向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为

(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g)
 CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=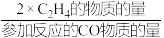 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=
您最近一年使用:0次
2022-07-29更新
|
291次组卷
|
3卷引用:吉林省双辽市一中、大安市一中、通榆县一中等重点高中2021-2022学年高三上学期期末联考理科综合化学试题
名校
解题方法
6 . 工业上利用硫(S8)与 为原料制备
为原料制备 。450℃以上,发生反应Ⅰ:
。450℃以上,发生反应Ⅰ: ;通常在600℃以上发生反应Ⅱ:
;通常在600℃以上发生反应Ⅱ: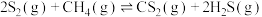 。一定条件下,
。一定条件下, 分解产生
分解产生 的体积分数、
的体积分数、 与
与 反应中
反应中 的平衡转化率与温度的关系如图所示。下列说法一定正确的是
的平衡转化率与温度的关系如图所示。下列说法一定正确的是

 为原料制备
为原料制备 。450℃以上,发生反应Ⅰ:
。450℃以上,发生反应Ⅰ: ;通常在600℃以上发生反应Ⅱ:
;通常在600℃以上发生反应Ⅱ: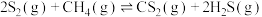 。一定条件下,
。一定条件下, 分解产生
分解产生 的体积分数、
的体积分数、 与
与 反应中
反应中 的平衡转化率与温度的关系如图所示。下列说法一定正确的是
的平衡转化率与温度的关系如图所示。下列说法一定正确的是
| A.反应Ⅱ的正反应为吸热反应 |
B.在恒温密闭容器中,反应相同时间,温度越低, 的转化率越大 的转化率越大 |
C.发生反应Ⅱ温度不低于600℃的原因是:此温度 平衡转化率已很高;低于此温度, 平衡转化率已很高;低于此温度, 浓度小,反应速率慢 浓度小,反应速率慢 |
D.某温度下若 完全分解成 完全分解成 ,在密闭容器中, ,在密闭容器中, 开始反应,当 开始反应,当 体积分数为10%时, 体积分数为10%时, 转化率为43% 转化率为43% |
您最近一年使用:0次
2022-07-03更新
|
637次组卷
|
4卷引用:江苏省木渎苏苑2021-2022学年高三下学期联合适应性检测化学试题
7 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
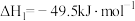
Ⅱ.
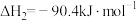
Ⅲ.

回答下列问题:
(1)
_______  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为_______ mol﹒L-1(用含a、b、V的代数式表示)
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
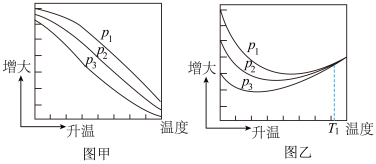
已知:CO2的平衡转化率=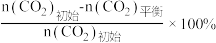
CH3OH的平衡产率=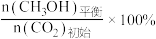
其中纵坐标表示CO2平衡转化率的是图_______ (填“甲”或“乙”);压强P1、P2、P3由大到小的顺序为_______ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
Ⅰ.

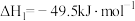
Ⅱ.

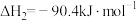
Ⅲ.


回答下列问题:
(1)

 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

已知:CO2的平衡转化率=
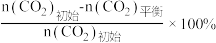
CH3OH的平衡产率=
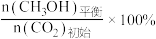
其中纵坐标表示CO2平衡转化率的是图
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
您最近一年使用:0次
名校
8 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象与结论 | |
| A | 验证压强对化学平衡的影响 | 先将注射器充满NO2气体,然后将活塞往里推压缩体积 | 观察到注射器内气体颜色加深,证明加压平衡朝生成NO2气体的方向移动 |
| B | 铜的电解精炼 | 待精炼的铜和纯铜连接外加直流电源的阳极和阴极,用硫酸铜溶液作电解质电解 | 阳极上铜逐渐溶解,阴极上铜逐渐析出,硫酸铜溶液浓度保持不变 |
| C | 制备[Cu(NH3)4]SO4·H2O晶体 | 向4mL 0.1mol/LCuSO4溶液中滴加氨水,先形成难溶物,并继续滴加沉淀溶解,然后蒸发溶剂析出晶体 | 反应过程中,NH3的N给出孤对电子,Cu2+接受电子对,形成了稳定的配位键[Cu(NH3)4]2+ |
| D | 除去锅炉水垢中的CaSO4 | 先用碳酸钠溶液浸泡水垢,然后再用盐酸除去 | 利用Ksp(CaSO4)> Ksp(CaCO3),实现沉淀的转化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-21更新
|
406次组卷
|
4卷引用:浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题
浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题(已下线)3.4 配合物与超分子-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)浙江省富阳区第二中学2021-2022学年高二下学期(3月)检测化学试题 河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题
9 . NO2和N2O2存在平衡:
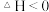 。下列分析错误的是
。下列分析错误的是

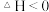 。下列分析错误的是
。下列分析错误的是| A.断裂2molNO2(g)中的共价键需能量小于断裂1molN2O4(g)中的共价键所需能量 |
| B.1mol平衡混合气体中含N原子的物质的量大于1mol |
| C.恒容升温,由于平衡逆向移动导致气体颜色变深 |
| D.恒温时,缩小容积,气体颜色变深是平衡正向移动导致的 |
您最近一年使用:0次
2021-12-19更新
|
329次组卷
|
5卷引用:辽宁省丹东市五校2021-2022学年高三上学期联考化学试题
辽宁省丹东市五校2021-2022学年高三上学期联考化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)
名校
解题方法
10 . 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
 N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。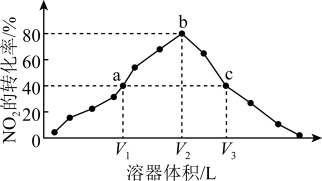
A.T℃时,该反应的化学平衡常数为Kc= mol·L-1 mol·L-1 |
| B.由图可知,c点V正>V逆 |
| C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡小 |
| D.容器内的压强:pa∶pb=6∶7 |
您最近一年使用:0次
2021-09-06更新
|
1449次组卷
|
16卷引用:重庆育才中学2022届高考适应性考试二化学试题
重庆育才中学2022届高考适应性考试二化学试题江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题河北省保定市定州市2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期期中考试化学试题四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题 山西省长治市第二中学2021-2022学年高三上学期第三次练考化学试题安徽省六安市第一中学2022届高三上学期第三次月考化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期期中考试化学试题广东省梅州市蕉岭县蕉岭中学2022-2023学年高三上学期高二第二次质检化学试题(已下线)化学(重庆A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)易错点4化学反应速率、平衡图像分析错误(已下线)题型24 化学反应平衡常数、平衡转化率图像福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题



