名校
解题方法
1 . 甲烷在化学工业中应用广泛。回答下列问题:
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=_______ kJ·mol-1,升高温度,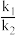
_______ (填“增大”或“减小”)。
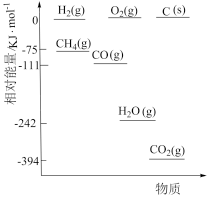
②起始物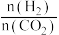 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)_______ vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=_______ Pa,反应I以物质的量分数表示的平衡常数KxI=_______ 。

(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
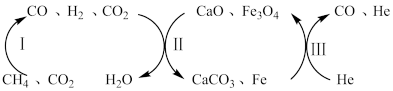
其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将_____ (填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)_______ (填“增大”、“减小”或“不变”),p(CO)_____ (填“增大”、“减小”或“不变”)。
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=
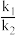

②起始物
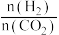 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。

其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将
您最近一年使用:0次
2023-03-19更新
|
949次组卷
|
3卷引用:山东省烟台市、德州市、滨州市2023届高三一模考试化学试题
山东省烟台市、德州市、滨州市2023届高三一模考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(原理综合题)山东省日照实验高级中学2023-2024学年高二上学期第一次阶段考试化学试题
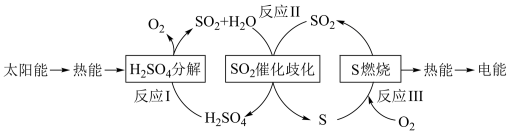
2 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________________________________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______ p 1(填“>”或“<”),得出该结论的理由是________________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+_________ ===_________ +_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
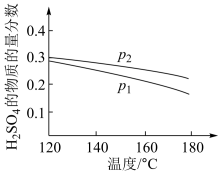
p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
2018-06-09更新
|
6521次组卷
|
28卷引用:2018年全国普通高等学校招生统一考试化学(北京卷)
2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题福建省福州市第三中学2019-2020学年高三10月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷四川省成都市实验中学2019-2020学年高三下学期第三次周测化学试题(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率北京东城区2019-2020学年高二下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题(已下线)化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷北京市第八中学2022-2023学年高二上学期期末考试化学试题广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷北京市第一○一中学2023-2024学年高二上学期统练一化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市铁路第二中学2023-2024学年高二上学期期中考试化学试题10-2023新东方高二上期中考化学
名校
解题方法
3 . 工业上利用硫(S8)与 为原料制备
为原料制备 。450℃以上,发生反应Ⅰ:
。450℃以上,发生反应Ⅰ: ;通常在600℃以上发生反应Ⅱ:
;通常在600℃以上发生反应Ⅱ: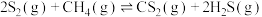 。一定条件下,
。一定条件下, 分解产生
分解产生 的体积分数、
的体积分数、 与
与 反应中
反应中 的平衡转化率与温度的关系如图所示。下列说法一定正确的是
的平衡转化率与温度的关系如图所示。下列说法一定正确的是

 为原料制备
为原料制备 。450℃以上,发生反应Ⅰ:
。450℃以上,发生反应Ⅰ: ;通常在600℃以上发生反应Ⅱ:
;通常在600℃以上发生反应Ⅱ: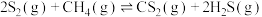 。一定条件下,
。一定条件下, 分解产生
分解产生 的体积分数、
的体积分数、 与
与 反应中
反应中 的平衡转化率与温度的关系如图所示。下列说法一定正确的是
的平衡转化率与温度的关系如图所示。下列说法一定正确的是
| A.反应Ⅱ的正反应为吸热反应 |
B.在恒温密闭容器中,反应相同时间,温度越低, 的转化率越大 的转化率越大 |
C.发生反应Ⅱ温度不低于600℃的原因是:此温度 平衡转化率已很高;低于此温度, 平衡转化率已很高;低于此温度, 浓度小,反应速率慢 浓度小,反应速率慢 |
D.某温度下若 完全分解成 完全分解成 ,在密闭容器中, ,在密闭容器中, 开始反应,当 开始反应,当 体积分数为10%时, 体积分数为10%时, 转化率为43% 转化率为43% |
您最近一年使用:0次
2022-07-03更新
|
626次组卷
|
4卷引用:江苏省木渎苏苑2021-2022学年高三下学期联合适应性检测化学试题
9-10高二下·北京·期末
名校
4 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是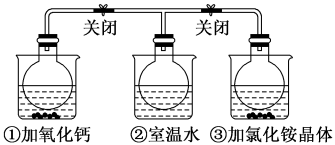
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1133次组卷
|
23卷引用:2010年北京市八一中学高二第二学期期末考试化学试卷
(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
2023高三·全国·专题练习
解题方法
5 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)
_______  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为_______ mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为_______ 。
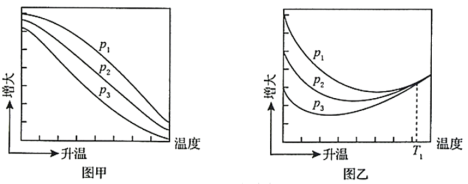
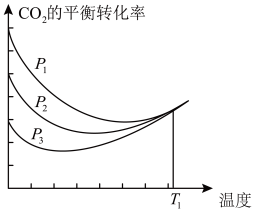
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2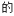 平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=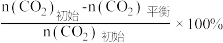
CH3OH的平衡产率=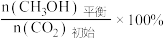
其中纵坐标表示CO2平衡转化率的是图_______ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为_______ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______(填标号)。
Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)

 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2
 平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
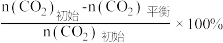
CH3OH的平衡产率=
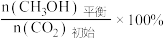
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
您最近一年使用:0次
2023-01-31更新
|
546次组卷
|
4卷引用:专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)
(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)化学反应速率与化学平衡——课时5影响化学平衡的因素广东北江实验学校2023—2024学年高二上学期10月月考化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
名校
解题方法
6 . 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
 N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。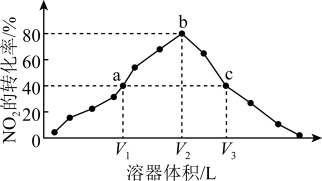
A.T℃时,该反应的化学平衡常数为Kc= mol·L-1 mol·L-1 |
| B.由图可知,c点V正>V逆 |
| C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡小 |
| D.容器内的压强:pa∶pb=6∶7 |
您最近一年使用:0次
2021-09-06更新
|
1443次组卷
|
16卷引用:重庆育才中学2022届高考适应性考试二化学试题
重庆育才中学2022届高考适应性考试二化学试题江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题河北省保定市定州市2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期期中考试化学试题四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题 山西省长治市第二中学2021-2022学年高三上学期第三次练考化学试题安徽省六安市第一中学2022届高三上学期第三次月考化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期期中考试化学试题广东省梅州市蕉岭县蕉岭中学2022-2023学年高三上学期高二第二次质检化学试题(已下线)化学(重庆A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)易错点4化学反应速率、平衡图像分析错误(已下线)题型24 化学反应平衡常数、平衡转化率图像福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 乙醇与水催化反应可以制得氢气。
(1)已知: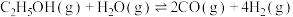
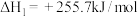 ,回答下列问题:
,回答下列问题:
①升温,平衡_______ 移动(填“向左”、“向右”、“不”);
②与原平衡相比较,增大压强,新平衡时
_______ (填“增大”、“减小”、“不变”,下同);
③恒温、恒容条件下。加入水蒸气,转化率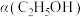
_______ ;
④恒温、恒压条件下,加入稀有气体,体积分数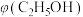
_______ 。
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I: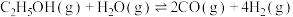
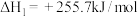
反应II:

反应III:

则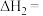
_______  。
。
(3)压强为100kPa, 的平衡产率与温度、起始时
的平衡产率与温度、起始时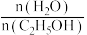 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
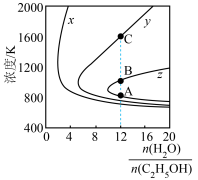
 的平衡产率:B点
的平衡产率:B点_______ C点(填“>”或“<”)。
(4)恒容条件下,将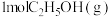 和
和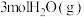 投入密闭容器中发生上述三个反应,平衡时
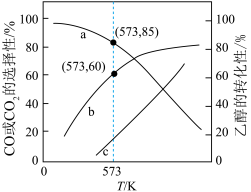
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性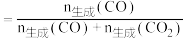 】
】
①表示乙醇转化率的曲线是_______ (填“a”、“b”或“c”)。
②573K时,反应II的压强平衡常数
_______ 。(已知:分压=总压 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
(1)已知:
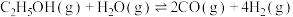
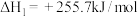 ,回答下列问题:
,回答下列问题:①升温,平衡
②与原平衡相比较,增大压强,新平衡时

③恒温、恒容条件下。加入水蒸气,转化率
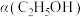
④恒温、恒压条件下,加入稀有气体,体积分数
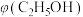
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I:
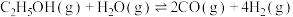
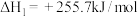
反应II:


反应III:


则
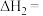
 。
。(3)压强为100kPa,
 的平衡产率与温度、起始时
的平衡产率与温度、起始时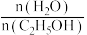 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
 的平衡产率:B点
的平衡产率:B点(4)恒容条件下,将
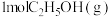 和
和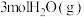 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性
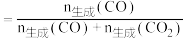 】
】①表示乙醇转化率的曲线是
②573K时,反应II的压强平衡常数

 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
您最近一年使用:0次
2023-11-14更新
|
361次组卷
|
2卷引用:重庆市第十一中学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1234次组卷
|
10卷引用:北京市丰台区2021届高三一模化学试题
北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)河北省武邑中学2021届高考七模化学试题黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷
名校
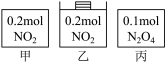
9 . 甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
| A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 |
| B.平衡时N2O4的百分含量:乙>甲=丙 |
| C.平衡时甲中NO2与丙中N2O4的转化率不可能相同 |
| D.平衡时混合物的平均相对分子质量:甲>乙>丙 |
您最近一年使用:0次
2019-11-06更新
|
2230次组卷
|
28卷引用:山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题
山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业六 化学平衡中的模型构建与等效平衡辽宁省辽阳市集美中学2020届高二12月月考化学试题江西省万载中学2019-2020学年高二12月月考(创新班)化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题天津市第一中学2021届高三上学期第二次月考化学试题(已下线)练习4 化学平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题河南省林州市第一中学2020-2021学年高二下学期第二次月考化学试题选择性必修1 专题2 第三单元综合训练黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷河南省洛阳市2021-2022学年高二上期期中考试化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题江西省新余市2021-2022学年高二上学期期末检测化学试题云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题四川省广安市华蓥中学校2021-2022学年高二上学期11月月考化学试题山西省山西大学附属中学2022-2023学年高二上学期10月考化学试题2.3.1浓度 压强变化对化学平衡的影响 课后安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
10 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象与结论 | |
| A | 验证压强对化学平衡的影响 | 先将注射器充满NO2气体,然后将活塞往里推压缩体积 | 观察到注射器内气体颜色加深,证明加压平衡朝生成NO2气体的方向移动 |
| B | 铜的电解精炼 | 待精炼的铜和纯铜连接外加直流电源的阳极和阴极,用硫酸铜溶液作电解质电解 | 阳极上铜逐渐溶解,阴极上铜逐渐析出,硫酸铜溶液浓度保持不变 |
| C | 制备[Cu(NH3)4]SO4·H2O晶体 | 向4mL 0.1mol/LCuSO4溶液中滴加氨水,先形成难溶物,并继续滴加沉淀溶解,然后蒸发溶剂析出晶体 | 反应过程中,NH3的N给出孤对电子,Cu2+接受电子对,形成了稳定的配位键[Cu(NH3)4]2+ |
| D | 除去锅炉水垢中的CaSO4 | 先用碳酸钠溶液浸泡水垢,然后再用盐酸除去 | 利用Ksp(CaSO4)> Ksp(CaCO3),实现沉淀的转化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-21更新
|
404次组卷
|
4卷引用:浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题
浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题(已下线)3.4 配合物与超分子-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)浙江省富阳区第二中学2021-2022学年高二下学期(3月)检测化学试题 河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题



