2023高三·全国·专题练习
解题方法
1 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)
_______  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为_______ mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为_______ 。
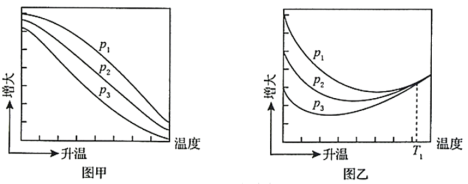
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2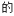 平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=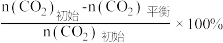
CH3OH的平衡产率=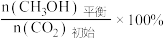
其中纵坐标表示CO2平衡转化率的是图_______ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为_______ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______(填标号)。
Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)

 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2
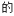 平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
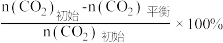
CH3OH的平衡产率=
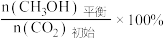
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
您最近一年使用:0次
2023-01-31更新
|
546次组卷
|
4卷引用:专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)
(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)化学反应速率与化学平衡——课时5影响化学平衡的因素广东北江实验学校2023—2024学年高二上学期10月月考化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
2 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
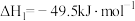
Ⅱ.
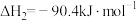
Ⅲ.

回答下列问题:
(1)
_______  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为_______ mol﹒L-1(用含a、b、V的代数式表示)
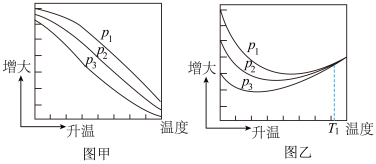
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=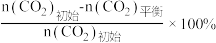
CH3OH的平衡产率=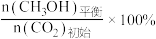
其中纵坐标表示CO2平衡转化率的是图_______ (填“甲”或“乙”);压强P1、P2、P3由大到小的顺序为_______ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
Ⅰ.

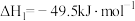
Ⅱ.

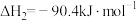
Ⅲ.


回答下列问题:
(1)

 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

已知:CO2的平衡转化率=
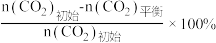
CH3OH的平衡产率=
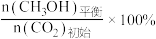
其中纵坐标表示CO2平衡转化率的是图
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
您最近一年使用:0次
名校
解题方法
3 . 以CO和CO2为原料合成乙烯、二甲醚(CH3OCH3)等有机物,一直是当前化学领域研究的热点。回答下列问题:
(1)已知相关物质能量变化示意图如下:
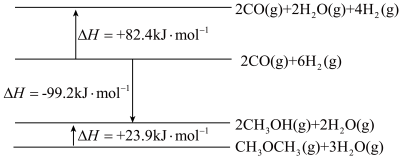
①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:_______ 。
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g) C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是_______ 。
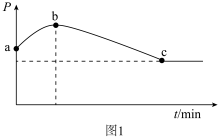
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
Ⅱ.CO2(g) +H2(g) CO(g) + H2O(g)。
CO(g) + H2O(g)。
向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为_______ ;T2℃时主要发生反应_______ (填“Ⅰ”或“Ⅱ”),平衡转化率随温度变化先降后升的原因为_______ 。
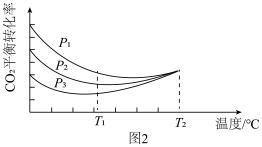
(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g) CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=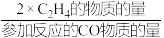 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=_______ MPa3(用含字母p的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),若要提高C2H4的选择性,则应考虑的因素是_______ 。
(1)已知相关物质能量变化示意图如下:

①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g)
 C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g)
 CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);Ⅱ.CO2(g) +H2(g)
 CO(g) + H2O(g)。
CO(g) + H2O(g)。向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为

(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g)
 CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=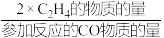 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=
您最近一年使用:0次
2022-07-29更新
|
289次组卷
|
3卷引用:吉林省双辽市一中、大安市一中、通榆县一中等重点高中2021-2022学年高三上学期期末联考理科综合化学试题
名校
解题方法
4 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
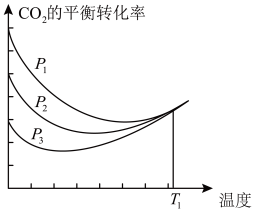
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1234次组卷
|
10卷引用:北京市丰台区2021届高三一模化学试题
北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)河北省武邑中学2021届高考七模化学试题黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷
5 . 为减少碳氧化物的排放,工业上可回收 和
和 合成甲醇(
合成甲醇( )。
)。
(1)利用 和
和 反应合成甲醇时发生两个平行反应:
反应合成甲醇时发生两个平行反应:
反应Ⅰ
反应Ⅱ
控制 和
和 初始投料比为
初始投料比为 ,温度对
,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示:
产率的影响如图所示:
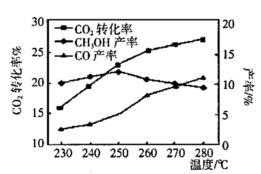
①反应Ⅰ能自发的反应条件:______ 。(填“低温”、“高温”、“任何温度”)
②由图可知温度升高 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是______ 。
③由图可知获取 最适宜的温度是
最适宜的温度是______ 。
④控制 和
和 初始投料比为
初始投料比为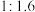 ,在
,在 时反应Ⅰ已达到平衡状态,
时反应Ⅰ已达到平衡状态, 的转化率为
的转化率为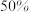 ,甲醇选择性为
,甲醇选择性为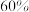 ,此时容器的体积为
,此时容器的体积为 ,若
,若 初始加入量为
初始加入量为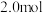 ,则反应Ⅰ的平衡常数是
,则反应Ⅰ的平衡常数是______ 。(甲醇的选择性:转化的 中生成甲醇的百分比)
中生成甲醇的百分比)
(2)利用 和
和 在一定条件下亦可合成甲醇,发生如下反应:
在一定条件下亦可合成甲醇,发生如下反应:
反应Ⅲ
其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是______ 。
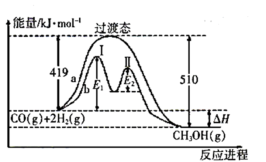
A. 上述反应的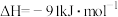
B. 反应正反应的活化能为
反应正反应的活化能为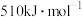
C. 过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D. 过程使用催化剂后降低了反应的活化能和
过程使用催化剂后降低了反应的活化能和
E. 过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入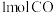 和
和 ,向乙中加入
,向乙中加入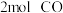 和
和 ,发生反应Ⅲ,测得不同温度下甲中
,发生反应Ⅲ,测得不同温度下甲中 的平衡转化率如图所示,请在图中画出不同温度下乙容器中
的平衡转化率如图所示,请在图中画出不同温度下乙容器中 的平衡转化率变化趋势的曲线
的平衡转化率变化趋势的曲线______ 。
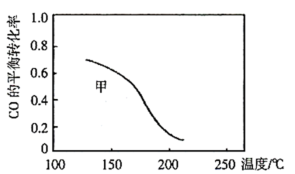
(4)反应Ⅰ生成的甲醇常用作燃料电池的原料,请写出以甲醇、空气、氢氧化钾溶液为原料,石墨为电极构成的燃料电池的负极电极方程式______ 。
 和
和 合成甲醇(
合成甲醇( )。
)。(1)利用
 和
和 反应合成甲醇时发生两个平行反应:
反应合成甲醇时发生两个平行反应:反应Ⅰ

反应Ⅱ

控制
 和
和 初始投料比为
初始投料比为 ,温度对
,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示:
产率的影响如图所示:
①反应Ⅰ能自发的反应条件:
②由图可知温度升高
 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是③由图可知获取
 最适宜的温度是
最适宜的温度是④控制
 和
和 初始投料比为
初始投料比为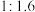 ,在
,在 时反应Ⅰ已达到平衡状态,
时反应Ⅰ已达到平衡状态, 的转化率为
的转化率为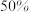 ,甲醇选择性为
,甲醇选择性为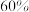 ,此时容器的体积为
,此时容器的体积为 ,若
,若 初始加入量为
初始加入量为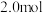 ,则反应Ⅰ的平衡常数是
,则反应Ⅰ的平衡常数是 中生成甲醇的百分比)
中生成甲醇的百分比)(2)利用
 和
和 在一定条件下亦可合成甲醇,发生如下反应:
在一定条件下亦可合成甲醇,发生如下反应:反应Ⅲ

其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是

A. 上述反应的
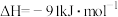
B.
 反应正反应的活化能为
反应正反应的活化能为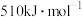
C.
 过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应D.
 过程使用催化剂后降低了反应的活化能和
过程使用催化剂后降低了反应的活化能和
E.
 过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
过程的反应速率:第Ⅱ阶段>第Ⅰ阶段(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入
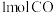 和
和 ,向乙中加入
,向乙中加入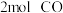 和
和 ,发生反应Ⅲ,测得不同温度下甲中
,发生反应Ⅲ,测得不同温度下甲中 的平衡转化率如图所示,请在图中画出不同温度下乙容器中
的平衡转化率如图所示,请在图中画出不同温度下乙容器中 的平衡转化率变化趋势的曲线
的平衡转化率变化趋势的曲线
(4)反应Ⅰ生成的甲醇常用作燃料电池的原料,请写出以甲醇、空气、氢氧化钾溶液为原料,石墨为电极构成的燃料电池的负极电极方程式
您最近一年使用:0次



