解题方法
1 . 化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反应进行的方向和限度的说法中不正确的是
A.恒温恒容的密闭容器中发生反应mA(g)+nB(g) pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深 pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深 |
| B.一定温度下两个体积相同密闭容器中,分别放有二氧化氮、气态溴,起始时两个容器中气体颜色相同,若将容器体积压缩至原来的一半,则CNO2>CBr2 |
| C.综合考虑反应速率和限度,以及催化剂活性,合成氨一般选择400℃~500℃ |
D.恒温时,对于反应A(g)+3B(g) 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n% 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n% |
您最近一年使用:0次
名校
2 . 回收利用CO是工业生产的一项新课题,新技术研究成果甲醇与CO反应可制备乙酸,其反应为CH3OH(g)+CO(g) CH3COOH(l),测得甲醇的转化率随温度变化如图所示
CH3COOH(l),测得甲醇的转化率随温度变化如图所示
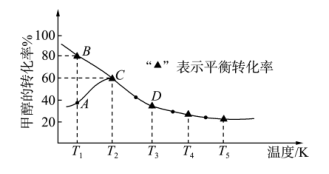
下列有关说法正确的是
 CH3COOH(l),测得甲醇的转化率随温度变化如图所示
CH3COOH(l),测得甲醇的转化率随温度变化如图所示
下列有关说法正确的是
| A.温度升高,平衡常数K增大 |
| B.温度为T1时,该反应的正反应速率:B点>A点 |
| C.缩小容器容积,既能加快反应速率,又能提高甲醇的转化率 |
| D.选择合适的催化剂可以降低反应活化能并提高平衡产率 |
您最近一年使用:0次
2021-12-03更新
|
339次组卷
|
3卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题
名校
3 . 联系生产生活实际,下列说法,不能根据平衡移动原理解释的是
| A.供热公司为了节能减排,将煤块粉碎燃烧 |
| B.可乐瓶开启后,马上泛起大量气泡,并可能将可乐冲出瓶口 |
| C.氯气在饱和食盐水中的溶解度比在水中小 |
| D.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,缓解病情 |
您最近一年使用:0次
2021-12-02更新
|
148次组卷
|
2卷引用:福建省福州外国语学校2021-2022学年高二上学期期中考试化学试题
名校
4 . 将一定量纯净的X置于某10L容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡: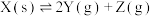 ,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
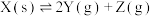 ,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是| 温度(°C) | 15.0 | 25.0 | 30.0 | 35.0 |
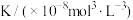 | 0.205 | 1.64 | 4.68 | 10.8 |
A.该反应 |
| B.若气体密度不再随时间变化时表示反应达平衡状态 |
| C.若在恒温下,压缩容器体积,再次达平衡后,X的物质的量比原平衡大 |
| D.35℃时,达平衡时,X分解了0.02mol |
您最近一年使用:0次
5 . 氨是化肥生产工业的重要原料。传统的Haber—Bosch法目前仍是合成氨的主要方式,反应原理为N2(g)+3H2(g) 2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是
2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是
 2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是
2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是| A.该反应的ΔH>0、ΔS<0 |
| B.将氨气及时液化分离可加快化学反应速率 |
| C.当2v(H2)正=3v(NH3)逆时,反应达到平衡状态 |
| D.提高体系的压强可增大反应的化学平衡常数 |
您最近一年使用:0次
2021-11-20更新
|
412次组卷
|
6卷引用:江苏省常州市部分重点中学2021-2022学年高三上学期期中考试化学试题
江苏省常州市部分重点中学2021-2022学年高三上学期期中考试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期10月月考化学试题
6 . 在一定体积的密闭容器中,可逆反应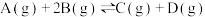 ,有如图所示的反应曲线,下列说法中错误的是
,有如图所示的反应曲线,下列说法中错误的是
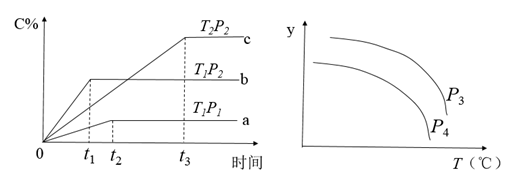
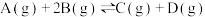 ,有如图所示的反应曲线,下列说法中错误的是
,有如图所示的反应曲线,下列说法中错误的是
| A.正反应是放热反应 | B. |
C.若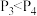 ,y轴可表示A的转化率 ,y轴可表示A的转化率 | D.若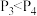 ,y轴可表示D的体积分数 ,y轴可表示D的体积分数 |
您最近一年使用:0次
7 . 已知N2(g)+3H2(g) 2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
 2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是| 容器 | 甲(恒温、恒容) | 乙(绝热、恒容) | 丙(恒温、恒压) |
| 反应物投入量 | 1molN2、3molH2 | 1molN2、3molH2 | 1molN2、3molH2 |
| NH3的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应物的转化率 | α1 | α2 | α3 |
| 化学平衡常数 | K1 | K2 | K3 |
| 混合气体的平均相对分子质量 | M1 | M2 | M3 |
| A.c2<c1<c3 | B.α2<α3<α1 |
| C.K2<K1=K3 | D.M2<M1<M3 |
您最近一年使用:0次
名校
8 . 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生如下反应:CO(g)+H2O(g) CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是
CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是
 CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是
CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.80 | 0.90 |
| t1 | 1.20 | |
| t2 | 0.30 |
| A.t2后若压缩容器体积至原来一半,再次平衡则c(H2O)=0.30mol/L |
| B.若初始量CO:3.6mol,H2O:1.8mol,则平衡时n(H2O)=0.60mol |
| C.t2后若增加0.9 mol H2O,则再次平衡时,H2的体积分数为25% |
| D.若为绝热容器(容器初始温度仍为700℃),其他条件不变,则平衡时n(H2)>0.60mol |
您最近一年使用:0次
2021-11-15更新
|
201次组卷
|
4卷引用:安徽省A10联盟2021-2022学年高二上学期期中联考化学试题
名校
9 . 某温度下,在恒容密闭容器中SO2、O2、SO3三种气态物质建立化学平衡:2SO2(g)+O2(g) 2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是
2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是
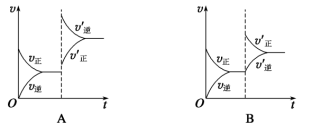
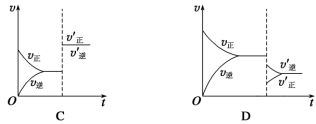
 2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是
2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法不正确的是

| A.压缩容器体积 | B.通入O2 |
| C.通入稀有气体He | D.减低温度 |
您最近一年使用:0次
2021-11-15更新
|
202次组卷
|
2卷引用:安徽省A10联盟2021-2022学年高二上学期期中联考化学试题
10 . 一定条件下,发生反应: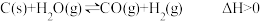 达到平衡后,下列说法错误的是
达到平衡后,下列说法错误的是
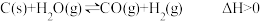 达到平衡后,下列说法错误的是
达到平衡后,下列说法错误的是| A.其它条件不变,升高温度,v(正)增大的程度比v(逆)增大的程度大,平衡向右移动 |
| B.恒温恒容条件下,充入稀有气体,v(正)、v(逆)不变,平衡不移动 |
| C.其它条件不变,增大压强,v(正)、v(逆)同倍数增大,平衡不移动 |
| D.恒温恒容条件下,加入碳粉,v(正)不变,v(逆)不变,平衡不移动 |
您最近一年使用:0次
2021-11-13更新
|
360次组卷
|
6卷引用:河南省中原名校2021-2022学年高二上学期第一次联考化学试题
河南省中原名校2021-2022学年高二上学期第一次联考化学试题河南省实验中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷新疆乌鲁木齐市第八中学2021-2022学年高二上学期第二次月考化学试题云南省昆明市官渡区第一中学2021-2022学年高二上学期期中考试化学试题



