名校
1 . 回答下列问题:
(1)①
②
③
根据反应①与反应②可推导出 、
、 与
与 之间的关系,则
之间的关系,则
_______ (用 、
、 表示);
表示);
(2)pH均为1的盐酸和醋酸溶液,稀释至原体积的1000倍,pH较大的是_______ ;
(3)将 、
、 的
的 溶液升温至
溶液升温至 ,其
,其
_______ ;
(4)常温,向 醋酸溶液中加入冰醋酸,其电离度
醋酸溶液中加入冰醋酸,其电离度_______ ,
_______ (填“增大”、“减小”或“不变”)。
(1)①

②

③

根据反应①与反应②可推导出
 、
、 与
与 之间的关系,则
之间的关系,则
 、
、 表示);
表示);(2)pH均为1的盐酸和醋酸溶液,稀释至原体积的1000倍,pH较大的是
(3)将
 、
、 的
的 溶液升温至
溶液升温至 ,其
,其
(4)常温,向
 醋酸溶液中加入冰醋酸,其电离度
醋酸溶液中加入冰醋酸,其电离度
您最近一年使用:0次
名校
解题方法
2 . 合成氨是人类科学技术上的一项重大突破。
合成氨的反应原理为: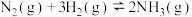 ,合成氨的简易流程图如下:
,合成氨的简易流程图如下:

(1)步骤I:天然气中的杂质H2S常用氨水吸收。
步骤Ⅱ:制氢气的原理如下:
反应1: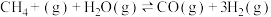
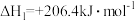
反应2: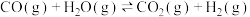
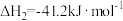
对于反应1,一定可以提高平衡体系中H2百分含量同时能加快反应速率的措施是___________。
(2)对于反应 ,在一定条件下氨的平衡含量如表。
,在一定条件下氨的平衡含量如表。
①该反应为___________ (填“吸热”或“放热”)反应。
②工业合成氨选用的条件是550℃、10 MPa,而非200℃、10 MPa,原因是________ 。
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
①工业合成氨反应的平衡常数表达式为K=___________ 。
②投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,计算该温度下合成氨反应的平衡常数K=___________ 。
③按投料II进行反应,起始时反应进行的方向为___________ (填“正向”或“逆向”)。
(4)实际生产中,常用工艺条件: 作催化剂,控制温度773 K,压强
作催化剂,控制温度773 K,压强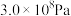 ,原料气中N2和H2物质的量之比为1:2.8,在
,原料气中N2和H2物质的量之比为1:2.8,在 催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
①分析说明原料气中 过量的理由
过量的理由___________ 。
②步骤III-IV合成氨: ,有关合成氨工艺说法正确的是
,有关合成氨工艺说法正确的是___________ 。
A.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
B.步骤III:分离空气可得N2,通过天然气和水蒸气转化可得H2,然后将所得原料气直接混合,经加压、热交换后制得合成氨
C.步骤IV:热交换过程中控制反应的温度为(773 K),远高于室温,是为了保证尽可提高平衡转化率和加快反应速率
D.步骤V基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
合成氨的反应原理为:
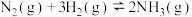 ,合成氨的简易流程图如下:
,合成氨的简易流程图如下:
(1)步骤I:天然气中的杂质H2S常用氨水吸收。
步骤Ⅱ:制氢气的原理如下:
反应1:
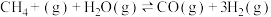
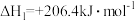
反应2:
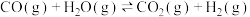
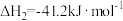
对于反应1,一定可以提高平衡体系中H2百分含量同时能加快反应速率的措施是___________。
| A.升高温度 | B.增大水蒸气的浓度 |
| C.加入合适催化剂 | D.增加压强 |
 ,在一定条件下氨的平衡含量如表。
,在一定条件下氨的平衡含量如表。| 温度/℃ | 压强/ | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②工业合成氨选用的条件是550℃、10 MPa,而非200℃、10 MPa,原因是
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
单位: |  |  |  |
| 投料I | 1.0 | 3.0 | 0 |
| 投料II | 0.5 | 1.5 | 1.0 |
②投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,计算该温度下合成氨反应的平衡常数K=
③按投料II进行反应,起始时反应进行的方向为
(4)实际生产中,常用工艺条件:
 作催化剂,控制温度773 K,压强
作催化剂,控制温度773 K,压强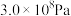 ,原料气中N2和H2物质的量之比为1:2.8,在
,原料气中N2和H2物质的量之比为1:2.8,在 催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。| 化学吸附 | → | 表面反应 | → | 脱附 |
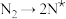 | 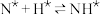 |  | ||
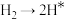 | 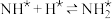 | |||
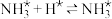 |
 过量的理由
过量的理由②步骤III-IV合成氨:
 ,有关合成氨工艺说法正确的是
,有关合成氨工艺说法正确的是A.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
B.步骤III:分离空气可得N2,通过天然气和水蒸气转化可得H2,然后将所得原料气直接混合,经加压、热交换后制得合成氨
C.步骤IV:热交换过程中控制反应的温度为(773 K),远高于室温,是为了保证尽可提高平衡转化率和加快反应速率
D.步骤V基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
您最近一年使用:0次
2022-01-03更新
|
415次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2021-2022学年高二上学期期末考试化学试题
3 . SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
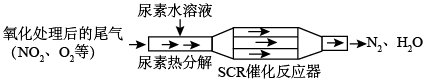
尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________ 。
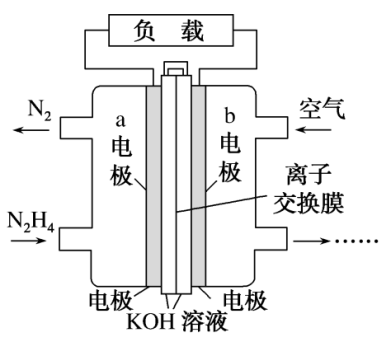
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为___________ ;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的___________ 极(填“正”或“负”),a电极的电极反应式为___________ 。
(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=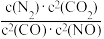 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___________ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol∙L-1∙min-1。
(1)SCR(选择性催化还原)工作原理:

尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为

(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=
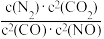 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=
您最近一年使用:0次
2021-11-19更新
|
105次组卷
|
2卷引用:黑龙江省龙东地区四校2021-2022学年高三上学期第一次联考化学试题
名校
解题方法
4 . 近几年经济发展迅速,汽车数量越来越多,在方便我们的工作和生活的同时,也带来了严重的环境问题,为了消除汽车尾气对大气环境和人体健康造成的影响,科学家们想了很多处理尾气的方法。
(1)活性炭可用于处理汽车尾气中的NO,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
①判断该反应达到平衡的标志为___________ 。(填标号)
A.容器内气体的物质的量恒定 B.NO、N2、CO2的物质的量之比为2:1:1
C.v正(NO)=2v逆(CO2) D.容器内气体密度恒定
②某温度时,向4L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:

a.图中A点v正___________ v逆(填“>”“<”或“=”)。
b.0~20min内的N2平均反应速率v=___________ ;在此过程中,气体的平均相对分子质量____ (填“增大”、“减小”或“不变”)。
c.第20min时,外界改变的条件可能是___________ 。
(2)CO可以与NO2反应:4CO(g)+2NO2(g) N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H
N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H___________ 0(填“>”或“<”,下同);p1___________ p2。

(3)在汽车排气管上安装催化转化器可以有效降低汽车尾气中的NO和CO,反应方程式为:2CO(g)+2NO(g) N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=
N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=______ 。(Kp为以分压表示的平衡常数,分压=总压×某物质的物质的量分数)
(1)活性炭可用于处理汽车尾气中的NO,有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)。
N2(g)+CO2(g)。①判断该反应达到平衡的标志为
A.容器内气体的物质的量恒定 B.NO、N2、CO2的物质的量之比为2:1:1
C.v正(NO)=2v逆(CO2) D.容器内气体密度恒定
②某温度时,向4L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
a.图中A点v正
b.0~20min内的N2平均反应速率v=
c.第20min时,外界改变的条件可能是
(2)CO可以与NO2反应:4CO(g)+2NO2(g)
 N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H
N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H
(3)在汽车排气管上安装催化转化器可以有效降低汽车尾气中的NO和CO,反应方程式为:2CO(g)+2NO(g)
 N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=
N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=
您最近一年使用:0次
2021-05-12更新
|
283次组卷
|
4卷引用:黑龙江省大庆中学2021届高三第一次仿真考试化学试题



