1 . 页岩气中含有 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。
(1)去除废气中 的相关热化学方程式如下:
的相关热化学方程式如下:
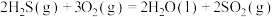
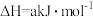
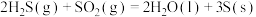

反应 的
的
______ 
(2)金属硫化物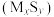 催化反应
催化反应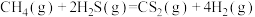 ,既可以除去天然气中的
,既可以除去天然气中的 ,又可以获得
,又可以获得 ,下列说法正确的是______。
,下列说法正确的是______。
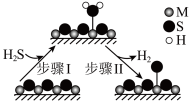
(3)通过电化学循环法可将 转化为
转化为 和
和 (如图所示),其中氧化过程发生如下两步反应:
(如图所示),其中氧化过程发生如下两步反应: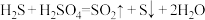 、
、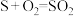 。
。
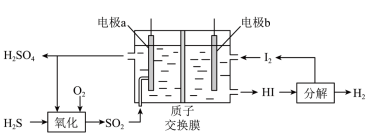
①电极a上发生反应的电极反应式为__________________ 。
②理论上1mol 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为__________________ 。
(4)我国科学家设计了一种 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
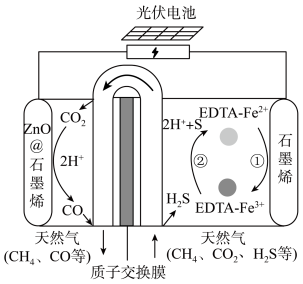
①Zno@石墨烯是______ 极(填“阳”或“阴”)。
②石墨烯电极区发生反应为:
ⅰ.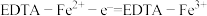
ⅱ.__________________ 。
 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。(1)去除废气中
 的相关热化学方程式如下:
的相关热化学方程式如下:

反应
 的
的

(2)金属硫化物
 催化反应
催化反应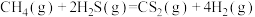 ,既可以除去天然气中的
,既可以除去天然气中的 ,又可以获得
,又可以获得 ,下列说法正确的是______。
,下列说法正确的是______。
A.该反应的 |
B.该反应的平衡常数 |
C.题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷的S与催化剂中的M之间发生作用 中带部分负电荷的S与催化剂中的M之间发生作用 |
D.该反应中每消耗1mol ,转移电子的数目约为 ,转移电子的数目约为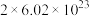 |
(3)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示),其中氧化过程发生如下两步反应:
(如图所示),其中氧化过程发生如下两步反应: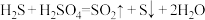 、
、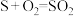 。
。
①电极a上发生反应的电极反应式为
②理论上1mol
 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(4)我国科学家设计了一种
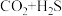 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
①Zno@石墨烯是
②石墨烯电极区发生反应为:
ⅰ.
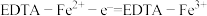
ⅱ.
您最近一年使用:0次
名校
解题方法
2 . 电解法可用于提纯金属。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应),某小组在实验室条件下以CuSO4溶液为电解液,用电解的方法实现粗铜精炼,并将电解液和阳极泥进行回收。
(1)步骤一:电解精炼铜,用下图装置电解时。

①粗铜应该为___________ 极(填“A”或“B”);
②CH3OH参加的电极方程式为___________ ;
③当A极质量变化ag,当B极质量变化bg时,左池消耗O2的质量为___________ g;
④电解结束后,右池溶液中CuSO4的浓度会___________ (填“增大”或“不变”或“减小”)。
(2)步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

①电解液中的溶质除了硫酸铜还有___________ ;
②操作a中用到的玻璃仪器除烧杯外还有___________ ;
③残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
请通过计算化学平衡常数来解释为什么金很难与浓硝酸反应,但却可溶于王水(浓硝酸与浓盐酸的混合物)___________ 。
(1)步骤一:电解精炼铜,用下图装置电解时。

①粗铜应该为
②CH3OH参加的电极方程式为
③当A极质量变化ag,当B极质量变化bg时,左池消耗O2的质量为
④电解结束后,右池溶液中CuSO4的浓度会
(2)步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

①电解液中的溶质除了硫酸铜还有
②操作a中用到的玻璃仪器除烧杯外还有
③残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
| 反应原理 | 化学平衡常数 | |
| 反应1 | Au+6HNO3 Au(NO3)3+3NO2↑+3H2O Au(NO3)3+3NO2↑+3H2O | K1=2×10-8 |
| 反应2 | Au(NO3)3+4HCl H[AuCl4]+3HNO3 H[AuCl4]+3HNO3 | K2=4×1011 |
| 反应3 | Au+3HNO3+4HCl H[AuCl4]+3NO2↑+3H2O H[AuCl4]+3NO2↑+3H2O | K3 |
您最近一年使用:0次
2023-11-11更新
|
104次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高二上学期11月期中化学试题
解题方法
3 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知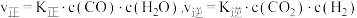 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数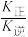 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知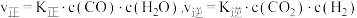 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数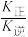 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
名校
4 . 在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应:mA+nB pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
下列说法一定正确的是
 pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:| 压强p/Pa | 2×105 | 5×105 | 1×106 | 3×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.40 | 0.80 |
| A.保持一定温度,增大压强,平衡正向移动 |
B.当压强为3×106Pa时,此反应的平衡常数表达式:Kp=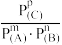 |
| C.反应平衡后若增大压强,则新平衡的逆反应速率大于原平衡的逆反应速率 |
| D.若再向体系中加入bmolB,当重新达到平衡时,体系中A、B、C总物质的量为(4+b)mol |
您最近一年使用:0次
2022-05-11更新
|
528次组卷
|
4卷引用:福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
名校
5 . 回答下列问题
(1)高温下,在密闭容器中用 还原
还原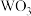 可得到金属钨,其总反应为:
可得到金属钨,其总反应为: ,该反应的化学平衡常数表达式为
,该反应的化学平衡常数表达式为_______ 。
(2)为了减少CO的排放,某环境研究小组以CO和 为原料合成清洁能源二甲醚(
为原料合成清洁能源二甲醚( ),反应如下:
),反应如下: 。如图所示能正确反映平衡常数K随温度变化关系的曲线为
。如图所示能正确反映平衡常数K随温度变化关系的曲线为_______ (填曲线标记字母),其判断理由是_______ 。

(1)高温下,在密闭容器中用
 还原
还原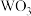 可得到金属钨,其总反应为:
可得到金属钨,其总反应为: ,该反应的化学平衡常数表达式为
,该反应的化学平衡常数表达式为(2)为了减少CO的排放,某环境研究小组以CO和
 为原料合成清洁能源二甲醚(
为原料合成清洁能源二甲醚( ),反应如下:
),反应如下: 。如图所示能正确反映平衡常数K随温度变化关系的曲线为
。如图所示能正确反映平衡常数K随温度变化关系的曲线为
您最近一年使用:0次
2022-03-20更新
|
190次组卷
|
2卷引用:福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题
名校
6 . 工业上可通过反应4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g) ΔH=-114.4kJ·mol-1将HCl转化为Cl2,下列有关说法正确的是
| A.使用催化剂能缩短该反应达到平衡的时间 |
| B.升高温度和增大压强均能提高反应中HCl的平衡转化率 |
C.反应的平衡常数可表示为K= |
D.其他条件相同,增大 ,HCl的转化率上升 ,HCl的转化率上升 |
您最近一年使用:0次
2021-12-24更新
|
210次组卷
|
3卷引用:福建省厦门市湖滨中学2023-2024学年高二上学期期中考试化学试题
福建省厦门市湖滨中学2023-2024学年高二上学期期中考试化学试题江苏省百校大联考2021-2022学年高三上学期第二次考试化学试题(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)
名校
7 . 回答问题:
(1)目前,大部分的载人航天器通过萨巴蒂尔循环实现元素的循环和能量的充分利用,其流程图为:
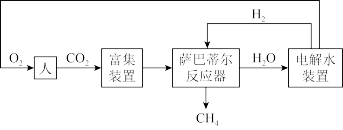
已知:①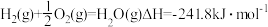
②CH4(g)+2O2(g)=2H2O(g)+CO2(g)△H=-802.3kJ.mol-1
写出萨巴蒂尔反应(生成的水为水蒸气)的热化学方程式___________ 。
(2)CO和H2是重要的工业原料,被称为合成气,可合成CH4、CH3OH等重要的化工原料。如:CO(g)+3H2(g) CH4(g)+H2O(l)。
CH4(g)+H2O(l)。
①该反应的化学平衡常数表达式为K=___________ 。
②增大压强(压缩容器体积为原来的一半),平衡向___________ (“正反应”或“逆反应”)方向移动,请利用K和Q的关系说明理由:___________ 。
③为了提高H2的转化率,可以采用什么方法:___________ (写两种)。
(1)目前,大部分的载人航天器通过萨巴蒂尔循环实现元素的循环和能量的充分利用,其流程图为:

已知:①
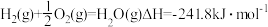
②CH4(g)+2O2(g)=2H2O(g)+CO2(g)△H=-802.3kJ.mol-1
写出萨巴蒂尔反应(生成的水为水蒸气)的热化学方程式
(2)CO和H2是重要的工业原料,被称为合成气,可合成CH4、CH3OH等重要的化工原料。如:CO(g)+3H2(g)
 CH4(g)+H2O(l)。
CH4(g)+H2O(l)。①该反应的化学平衡常数表达式为K=
②增大压强(压缩容器体积为原来的一半),平衡向
③为了提高H2的转化率,可以采用什么方法:
您最近一年使用:0次
2021-10-13更新
|
57次组卷
|
2卷引用:福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题
8 . 请根据化学反应原理的知识回答下列问题。
(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知298K温度下:
①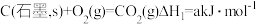
②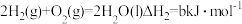
③
反应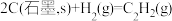 的焓变
的焓变  =
=___________ 。(用含字母的代数式表示)
(2)某研究小组发现用NH3还原法也可以处理氮氧化物,发生反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
5N2(g)+6H2O(g)  =-1806.4 kJ·mol-1。
=-1806.4 kJ·mol-1。
① 下列事实能说明该反应达到平衡状态的是___________ (填选项字母)。
a.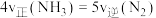 b. NH3(g)与H2O(g)的物质的量之比保持不变
b. NH3(g)与H2O(g)的物质的量之比保持不变
c. 恒容密闭容器中气体的密度保持不变 d. 各组分的物质的量分数保持不变
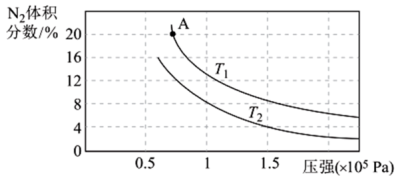
② 向一密闭容器中充入2 mol NH3(g)和3 mol NO(g),发生上述反应,平衡混合物中N2的体积分数与压强、温度的关系如图所示(T代表温度),判断T1和T2的大小关系:T1___________ T2(填“>”“<”或“=”)。T1时,A点的坐标为(0.75,20),此时NO的转化率为___________ (保留三位有效数字)。
(3)科学研究表明,活性炭还原法也能处理氮氧化物,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H>0.某探究小组向恒容密闭容器中加入足量的活性炭和1.0 mol NO(g),充分反应后达到化学平衡。其他条件不变,下列措施能同时提高化学反应速率和NO平衡转化率的是
N2(g)+CO2(g) △H>0.某探究小组向恒容密闭容器中加入足量的活性炭和1.0 mol NO(g),充分反应后达到化学平衡。其他条件不变,下列措施能同时提高化学反应速率和NO平衡转化率的是___________ (填选项字母)。
a. 通入氦气 b. 加入催化剂
c. 除去体系中的CO2 d. 升高温度
(4)某种甲醇燃料电池的工作原理如图所示,则通入a气体的电极反应式为___________ 。

(5)CuS呈黑色,是最难溶的物质之一,由于它的难溶性使得一些看似不可能的反应可以发生。向0.01 mol·L-1 CuSO4溶液中,持续通入H2S维持饱和(H2S饱和浓度为0.1 mol·L-1),发生反应:H2S(aq)+Cu2+(aq) CuS(s)+2H+(aq),该反应的化学平衡常数K为
CuS(s)+2H+(aq),该反应的化学平衡常数K为___________ (保留2位有效数字)。已知: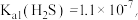
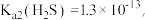
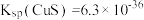 。
。
(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知298K温度下:
①
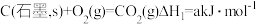
②
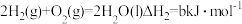
③

反应
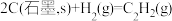 的焓变
的焓变  =
=(2)某研究小组发现用NH3还原法也可以处理氮氧化物,发生反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)
5N2(g)+6H2O(g)  =-1806.4 kJ·mol-1。
=-1806.4 kJ·mol-1。① 下列事实能说明该反应达到平衡状态的是
a.
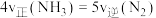 b. NH3(g)与H2O(g)的物质的量之比保持不变
b. NH3(g)与H2O(g)的物质的量之比保持不变c. 恒容密闭容器中气体的密度保持不变 d. 各组分的物质的量分数保持不变
② 向一密闭容器中充入2 mol NH3(g)和3 mol NO(g),发生上述反应,平衡混合物中N2的体积分数与压强、温度的关系如图所示(T代表温度),判断T1和T2的大小关系:T1

(3)科学研究表明,活性炭还原法也能处理氮氧化物,发生反应C(s)+2NO(g)
 N2(g)+CO2(g) △H>0.某探究小组向恒容密闭容器中加入足量的活性炭和1.0 mol NO(g),充分反应后达到化学平衡。其他条件不变,下列措施能同时提高化学反应速率和NO平衡转化率的是
N2(g)+CO2(g) △H>0.某探究小组向恒容密闭容器中加入足量的活性炭和1.0 mol NO(g),充分反应后达到化学平衡。其他条件不变,下列措施能同时提高化学反应速率和NO平衡转化率的是a. 通入氦气 b. 加入催化剂
c. 除去体系中的CO2 d. 升高温度
(4)某种甲醇燃料电池的工作原理如图所示,则通入a气体的电极反应式为

(5)CuS呈黑色,是最难溶的物质之一,由于它的难溶性使得一些看似不可能的反应可以发生。向0.01 mol·L-1 CuSO4溶液中,持续通入H2S维持饱和(H2S饱和浓度为0.1 mol·L-1),发生反应:H2S(aq)+Cu2+(aq)
 CuS(s)+2H+(aq),该反应的化学平衡常数K为
CuS(s)+2H+(aq),该反应的化学平衡常数K为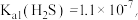
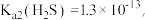
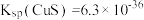 。
。
您最近一年使用:0次



