1 . 氨用于制造氨水、氮肥等,广泛应用于化工、化肥、制药、合成纤维等领域。
反应I:4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1< 0
反应Ⅱ:4NH3(g)+3O2(g) = 2N2(g)+6H2O(g) ΔH2< 0
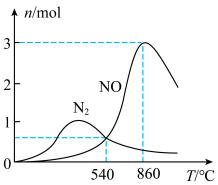
一体积固定的密闭容器中,按n(NH3):n(O2) = 1:5投料进行反应。下图为某一段时间的物量变化示意图,下列说法正确的是
反应I:4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1< 0
反应Ⅱ:4NH3(g)+3O2(g) = 2N2(g)+6H2O(g) ΔH2< 0
一体积固定的密闭容器中,按n(NH3):n(O2) = 1:5投料进行反应。下图为某一段时间的物量变化示意图,下列说法正确的是

| A.O2的平衡转化率始终低于NH3 |
B.反应I平衡常数表达式为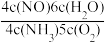 |
| C.540℃~860℃时容器发生的反应以反应Ⅱ为主 |
| D.加入适当的催化剂无法提高NO的产率 |
您最近一年使用:0次
解题方法
2 . TiCl4是一种重要的化工原料,由钛精矿(主要成分为TiO2,还含少量Si、Al、Fe等元素的化合物杂质)制备纯TiCl4的工艺流程如下:

(1)已知:
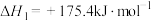

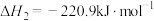
沸腾炉中TiO2(s)与Cl2、C反应生成TiCl4(g)和CO的热化学方程式为_______ 。
(2)氯化过程中CO与CO2可相互转化,反应为: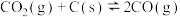 △H
△H
①该反应的平衡常数表达式为K=_______ 。
②如图为只改变反应温度时CO2、CO的物质的量变化图,则该反应的△H_______ (填“>”“=”或“<”)0,依据是_______ 。
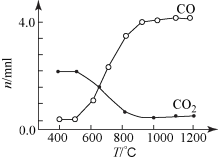
③下列有利于提高CO2转化率的措施有_______ (填字母)。
a.加压 b.加入C(s) c.移出CO
(3)TiCl4及所含主要杂质氯化物的部分性质如下表:
①蒸馏塔的温度:T1_______ (填“>”“=”或“<”)T2,原因是_______ 。
②温度T2应略高于_______ ℃。

(1)已知:

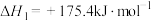

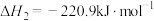
沸腾炉中TiO2(s)与Cl2、C反应生成TiCl4(g)和CO的热化学方程式为
(2)氯化过程中CO与CO2可相互转化,反应为:
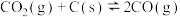 △H
△H①该反应的平衡常数表达式为K=
②如图为只改变反应温度时CO2、CO的物质的量变化图,则该反应的△H

③下列有利于提高CO2转化率的措施有
a.加压 b.加入C(s) c.移出CO
(3)TiCl4及所含主要杂质氯化物的部分性质如下表:
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 |
| 熔点/℃ | -69 | 25 | 193 | 304 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | |
②温度T2应略高于
您最近一年使用:0次
3 . 氮氧化物的有效去除和资源的充分利用是当今社会的重要研究课题。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为_______ kJ•mol-1 (用含E逆的代数式表示)。
(2)已知:①2NO(g)+2ICl(g) 2NOCl (g)+I2(g)
2NOCl (g)+I2(g)
②2NOCl(g) 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)
③I2(g)+Cl2(g) 2ICl(g)
2ICl(g)
若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为_______ mol•L-1(用含 a、b、V 的代数式表示,下同),反应③的平衡常数为_______ 。
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g) CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:_______ 。
(4)已知4CO(g) +2NO2(g) 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行,为探究温度及不同催化剂对该反应的影响,保持其它初始条件不变重复实验,在相同时间内测得 N2产率与温度的关系如图所示。在催化剂乙作用下,图中 M 点对应的速率(对应温度400℃)v正_______ (填“>”、“<” 或“=”) v逆,温度高于400℃,N2产率降低的原因可能是_______ 。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为(2)已知:①2NO(g)+2ICl(g)
 2NOCl (g)+I2(g)
2NOCl (g)+I2(g) ②2NOCl(g)
 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)③I2(g)+Cl2(g)
 2ICl(g)
2ICl(g)若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g)
 CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
(4)已知4CO(g) +2NO2(g)
 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
您最近一年使用:0次
2022-05-12更新
|
855次组卷
|
5卷引用:2024届广西桂林市高三下学期4月月考化学试卷
2024届广西桂林市高三下学期4月月考化学试卷天津市和平区2022届高三第二次质量调查化学试题湖南省邵东市第三中学2021-2022学年高三下学期5月月考化学试题湖南省祁东县育贤中学2022-2023学年高二上学期第一次月考化学试题(已下线)专题06 化学反应的方向及调控【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
解题方法
4 . 乙烯的分子式为 ,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应 制备乙烯。
制备乙烯。
已知:Ⅰ. ;
;
Ⅱ. ;
;
Ⅲ. 。
。
则
___________ kJ/mol。
(2)乙烯可用于制备乙醇: 。向某恒容密闭容器中充入
。向某恒容密闭容器中充入 和
和 ,测得
,测得 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示:

①该反应为___________ (填“吸”或“放”)热反应,理由为___________ 。
②A点时容器中气体的总物质的量为___________ 。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(Kp),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的Kp=___________  (用含b的分数表示)
(用含b的分数表示)
③若保持其他条件不变,将容器改为恒压密闭容器,则300℃时, 的平衡转化率
的平衡转化率___________ 10%(填“>”“<”或“=”)。
 ,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:(1)乙烯的制备:工业上常利用反应
 制备乙烯。
制备乙烯。已知:Ⅰ.
 ;
;Ⅱ.
 ;
;Ⅲ.
 。
。则

(2)乙烯可用于制备乙醇:
 。向某恒容密闭容器中充入
。向某恒容密闭容器中充入 和
和 ,测得
,测得 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示:
①该反应为
②A点时容器中气体的总物质的量为
 (用含b的分数表示)
(用含b的分数表示)③若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,
 的平衡转化率
的平衡转化率
您最近一年使用:0次
5 . 写出下列反应的化学平衡常数表达式及单位,并回答下列问题。
(1)N2(g)+3H2(g) 2NH3(g) K1=
2NH3(g) K1=____ ,单位:____ 。
(2) N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) K2=
NH3(g) K2=____ ,单位:____ 。
(3)2NH3(g) N2(g)+3H2(g) K3=
N2(g)+3H2(g) K3=____ ,单位:____ 。
(4)对于某一个反应,其平衡常数的表达式是唯一的吗____ ?平衡常数表达式的书写哪些因素有关____ ?
(5)由K1、K3可知,正向反应和逆向反应的平衡常数有什么关系____ ?
(6)由K1、K2可知,化学方程式的化学计量数变为原来的 倍,化学平衡常数K1、K2有何关系
倍,化学平衡常数K1、K2有何关系____ ?
(7)以mA(g)+nB(g) pC(g)+qD(g)为例,说明化学平衡常数的单位与反应方程式中气态物质的系数有何关系
pC(g)+qD(g)为例,说明化学平衡常数的单位与反应方程式中气态物质的系数有何关系____ ?
(1)N2(g)+3H2(g)
 2NH3(g) K1=
2NH3(g) K1=(2)
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) K2=
NH3(g) K2=(3)2NH3(g)
 N2(g)+3H2(g) K3=
N2(g)+3H2(g) K3=(4)对于某一个反应,其平衡常数的表达式是唯一的吗
(5)由K1、K3可知,正向反应和逆向反应的平衡常数有什么关系
(6)由K1、K2可知,化学方程式的化学计量数变为原来的
 倍,化学平衡常数K1、K2有何关系
倍,化学平衡常数K1、K2有何关系(7)以mA(g)+nB(g)
 pC(g)+qD(g)为例,说明化学平衡常数的单位与反应方程式中气态物质的系数有何关系
pC(g)+qD(g)为例,说明化学平衡常数的单位与反应方程式中气态物质的系数有何关系
您最近一年使用:0次
2022-02-10更新
|
194次组卷
|
3卷引用:广西钦州市第四中学2023-2024学年高二上学期10月考试化学试卷
解题方法
6 . I.氮及其化合物在工农业生产、生活中有着重要作用。氮气在一定的温度、压强和催化剂的作用下可合成氨: N2(g)+3H2(g) 2NH3 (g)。
2NH3 (g)。
(1)在恒温固定容积的反应室中,能说明上述反应达到平衡状态的是___________。
(2)一定条件下,合成氨反应中N2的平衡转化率与温度、压强的关系如图所示。从图中可知,p1___________ p2(填“<”、“>”或“=”,下同),正反应的ΔH___________ 0。

(3)下列措施一定能使 减小的是___________。
减小的是___________。
(4)200℃、p1条件下,将1 mol N2和3 mol H2通入2 L的反应室,t min末NH3(g)的浓度为0.4 mol/L,t min内H2的反应速率为___________ mol·L-1·min-1(用含有t的代数式表示);该条件下化学平衡常数K=___________ (列式即可,不用计算出结果)。
II.有人设想以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氨的新型燃料电池,装置如图所示。

(5)电池正极发生的电极反应式是___________
 2NH3 (g)。
2NH3 (g)。(1)在恒温固定容积的反应室中,能说明上述反应达到平衡状态的是___________。
| A.N2、H2、NH3的物质的量浓度之比为1:3:2 | B.混合气体总物质的量不再变化 |
| C.混合气体的密度不再变化 | D.3v(NH3)正=2v(H2)逆 |

(3)下列措施一定能使
 减小的是___________。
减小的是___________。| A.升高温度 | B.恒温恒容充入惰性气体 |
| C.恒温恒压充入N2 | D.加入更高效的催化剂 |
II.有人设想以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氨的新型燃料电池,装置如图所示。

(5)电池正极发生的电极反应式是
您最近一年使用:0次
名校
7 . 煤燃烧排放的烟气中含有SO2,SO2易形成酸雨,污染大气。采用NaClO2溶液作为吸收剂可对烟气进行脱硫,发生如下反应: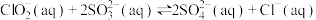
 。在不同温度下,测得反应中SO2的压强变化如图所示,下列说法错误的是
。在不同温度下,测得反应中SO2的压强变化如图所示,下列说法错误的是
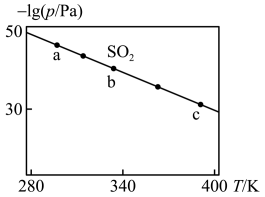
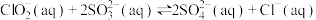
 。在不同温度下,测得反应中SO2的压强变化如图所示,下列说法错误的是
。在不同温度下,测得反应中SO2的压强变化如图所示,下列说法错误的是
| A.△H<0 |
B.该反应的平衡常数表达式为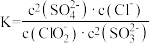 |
| C.减小压强,有利于该反应朝正反应方向进行 |
| D.平衡常数:K(a)>K(b)>K(c) |
您最近一年使用:0次
2021-12-25更新
|
136次组卷
|
2卷引用:广西南宁沛鸿民族中学2023-2024学年高二上学期10月月考化学试题
解题方法
8 . CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H=﹣890 kJ•mol-1可用于甲醇的制备。下列有关该反应的说法正确的是
CH3OH(g)+H2O(g)△H=﹣890 kJ•mol-1可用于甲醇的制备。下列有关该反应的说法正确的是
 CH3OH(g)+H2O(g)△H=﹣890 kJ•mol-1可用于甲醇的制备。下列有关该反应的说法正确的是
CH3OH(g)+H2O(g)△H=﹣890 kJ•mol-1可用于甲醇的制备。下列有关该反应的说法正确的是| A.上述反应能在任何温度下自发进行 |
B.该反应的平衡常数K=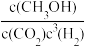 |
| C.该反应每生成1mol甲醇需消耗3×22.4 LH2 |
| D.用E表示键能,该反应△H=2E(C=O)+3E(H﹣H)﹣3E(C﹣H)﹣E(C﹣O)﹣3E(O﹣H) |
您最近一年使用:0次



