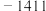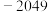解题方法
1 . 醛酮在酸或碱的催化下生成偕二醇的反应历程如下:
下列说法不正确的是
酸催化历程: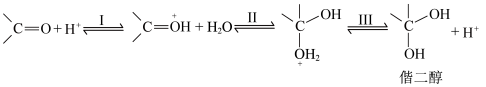
碱催化历程: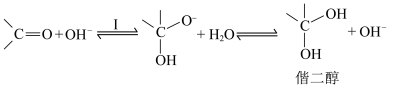
| 羰基化合物 |  |  |  |
| 平衡常数K | 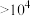 | 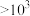 | 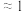 |
A.酸催化历程的步骤I中 与羰基中的O结合,增大了碳氧双键的极性 与羰基中的O结合,增大了碳氧双键的极性 |
B.对比酸和碱的催化历程可知,与羰基反应的活性: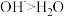 |
C.无论酸或碱催化,生成偕二醇的平衡常数: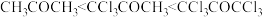 |
D.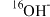 催化下, 催化下,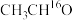 的 的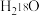 溶液中无法生成 溶液中无法生成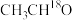 |
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)家用液化气中主要成分之一是丁烷( )。常温常压时,当1g丁烷完全燃烧并生成
)。常温常压时,当1g丁烷完全燃烧并生成 和液态水时,放出热量50kJ。试写出该状态下表示丁烷燃烧热的热化学方程式:
和液态水时,放出热量50kJ。试写出该状态下表示丁烷燃烧热的热化学方程式:________ 。
(2)高炉炼铁基本反应: ,其平衡常数表达式为:
,其平衡常数表达式为:___________ 。
(3)处理含CO、 烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
①
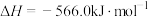
②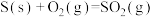

此反应的热化学方程式是___________ 。
(4)CO用于处理大气污染物 的原理为
的原理为
 ,有人提出上述反应可以用“
,有人提出上述反应可以用“ ”作催化剂,其总反应分两步进行:第一步:
”作催化剂,其总反应分两步进行:第一步: ;第二步:
;第二步:___________ (写离子反应方程式)。
(1)家用液化气中主要成分之一是丁烷(
 )。常温常压时,当1g丁烷完全燃烧并生成
)。常温常压时,当1g丁烷完全燃烧并生成 和液态水时,放出热量50kJ。试写出该状态下表示丁烷燃烧热的热化学方程式:
和液态水时,放出热量50kJ。试写出该状态下表示丁烷燃烧热的热化学方程式:(2)高炉炼铁基本反应:
 ,其平衡常数表达式为:
,其平衡常数表达式为:(3)处理含CO、
 烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:①

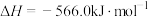
②
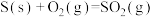

此反应的热化学方程式是
(4)CO用于处理大气污染物
 的原理为
的原理为
 ,有人提出上述反应可以用“
,有人提出上述反应可以用“ ”作催化剂,其总反应分两步进行:第一步:
”作催化剂,其总反应分两步进行:第一步: ;第二步:
;第二步:
您最近一年使用:0次
3 . 下列有关说法不正确 的是
| A.将pH相等的氨水和NaOH溶液均稀释10倍,氨水的pH变化小 |
B.25℃时反应  ,说明25℃时该分解反应速率很慢 ,说明25℃时该分解反应速率很慢 |
C.反应 的平衡常数表达式: 的平衡常数表达式: |
D.25℃,中和等体积、等pH的 溶液和盐酸溶液时,消耗NaOH的物质的量相等 溶液和盐酸溶液时,消耗NaOH的物质的量相等 |
您最近一年使用:0次
名校
4 . 完成下面的题。
(1)已知:常温下,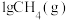 在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:
在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:___________ 。
(2)高炉炼铁基本反应: ,其平衡常数表达式为:
,其平衡常数表达式为:___________ 。
(1)已知:常温下,
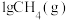 在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:
在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:(2)高炉炼铁基本反应:
 ,其平衡常数表达式为:
,其平衡常数表达式为:
您最近一年使用:0次
5 . 丁烯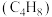 和乙烯
和乙烯 反应制丙烯
反应制丙烯 的方法被称为“烯烃复分解法”:
的方法被称为“烯烃复分解法”: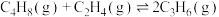
 。向容积为
。向容积为 的恒容密闭容器中按
的恒容密闭容器中按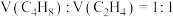 的比例充入两种气体。请回答:
的比例充入两种气体。请回答:
(1)已知各相关物质的燃烧热如下表:
则
______ 。
(2)下列说法中正确的是______(选填序号)。
(3) 时达到平衡状态,容器中
时达到平衡状态,容器中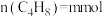 ,
,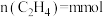 ,
,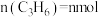 。
。
①平衡常数
______ (用含m、n的式子表示)。
②再往容器内通入等物质的量的 和
和 ,重新达到平衡后
,重新达到平衡后 的体积分数
的体积分数______ (填“增大”“减少”或“不变”)。
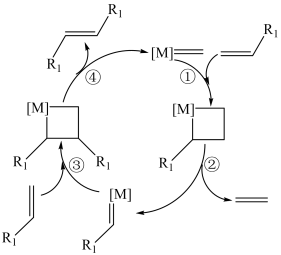
(4)歧化反应的机理如图所示,下列说法正确的是______(选填序号)。
(5)在相同催化剂作用下,温度、空速[体流过催化剂表面的速率 ]对丁烯和乙烯复分解反应平衡的影响如图所示:
]对丁烯和乙烯复分解反应平衡的影响如图所示:
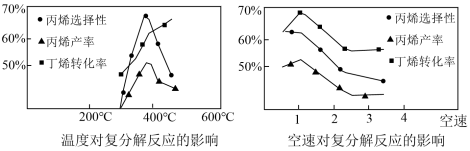
①温度升高,丙烯产率先增大后减少,原因是______ 。
②空速太快,丙烯的产率逐渐减小,原因是______ 。
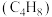 和乙烯
和乙烯 反应制丙烯
反应制丙烯 的方法被称为“烯烃复分解法”:
的方法被称为“烯烃复分解法”: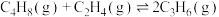
 。向容积为
。向容积为 的恒容密闭容器中按
的恒容密闭容器中按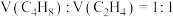 的比例充入两种气体。请回答:
的比例充入两种气体。请回答:(1)已知各相关物质的燃烧热如下表:
物质 | 乙烯 | 丙烯 | 丁烯 |
燃烧热 |
|
|
|

(2)下列说法中正确的是______(选填序号)。
| A.混合气体的平均相对分子质量不再改变,说明反应达到了限度 |
B.因化学方程式前后物质的化学计量数之和相等,所以反应的 等于零 等于零 |
| C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数 |
| D.烯烃歧化反应中,断键吸收的能量大于成键放出的能量 |
 时达到平衡状态,容器中
时达到平衡状态,容器中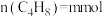 ,
,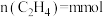 ,
,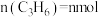 。
。①平衡常数

②再往容器内通入等物质的量的
 和
和 ,重新达到平衡后
,重新达到平衡后 的体积分数
的体积分数(4)歧化反应的机理如图所示,下列说法正确的是______(选填序号)。

| A.反应②为消去反应 |
B.反应可表示为: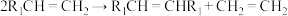 |
C. 为顺式结构 为顺式结构 |
| D.丙烯与丁烯发生反应,可生成3种新烯烃 |
 ]对丁烯和乙烯复分解反应平衡的影响如图所示:
]对丁烯和乙烯复分解反应平衡的影响如图所示:
①温度升高,丙烯产率先增大后减少,原因是
②空速太快,丙烯的产率逐渐减小,原因是
您最近一年使用:0次
2023-05-27更新
|
95次组卷
|
2卷引用:浙江省部分校2022-2023学年高二下学期5月份联考化学试题
6 . 对苯二甲酸(TPA)是生产聚酯的主要原料。实验中,将初始浓度为0.08mol/L对甲基苯甲酸(p-TA)放入反应器中(用醋酸作为溶剂),在Co-Mn-Br的复合催化剂作用下进行反应,反应温度为186℃,反应过程中有充足的氧气供应,对甲基苯甲酸(p-TA)按照如下的路径发生反应:
 且有
且有
已知对甲基苯甲酸(p-TA)氧化的活化能比对醛基苯甲酸(4-CBA)氧化的活化能大得多。反应10min后,取样分析,对甲基苯甲酸(p-TA)和对醛基苯甲酸(4-CBA)含量基本为零。请回答:
(1)下列说法正确的是___________
(2)画出上述过程中p-TA制备TPA的物质相对能量-反应过程的示意图_________

(3)某研究小组进行了186℃下p-TA液相氧化反应并绘制了各物质浓度随时间的变化图像。
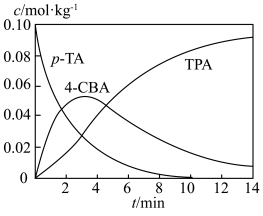
Ⅰ.已知图像中4-CBA的曲线有误,请说明错误的理由:___________ 。
Ⅱ.已知有两种溶剂a与b,p-TA、4-CBA和TPA在其中的溶解情况如下表所示,现欲收集反应的中间产物,选择溶剂___________ (填“a”或“b”)
(4)已知原料对甲基苯甲酸(p-TA)可通过对二甲苯(PX)制取,PX液相氧化遵循自由基机理,部分反应历程如下所示,下列说法正确的是___________
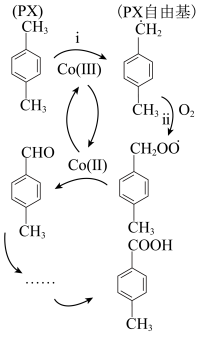
 且有
且有
已知对甲基苯甲酸(p-TA)氧化的活化能比对醛基苯甲酸(4-CBA)氧化的活化能大得多。反应10min后,取样分析,对甲基苯甲酸(p-TA)和对醛基苯甲酸(4-CBA)含量基本为零。请回答:
(1)下列说法正确的是___________
A.反应Ⅰ 的平衡常数表达式 的平衡常数表达式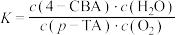 |
| B.CO-Mn-Br催化剂能改变反应历程 |
| C.相同条件下温度升高,反应Ⅰ的速率减慢,反应Ⅱ的速率加快 |
D.升高温度,副产物 的含量会增大 的含量会增大 |

(3)某研究小组进行了186℃下p-TA液相氧化反应并绘制了各物质浓度随时间的变化图像。

Ⅰ.已知图像中4-CBA的曲线有误,请说明错误的理由:
Ⅱ.已知有两种溶剂a与b,p-TA、4-CBA和TPA在其中的溶解情况如下表所示,现欲收集反应的中间产物,选择溶剂
| 溶解度 | 反应物质 | |||
| p-TA | 4-CBA | TPA | ||
| 溶剂 | a | 可溶 | 易溶 | 可溶 |
| b | 易溶 | 难溶 | 可溶 | |

A.Co(Ⅲ)使苯环上甲基的C-H键断裂生成PX自由基和 |
| B.该反应中Co(Ⅲ)作为催化剂 |
| C.PX自由基在反应ⅱ中发生还原反应 |
| D.该历程中原料的原子利用率达到100% |
您最近一年使用:0次
名校
7 . CO在工业生产中具有重要作用。
(1)CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
已知△G=△H-T△S,反应CO(g)+2H2(g) CH3OH(g)的△G随温度的变化是图1中的
CH3OH(g)的△G随温度的变化是图1中的____ (填“L1”或“L2”)。

(2)已知在催化剂M作用下,NO2(g)+CO(g) CO2(g)+NO(g) △H<0。
CO2(g)+NO(g) △H<0。
①一定温度下,假设正逆反应速率与浓度关系为v正=k1c(NO2)•c(CO),v逆=k2c(CO2)•c(NO),k1、k2只与温度相关,则反应的平衡常数K=____ (用含k1、k2的式子表示)。
②催化剂M活性随温度变化情况如图2所示,相同时间测得NO2的转化率随反应温度变化情况如图3所示,写出T0后NO2的转化率出现如图变化的可能原因_____ 。

③在图3中画出并标注,其他条件不变,增大压强(催化剂不失活)情况下,NO2的转化率随温度变化图_____ 。
(1)CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-12CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1已知△G=△H-T△S,反应CO(g)+2H2(g)
 CH3OH(g)的△G随温度的变化是图1中的
CH3OH(g)的△G随温度的变化是图1中的
(2)已知在催化剂M作用下,NO2(g)+CO(g)
 CO2(g)+NO(g) △H<0。
CO2(g)+NO(g) △H<0。①一定温度下,假设正逆反应速率与浓度关系为v正=k1c(NO2)•c(CO),v逆=k2c(CO2)•c(NO),k1、k2只与温度相关,则反应的平衡常数K=
②催化剂M活性随温度变化情况如图2所示,相同时间测得NO2的转化率随反应温度变化情况如图3所示,写出T0后NO2的转化率出现如图变化的可能原因

③在图3中画出并标注,其他条件不变,增大压强(催化剂不失活)情况下,NO2的转化率随温度变化图
您最近一年使用:0次
2022-09-27更新
|
288次组卷
|
2卷引用:浙江省杭州学军中学2022-2023学年高二上学期期中考试 化学试题
名校
8 .  和
和 是工业排放的对环境产生影响的废气,充分利用(例如合成尿素)既可以降低成本,也可以减少对环境的污染。
是工业排放的对环境产生影响的废气,充分利用(例如合成尿素)既可以降低成本,也可以减少对环境的污染。
(1)以 与
与 为原料合成化肥尿素的主要反应如下:
为原料合成化肥尿素的主要反应如下:
①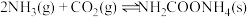 ;
;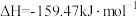
②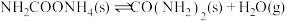 ;
;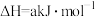
③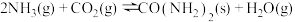 ;
;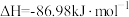 。
。
则a为_______
(2)写出反应②的平衡常数的表达式K=_______ 。
(3)下列说法正确的是_______
(4)在一个初始体积为VL的恒温恒压的容器中,起始充入14mol 和13mol
和13mol ,发生反应③,经过20min后,氨气的转化率达到50%,则用尿素来表示这个反应在20min内的平均反应速率为
,发生反应③,经过20min后,氨气的转化率达到50%,则用尿素来表示这个反应在20min内的平均反应速率为_______ mol/min。并将0-30min内体系内气体的密度随时间的变化趋势画在下图中。________

 和
和 是工业排放的对环境产生影响的废气,充分利用(例如合成尿素)既可以降低成本,也可以减少对环境的污染。
是工业排放的对环境产生影响的废气,充分利用(例如合成尿素)既可以降低成本,也可以减少对环境的污染。(1)以
 与
与 为原料合成化肥尿素的主要反应如下:
为原料合成化肥尿素的主要反应如下:①
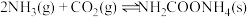 ;
;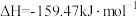
②
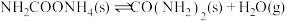 ;
;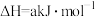
③
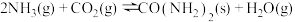 ;
;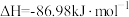 。
。则a为
(2)写出反应②的平衡常数的表达式K=
(3)下列说法正确的是_______
| A.某恒温恒容的容器中仅发生反应①,若混合气体平均相对分子质量保持不变,说明反应达到了平衡 |
B.某恒温恒压的容器中仅发生反应②,达到平衡后,充入少量He,继续反应足够时间,则 会被完全反应 会被完全反应 |
C.对于反应③,反应开始后的一段时间内,适当升温可提高单位时间内 的转化率 的转化率 |
D.对于反应③,在容器中加入CaO,(可与 反应),提高 反应),提高 产率 产率 |
 和13mol
和13mol ,发生反应③,经过20min后,氨气的转化率达到50%,则用尿素来表示这个反应在20min内的平均反应速率为
,发生反应③,经过20min后,氨气的转化率达到50%,则用尿素来表示这个反应在20min内的平均反应速率为
您最近一年使用:0次
名校
9 . 在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应:mA+nB pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
下列说法一定正确的是
 pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:| 压强p/Pa | 2×105 | 5×105 | 1×106 | 3×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.40 | 0.80 |
| A.保持一定温度,增大压强,平衡正向移动 |
B.当压强为3×106Pa时,此反应的平衡常数表达式:Kp=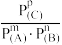 |
| C.反应平衡后若增大压强,则新平衡的逆反应速率大于原平衡的逆反应速率 |
| D.若再向体系中加入bmolB,当重新达到平衡时,体系中A、B、C总物质的量为(4+b)mol |
您最近一年使用:0次
2022-05-11更新
|
528次组卷
|
4卷引用:浙江省温州市普通高中2022届高三适应性测试三模考试化学试题
解题方法
10 . 我国承诺在2030年前实现碳达峰即二氧化碳的排放量不再增长。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。回答下列问题:
(1)25℃时,大气中的 溶于雨水中,进一步和水反应并发生电离:
溶于雨水中,进一步和水反应并发生电离:


 。
。
① 的焓变
的焓变
___________ 0(填“ ”“
”“ ”或“
”或“ ”)
”)
②平衡常数为 的表达式为
的表达式为___________ 。
③溶液中 的浓度与空气中的
的浓度与空气中的 分压成正比(分压=总压×物质的量分数),比例系数为y
分压成正比(分压=总压×物质的量分数),比例系数为y ,当大气压强为pkPa,大气中
,当大气压强为pkPa,大气中 的物质的量分数为x时,溶液中
的物质的量分数为x时,溶液中 浓度为
浓度为___________  (写出表达式,忽略水的电离和
(写出表达式,忽略水的电离和 的电离)
的电离)
(2)二氧化碳加氢制甲醇的总反应可表示为:



该反应一般认为通过如下步骤来实现:
反应I:


反应II:

若反应I为决速步反应,画出反应过程中的体系能量变化图____________ 。

(3)在密闭恒温容器中通入1mol 和3mol
和3mol ,发生下述两个反应。
,发生下述两个反应。
反应I:


反应II:


①测得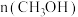 随时间变化如下图甲所示:
随时间变化如下图甲所示:

下列叙述正确的是___________ 。
A.反应I的活化能大于反应II
B.反应达平衡后,若压缩容积,反应II平衡不移
C.选择合适的催化剂可以提高甲醇生成的产率
D.若在 适当升高温度,产物中CO的比例会升高
适当升高温度,产物中CO的比例会升高
②测得 的平衡转化率随温度变化关系如图乙所示,请解释:
的平衡转化率随温度变化关系如图乙所示,请解释: 的平衡转化率随温度变化先下降后升高的原因
的平衡转化率随温度变化先下降后升高的原因___________ 。

(1)25℃时,大气中的
 溶于雨水中,进一步和水反应并发生电离:
溶于雨水中,进一步和水反应并发生电离:

 。
。①
 的焓变
的焓变
 ”“
”“ ”或“
”或“ ”)
”)②平衡常数为
 的表达式为
的表达式为③溶液中
 的浓度与空气中的
的浓度与空气中的 分压成正比(分压=总压×物质的量分数),比例系数为y
分压成正比(分压=总压×物质的量分数),比例系数为y ,当大气压强为pkPa,大气中
,当大气压强为pkPa,大气中 的物质的量分数为x时,溶液中
的物质的量分数为x时,溶液中 浓度为
浓度为 (写出表达式,忽略水的电离和
(写出表达式,忽略水的电离和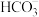 的电离)
的电离)(2)二氧化碳加氢制甲醇的总反应可表示为:



该反应一般认为通过如下步骤来实现:
反应I:



反应II:


若反应I为决速步反应,画出反应过程中的体系能量变化图

(3)在密闭恒温容器中通入1mol
 和3mol
和3mol ,发生下述两个反应。
,发生下述两个反应。反应I:



反应II:



①测得
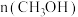 随时间变化如下图甲所示:
随时间变化如下图甲所示:
下列叙述正确的是
A.反应I的活化能大于反应II
B.反应达平衡后,若压缩容积,反应II平衡不移
C.选择合适的催化剂可以提高甲醇生成的产率
D.若在
 适当升高温度,产物中CO的比例会升高
适当升高温度,产物中CO的比例会升高②测得
 的平衡转化率随温度变化关系如图乙所示,请解释:
的平衡转化率随温度变化关系如图乙所示,请解释: 的平衡转化率随温度变化先下降后升高的原因
的平衡转化率随温度变化先下降后升高的原因
您最近一年使用:0次
2022-02-22更新
|
164次组卷
|
2卷引用:浙江省浙南名校联考2021-2022学年下学期高三返校联考化学试题