SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
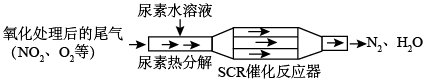
尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________ 。
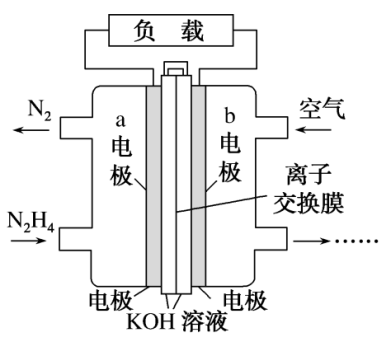
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为___________ ;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的___________ 极(填“正”或“负”),a电极的电极反应式为___________ 。
(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=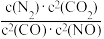 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___________ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol∙L-1∙min-1。
(1)SCR(选择性催化还原)工作原理:

尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为

(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=
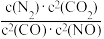 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=
更新时间:2021-11-19 20:32:27
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题。
(1)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。
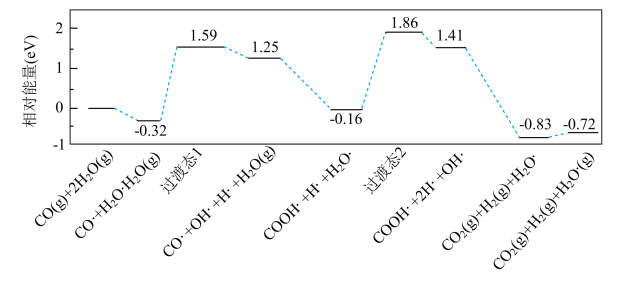
可知水煤气变换的ΔH___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式:___________ 。
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应。已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则2N2(g)+6H2O(l)
2NH3(g) ΔH=-92.4 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=
4NH3(g)+3O2(g) ΔH=___________ 。
(3)已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)=C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用___________ 反应的ΔH。
(4)饮用水中的NO 主要来自于NH
主要来自于NH 。已知在微生物的作用下,NH
。已知在微生物的作用下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
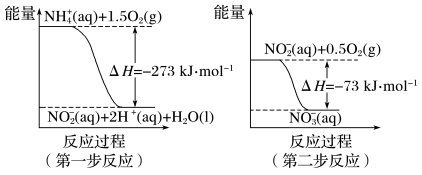
1 mol NH 全部被氧化成NO
全部被氧化成NO 的热化学方程式为
的热化学方程式为___________ 。
(5)大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为___________ 。
(1)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。

可知水煤气变换的ΔH
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应。已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则2N2(g)+6H2O(l)
2NH3(g) ΔH=-92.4 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=
4NH3(g)+3O2(g) ΔH=(3)已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)=C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用
(4)饮用水中的NO
 主要来自于NH
主要来自于NH 。已知在微生物的作用下,NH
。已知在微生物的作用下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
1 mol NH
 全部被氧化成NO
全部被氧化成NO 的热化学方程式为
的热化学方程式为(5)大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热ΔH/(kJ·mol-1) | -285.8 | -393.5 | -3267.5 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
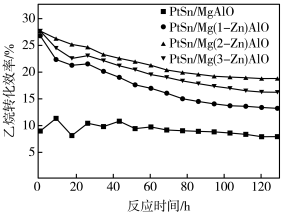
【推荐2】开发新型高效的乙烷脱氢制乙烯过程对于石油化工至关重要。回答下列问题:
(1)不同Zn含量PtSn催化剂催化乙烷脱氢反应
 时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为
时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为____________ 。
(2)随着温度升高,乙烷脱氢反应容易造成催化剂表面积碳,影响催化剂的稳定性,脱氢时通常一起充入CO2,该工艺称为“乙烷二氧化碳氧化脱氢反应”,CO2发生的反应为:
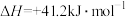 、
、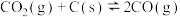
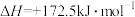 。则CO2的作用为
。则CO2的作用为____________ 、____________ 。
(3)实验室模拟“乙烷二氧化碳氧化脱氢反应”, ℃时,将2.8mol
℃时,将2.8mol 与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应:
与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应: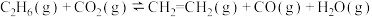
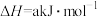 ,平衡时,
,平衡时,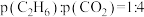 。
。
①a=______ 。
②T℃时,该反应的平衡常数K=______ 。
③若不考虑副反应,对于该反应体系,下列说法正确的是______ (填标号)。
a.三种生成物平衡分压比值保持不变时,反应达到平衡状态
b.降低C2H6与CO2用料比,C2H6的平衡转化率升高
c.在容器中加入CaO,可与H2O反应,提高CH2=CH2产率
d.反应开始后的一段时间内,适当缩小容器体积可提高单位时间内C2H6的转化率
(4)中国科学院科研团队,利用固体氧化物电解池(Solid oxide electrolysis cell,SOEC),在SOEC阳极实现了高选择性乙烷电化学脱氢制乙烯。装置示意图如下。
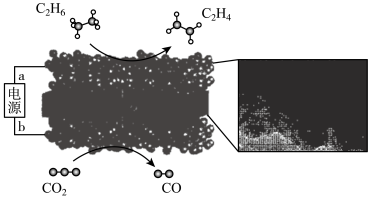
①b为电源的______ 极。
②阳极电极反应为__________________ 。
(1)不同Zn含量PtSn催化剂催化乙烷脱氢反应
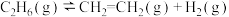
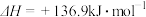 时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为
时,乙烷的转化效率随时间变化如下图所示。由图可知,催化活性最优的催化剂为
(2)随着温度升高,乙烷脱氢反应容易造成催化剂表面积碳,影响催化剂的稳定性,脱氢时通常一起充入CO2,该工艺称为“乙烷二氧化碳氧化脱氢反应”,CO2发生的反应为:

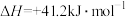 、
、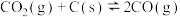
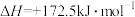 。则CO2的作用为
。则CO2的作用为(3)实验室模拟“乙烷二氧化碳氧化脱氢反应”,
 ℃时,将2.8mol
℃时,将2.8mol 与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应:
与5.2mol CO2充入容积恒定为0.5L的恒温密闭容器中发生反应: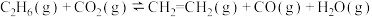
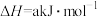 ,平衡时,
,平衡时,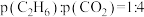 。
。①a=
②T℃时,该反应的平衡常数K=
③若不考虑副反应,对于该反应体系,下列说法正确的是
a.三种生成物平衡分压比值保持不变时,反应达到平衡状态
b.降低C2H6与CO2用料比,C2H6的平衡转化率升高
c.在容器中加入CaO,可与H2O反应,提高CH2=CH2产率
d.反应开始后的一段时间内,适当缩小容器体积可提高单位时间内C2H6的转化率
(4)中国科学院科研团队,利用固体氧化物电解池(Solid oxide electrolysis cell,SOEC),在SOEC阳极实现了高选择性乙烷电化学脱氢制乙烯。装置示意图如下。

①b为电源的
②阳极电极反应为
您最近一年使用:0次
【推荐3】煤经过气化可达到“节能减排”的目的。在一定温度范围内,煤的气化发生的主要反应如下:
I.
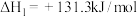
II.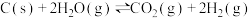

III.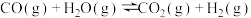

(1)
_______ 
(2)煤的综合利用除气化外,还有_______ (写出1点即可)。
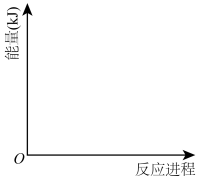
(3)用过渡理论或简单碰撞理论画出反应III反应过程中的能量变化示意图______ 。
(4)将一定量的 和
和 的混合气体充入一绝热恒容密闭容器中发生反应III,下列说法能说明反应达到平衡的是_______(填选项字母)。
的混合气体充入一绝热恒容密闭容器中发生反应III,下列说法能说明反应达到平衡的是_______(填选项字母)。
(5)将一定量的碳(足量)和 充入一恒容密闭容器中进行反应,假设
充入一恒容密闭容器中进行反应,假设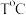 时
时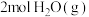 在该容器中产生的压强为
在该容器中产生的压强为 。达平衡时,
。达平衡时, 的转化率和容器中混合气体的平均相对分子质量随温度变化如下图。
的转化率和容器中混合气体的平均相对分子质量随温度变化如下图。
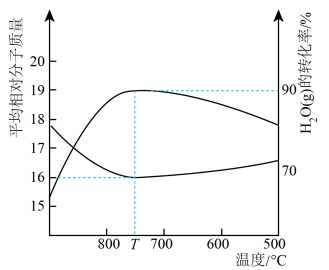
① 后,平衡时混合气体平均相对分子质量变化很小的原因是
后,平衡时混合气体平均相对分子质量变化很小的原因是_______ 。
②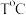 时,假设体系中只发生反应I和II,反应I的平衡常数
时,假设体系中只发生反应I和II,反应I的平衡常数
_______ (用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
I.

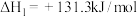
II.
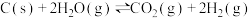

III.
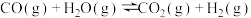

(1)


(2)煤的综合利用除气化外,还有
(3)用过渡理论或简单碰撞理论画出反应III反应过程中的能量变化示意图

(4)将一定量的
 和
和 的混合气体充入一绝热恒容密闭容器中发生反应III,下列说法能说明反应达到平衡的是_______(填选项字母)。
的混合气体充入一绝热恒容密闭容器中发生反应III,下列说法能说明反应达到平衡的是_______(填选项字母)。| A.容器内温度不变 |
| B.容器内压强不变 |
| C.混合气体密度不变 |
| D.混合气体平均相对分子质量不变 |
 充入一恒容密闭容器中进行反应,假设
充入一恒容密闭容器中进行反应,假设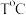 时
时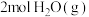 在该容器中产生的压强为
在该容器中产生的压强为 。达平衡时,
。达平衡时, 的转化率和容器中混合气体的平均相对分子质量随温度变化如下图。
的转化率和容器中混合气体的平均相对分子质量随温度变化如下图。
①
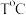 后,平衡时混合气体平均相对分子质量变化很小的原因是
后,平衡时混合气体平均相对分子质量变化很小的原因是②
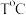 时,假设体系中只发生反应I和II,反应I的平衡常数
时,假设体系中只发生反应I和II,反应I的平衡常数
 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
【推荐1】I.下表中的数据是破坏1mol物质中的化学键所消耗的能量:
根据上述数据回答下列问题:
(1)下列氢化物中最稳定的是_______ (填字母代号)。
A. HCl B. HBr C. HI
(2)按照反应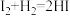 ,生成2mol HI
,生成2mol HI _______ (填“吸收”或“放出”)的热量为_______ kJ。
II.将等物质的卧的A、B混合于2L的密闭容器中,发生反应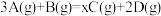 ,经5min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(L·min)。求:
,经5min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)A或B起始的物质的量是_______ 。
(2)5min内用B表示的该反应的平均反应速率是_______ 。
(3)x的值是_______
III.某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_______ ;
(2)从开始至2min,B的平均反应速率为_______ ;平衡时,C的物质的量为_______ ;
(3)下列叙述能说明该反应已达到化学平衡状态的_______ (填序号);
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗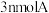 ,同时消耗
,同时消耗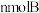
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是_______ (填序号)。
A.加催化剂 B.降低温度
C.容积不变,充入A D.容积不变,从容器中分离出A
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列氢化物中最稳定的是
A. HCl B. HBr C. HI
(2)按照反应
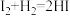 ,生成2mol HI
,生成2mol HI II.将等物质的卧的A、B混合于2L的密闭容器中,发生反应
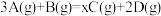 ,经5min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(L·min)。求:
,经5min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(L·min)。求:(1)A或B起始的物质的量是
(2)5min内用B表示的该反应的平均反应速率是
(3)x的值是
III.某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为
(2)从开始至2min,B的平均反应速率为
(3)下列叙述能说明该反应已达到化学平衡状态的
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗
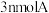 ,同时消耗
,同时消耗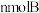
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是
A.加催化剂 B.降低温度
C.容积不变,充入A D.容积不变,从容器中分离出A
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】碘及其化合物在生产生活中有重要作用。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为2:1的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)=2HI(g),反应经过5分钟测得碘化氢的浓度为0.1mol·L-1,碘蒸气的浓度为0.05mol·L-1。
①前5分钟平均反应速率v(H2)=____ ,H2的初始浓度是____ 。
②下列能说明反应已达平衡状态的是____ (填序号)。
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的H-H键数目与断裂的H-I键数目相等
c.c(H2):c(I2):c(HI)=1:1:2
d.2v(I2)正=v(HI)逆
e.反应混合体系的颜色不再发生变化
(2)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01mol·L-1的H2O2、H2SO4、HI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O
+2H2O
反应分两步进行:
反应A:……
反应B:I2+2S2O =2I-+S4O
=2I-+S4O
①反应A的离子方程式是___ 。对于总反应,I-的作用是____
②为探究溶液变蓝快慢的影响因素,进行实验I、II(溶液浓度均为0.01mol·L-1)。
溶液从混合时的无色变为蓝色的时间:实验I是30min、实验II是40min。实验II中,x、y、z所对成的数值分别是____ ;对比实验I、II,可得出的实验结论是____ 。
(3)为探究其他因素对该“碘钟实验”的影响,进行实验III和IV。(溶液浓度均为0.01mol/L)
①实验III过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及两步反应速率的相对快慢关系,解释实验Ⅲ未产生颜色变化的原因:____ 。
②实验IV过程中,溶液最终显蓝色且不褪色。
结合“碘钟实验”总反应方程式及两步反应,试着根据试剂用量解释实验IV溶液终显蓝色且不褪色的原因:____ 。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为2:1的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)=2HI(g),反应经过5分钟测得碘化氢的浓度为0.1mol·L-1,碘蒸气的浓度为0.05mol·L-1。
①前5分钟平均反应速率v(H2)=
②下列能说明反应已达平衡状态的是
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的H-H键数目与断裂的H-I键数目相等
c.c(H2):c(I2):c(HI)=1:1:2
d.2v(I2)正=v(HI)逆
e.反应混合体系的颜色不再发生变化
(2)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01mol·L-1的H2O2、H2SO4、HI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O
+2H2O反应分两步进行:
反应A:……
反应B:I2+2S2O
 =2I-+S4O
=2I-+S4O
①反应A的离子方程式是
②为探究溶液变蓝快慢的影响因素,进行实验I、II(溶液浓度均为0.01mol·L-1)。
| 试剂 用量(mL) 序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验I | 5 | 4 | 8 | 3 | 0 |
| 实验II | 5 | 2 | x | y | z |
(3)为探究其他因素对该“碘钟实验”的影响,进行实验III和IV。(溶液浓度均为0.01mol/L)
| 试剂 用量(mL) 序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验III | 4 | 4 | 9 | 3 | 0 |
| 实验IV | 9 | 4 | 4 | 3 | 0 |
试结合该“碘钟实验”总反应方程式及两步反应速率的相对快慢关系,解释实验Ⅲ未产生颜色变化的原因:
②实验IV过程中,溶液最终显蓝色且不褪色。
结合“碘钟实验”总反应方程式及两步反应,试着根据试剂用量解释实验IV溶液终显蓝色且不褪色的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题
(1)实验室用30%左右的硫酸溶液(约3.7 mol/L)与锌粒反应制取氢气。下列措施中能加快反应速率的是_______。
(2)目前工业上可用 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为: 。现向体积为1 L的密闭容器中,充入l mol
。现向体积为1 L的密闭容器中,充入l mol  和3 mol
和3 mol  ,反应过程中测得
,反应过程中测得 和
和 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。
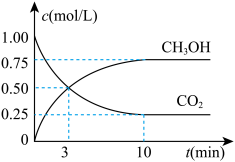
①计算3 min内用氢气表示的该反应的反应速率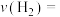
_______ ;3 min时,正反应速率_______ 逆反应速率(填“>”“=”或“<”)。
②10 min反应达平衡,氢气的转化率为_______ 。当反应达平衡后,维持温度和压强不变,改变其它条件使反应速率增大,采取的措施_______ (写一条即可)
(3)电池的发明和应用是化学家们对人类社会的重要贡献之一。每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲烷燃料电池的相关技术上获得了新突破,原理如下图所示。
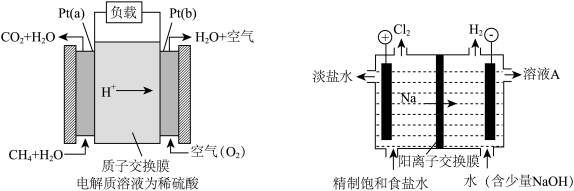
①甲烷进口为_______ 极(左图),Pt(b)电极发生_______ 反应(填“氧化”或“还原”)。
②以石墨做电极电解饱和食盐水(滴有酚酞),如图所示。电解开始后在_______ 的周围(填“阴极”或“阳极”)先出现红色。该极的电极反应式为_______ 。
(1)实验室用30%左右的硫酸溶液(约3.7 mol/L)与锌粒反应制取氢气。下列措施中能加快反应速率的是_______。
| A.降低反应温度 | B.将锌粒改为锌粉 |
| C.将所用硫酸加水稀释 | D.加入少量的硫酸铜溶液 |
 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为: 。现向体积为1 L的密闭容器中,充入l mol
。现向体积为1 L的密闭容器中,充入l mol  和3 mol
和3 mol  ,反应过程中测得
,反应过程中测得 和
和 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。
①计算3 min内用氢气表示的该反应的反应速率
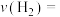
②10 min反应达平衡,氢气的转化率为
(3)电池的发明和应用是化学家们对人类社会的重要贡献之一。每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲烷燃料电池的相关技术上获得了新突破,原理如下图所示。

①甲烷进口为
②以石墨做电极电解饱和食盐水(滴有酚酞),如图所示。电解开始后在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____ kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____ 。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____ 。
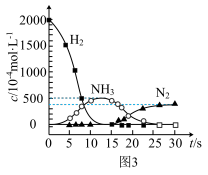
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。
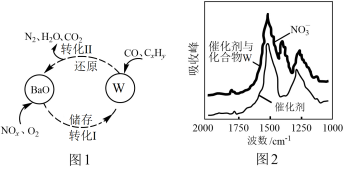
①在图1所示转化中,W的化学式为____ 。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____ 。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____ 。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____ 。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)
 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。


①在图1所示转化中,W的化学式为
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:
您最近一年使用:0次
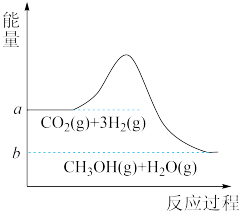
【推荐2】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:在容器为1L的密闭容器中充入1molCO2和3molH2,平衡时CO2的物质的量为0.25mol,CO2(g)+3H2(g) CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
请回答下列问题:
(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量______ (填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:__________ 。甲醇分子中的化学键类型是________ (填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是__________ ,发生的是__________ (填"氧化"或"还原")反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:___________________
(5)平衡时H2的转化率为__________ 平衡时混合气体中CH3OH(g)的体积分数为__________ 。
(6)下列事实能表明该反应已达平衡状态的是( ) (填序号)
A.CO2(g)的浓度不再发生变化
B.单位时间内消耗1mol CO2的同时生成3mol H2
C.在一个绝热的容器中,混合物的温度不再发生变化
D.在一个容积固定的容器内,压强不再发生变化
 CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
请回答下列问题:
(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:
(5)平衡时H2的转化率为
(6)下列事实能表明该反应已达平衡状态的是
A.CO2(g)的浓度不再发生变化
B.单位时间内消耗1mol CO2的同时生成3mol H2
C.在一个绝热的容器中,混合物的温度不再发生变化
D.在一个容积固定的容器内,压强不再发生变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】合成氨是人类科学技术上的一项重大突破。
合成氨的反应原理为: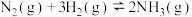 ,合成氨的简易流程图如下:
,合成氨的简易流程图如下:

(1)步骤I:天然气中的杂质H2S常用氨水吸收。
步骤Ⅱ:制氢气的原理如下:
反应1: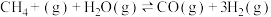
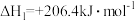
反应2: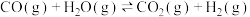
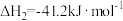
对于反应1,一定可以提高平衡体系中H2百分含量同时能加快反应速率的措施是___________。
(2)对于反应 ,在一定条件下氨的平衡含量如表。
,在一定条件下氨的平衡含量如表。
①该反应为___________ (填“吸热”或“放热”)反应。
②工业合成氨选用的条件是550℃、10 MPa,而非200℃、10 MPa,原因是________ 。
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
①工业合成氨反应的平衡常数表达式为K=___________ 。
②投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,计算该温度下合成氨反应的平衡常数K=___________ 。
③按投料II进行反应,起始时反应进行的方向为___________ (填“正向”或“逆向”)。
(4)实际生产中,常用工艺条件: 作催化剂,控制温度773 K,压强
作催化剂,控制温度773 K,压强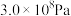 ,原料气中N2和H2物质的量之比为1:2.8,在
,原料气中N2和H2物质的量之比为1:2.8,在 催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
①分析说明原料气中 过量的理由
过量的理由___________ 。
②步骤III-IV合成氨: ,有关合成氨工艺说法正确的是
,有关合成氨工艺说法正确的是___________ 。
A.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
B.步骤III:分离空气可得N2,通过天然气和水蒸气转化可得H2,然后将所得原料气直接混合,经加压、热交换后制得合成氨
C.步骤IV:热交换过程中控制反应的温度为(773 K),远高于室温,是为了保证尽可提高平衡转化率和加快反应速率
D.步骤V基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
合成氨的反应原理为:
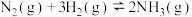 ,合成氨的简易流程图如下:
,合成氨的简易流程图如下:
(1)步骤I:天然气中的杂质H2S常用氨水吸收。
步骤Ⅱ:制氢气的原理如下:
反应1:
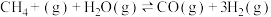
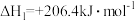
反应2:
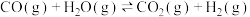
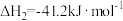
对于反应1,一定可以提高平衡体系中H2百分含量同时能加快反应速率的措施是___________。
| A.升高温度 | B.增大水蒸气的浓度 |
| C.加入合适催化剂 | D.增加压强 |
 ,在一定条件下氨的平衡含量如表。
,在一定条件下氨的平衡含量如表。| 温度/℃ | 压强/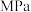 | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②工业合成氨选用的条件是550℃、10 MPa,而非200℃、10 MPa,原因是
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
单位: |  |  |  |
| 投料I | 1.0 | 3.0 | 0 |
| 投料II | 0.5 | 1.5 | 1.0 |
②投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,计算该温度下合成氨反应的平衡常数K=
③按投料II进行反应,起始时反应进行的方向为
(4)实际生产中,常用工艺条件:
 作催化剂,控制温度773 K,压强
作催化剂,控制温度773 K,压强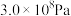 ,原料气中N2和H2物质的量之比为1:2.8,在
,原料气中N2和H2物质的量之比为1:2.8,在 催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
催化剂作用下的反应历程为(*表示吸附态)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。| 化学吸附 | → | 表面反应 | → | 脱附 |
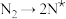 | 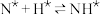 |  | ||
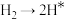 | 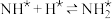 | |||
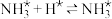 |
 过量的理由
过量的理由②步骤III-IV合成氨:
 ,有关合成氨工艺说法正确的是
,有关合成氨工艺说法正确的是A.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
B.步骤III:分离空气可得N2,通过天然气和水蒸气转化可得H2,然后将所得原料气直接混合,经加压、热交换后制得合成氨
C.步骤IV:热交换过程中控制反应的温度为(773 K),远高于室温,是为了保证尽可提高平衡转化率和加快反应速率
D.步骤V基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
您最近一年使用:0次
【推荐1】甲烷和水蒸气催化制氢主要有如下两个反应:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41 kJ·mol-1
CO2(g)+H2(g) ΔH=-41 kJ·mol-1
恒定压强为100 kPa时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如下图所示。

回答下列问题:
(1)写出CH4与CO2生成H2和CO的热化学方程式:_______ 。
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是_______ (填标号)。
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
(3)系统中H2的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
①低于700℃,_______ ;
②高于700℃,_______ 。
(4)反应①的平衡常数的表达式Kp=_______ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)利用微生物燃料电池处理某废水的工作原理如图所示。
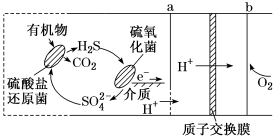
该电池a电极反应式为_______ 。
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41 kJ·mol-1
CO2(g)+H2(g) ΔH=-41 kJ·mol-1恒定压强为100 kPa时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如下图所示。

回答下列问题:
(1)写出CH4与CO2生成H2和CO的热化学方程式:
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
(3)系统中H2的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
①低于700℃,
②高于700℃,
(4)反应①的平衡常数的表达式Kp=
(5)利用微生物燃料电池处理某废水的工作原理如图所示。

该电池a电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】微型纽扣电池在现代生活中有广泛应用。下图是一种银锌电池,其电极分别是 和Zn,电解质溶液为KOH溶液。总反应为
和Zn,电解质溶液为KOH溶液。总反应为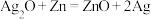 ,其中一个电极反应为
,其中一个电极反应为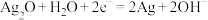 。
。___________ 。
(2)写出另一电极的电极反应式___________ 。
(3)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?___________ (增大、减小、不变)。
(4)当电池工作时通过电路对外提供了1mol电子,计算消耗的负极的质量___________ 。
(5)利用下列反应: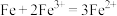 ,选择适当的材料和试剂设计一个原电池。
,选择适当的材料和试剂设计一个原电池。
①请在答卷上的原电池示意图中,标出电极名称、电极材料和电解质溶液。___________ ___________ 。
③电解质溶液中,阳离子向___________ 极移动。
 和Zn,电解质溶液为KOH溶液。总反应为
和Zn,电解质溶液为KOH溶液。总反应为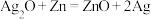 ,其中一个电极反应为
,其中一个电极反应为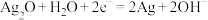 。
。
(2)写出另一电极的电极反应式
(3)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?
(4)当电池工作时通过电路对外提供了1mol电子,计算消耗的负极的质量
(5)利用下列反应:
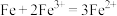 ,选择适当的材料和试剂设计一个原电池。
,选择适当的材料和试剂设计一个原电池。①请在答卷上的原电池示意图中,标出电极名称、电极材料和电解质溶液。
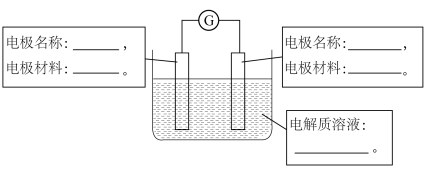
③电解质溶液中,阳离子向
您最近一年使用:0次
【推荐3】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(一)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol,CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8 kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol,
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=_____ 。
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=______ 。2min内CO2平均消耗速率为________ 。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
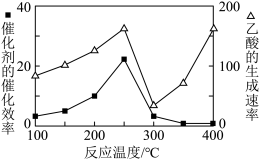
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的原因是_________ 。
②为了提高该反应中CH4的转化率,可能采取的措施是__________________ 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为_____________________ 。
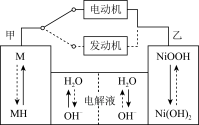
(3)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供动力,降低油耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH溶液)为电解质溶液。镍氢电池充放电原理示意图如下,其总反应式为H2+2NiOOH Ni(OH)2。
Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时,该电池处于________ (选填“充电”或“放电”),乙电极的电极反应式为_________ 。
(一)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol,CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8 kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol,
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的原因是

②为了提高该反应中CH4的转化率,可能采取的措施是
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为
(3)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供动力,降低油耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH溶液)为电解质溶液。镍氢电池充放电原理示意图如下,其总反应式为H2+2NiOOH
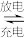 Ni(OH)2。
Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时,该电池处于
您最近一年使用:0次



