名校
1 . 丙烯是石油化工的基本原料之一,在精细化学品合成、环保、医学科学和基础研究等领域应用广泛。回答下列问题:
(1)丙烷脱氢制丙烯过程的主反应为:
反应①:
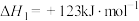 。
。
副反应有:
反应②:
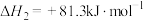
反应③: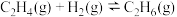
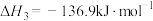
反应④: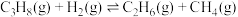

则
___________  。
。
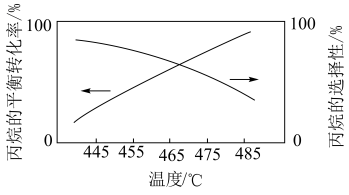
(2)已知:在纤维状BPO4/SiO2催化剂作用下,丙烷在一定温度下会发生(1)中反应①和反应②。丙烷的平衡转化率和丙烯的选择性随温度的变化如图所示,随着温度升高,丙烯的选择性降低的可能原因有___________ (答一条即可);丙烷的平衡转化率增大的原因是___________ 。 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,发生反应
,发生反应 ,经过
,经过 达到平衡状态,测得平衡时气体压强是开始时的1.2倍。
达到平衡状态,测得平衡时气体压强是开始时的1.2倍。
①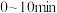 内丙烯的平均反应速率
内丙烯的平均反应速率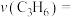
___________  。
。
②保持其他条件不变,反应达平衡后再向容器中充入少量 ,则
,则 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。
③已知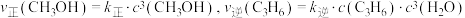 ,其中
,其中 、
、 为速率常数,只与温度有关,则
为速率常数,只与温度有关,则 时,
时,
___________ (结果保留两位有效数字)。
(4)在 、压强恒定为
、压强恒定为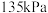 时,向有催化剂的密闭容器中按体积比
时,向有催化剂的密闭容器中按体积比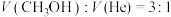 充入
充入 和
和 ,发生反应
,发生反应 ,达到平衡状态时
,达到平衡状态时 的转化率为
的转化率为 ,则该温度下,反应的平衡常数
,则该温度下,反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(1)丙烷脱氢制丙烯过程的主反应为:
反应①:

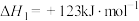 。
。副反应有:
反应②:

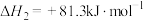
反应③:
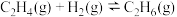
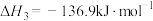
反应④:
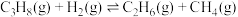

则

 。
。(2)已知:在纤维状BPO4/SiO2催化剂作用下,丙烷在一定温度下会发生(1)中反应①和反应②。丙烷的平衡转化率和丙烯的选择性随温度的变化如图所示,随着温度升高,丙烯的选择性降低的可能原因有
 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,发生反应
,发生反应 ,经过
,经过 达到平衡状态,测得平衡时气体压强是开始时的1.2倍。
达到平衡状态,测得平衡时气体压强是开始时的1.2倍。①
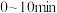 内丙烯的平均反应速率
内丙烯的平均反应速率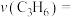
 。
。②保持其他条件不变,反应达平衡后再向容器中充入少量
 ,则
,则 的平衡转化率
的平衡转化率③已知
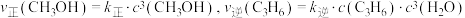 ,其中
,其中 、
、 为速率常数,只与温度有关,则
为速率常数,只与温度有关,则 时,
时,
(4)在
 、压强恒定为
、压强恒定为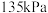 时,向有催化剂的密闭容器中按体积比
时,向有催化剂的密闭容器中按体积比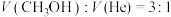 充入
充入 和
和 ,发生反应
,发生反应 ,达到平衡状态时
,达到平衡状态时 的转化率为
的转化率为 ,则该温度下,反应的平衡常数
,则该温度下,反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
名校
解题方法
2 . 甲醇水蒸气重整制氢反应流程简单,但氢气中含有的CO会降低氢燃料电池性能,如何降低一氧化碳含量、提升氢气纯度成为研究的热点。甲醇水蒸气重整制氢过程发生的反应如下:
主反应:

副反应:

(1)制氢过程中存在逆水气变换反应 ,
,
_______  。
。
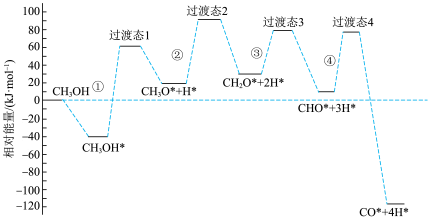
(2)副反应部分机理如图所示(其中吸附在催化剂表面上的物种用*标注),其中决速步骤的反应为_______ 。 时,在催化剂作用下,温度对甲醇平衡转化率及
时,在催化剂作用下,温度对甲醇平衡转化率及 选择性[
选择性[ ]的影响如图所示。
]的影响如图所示。 平衡转化率增大的原因是
平衡转化率增大的原因是_______ 。
②主反应的适宜温度在_______ (填“210℃”“240℃”或“280℃”)左右。
(4)在一定温度、压强和催化剂作用下,甲醇水蒸气重整反应中,CO、 的选择性及单位甲醇的产氢率随水醇比的变化如图所示。
的选择性及单位甲醇的产氢率随水醇比的变化如图所示。_______ 。
②若 点甲醇的平衡转化率为96%,此时
点甲醇的平衡转化率为96%,此时 的物质的量分数
的物质的量分数
_______ (保留两位有效数字),以物质的量分数表示的主反应的平衡常数
_______ (列出计算式即可)。
主反应:


副反应:


(1)制氢过程中存在逆水气变换反应
 ,
,
 。
。(2)副反应部分机理如图所示(其中吸附在催化剂表面上的物种用*标注),其中决速步骤的反应为
 时,在催化剂作用下,温度对甲醇平衡转化率及
时,在催化剂作用下,温度对甲醇平衡转化率及 选择性[
选择性[ ]的影响如图所示。
]的影响如图所示。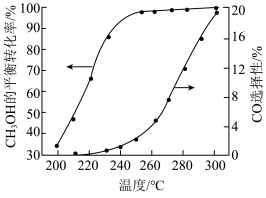
 平衡转化率增大的原因是
平衡转化率增大的原因是②主反应的适宜温度在
(4)在一定温度、压强和催化剂作用下,甲醇水蒸气重整反应中,CO、
 的选择性及单位甲醇的产氢率随水醇比的变化如图所示。
的选择性及单位甲醇的产氢率随水醇比的变化如图所示。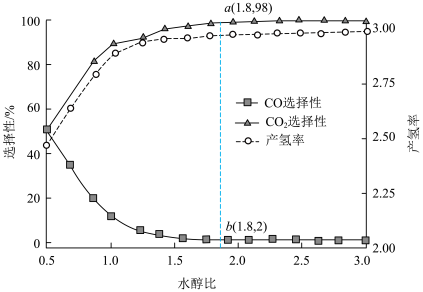
②若
 点甲醇的平衡转化率为96%,此时
点甲醇的平衡转化率为96%,此时 的物质的量分数
的物质的量分数

您最近一年使用:0次
3 . 资源和环境问题仍是社会关注的焦点。碳捕集、利用与封存(简称 ),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离
),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离 ,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
(1)一定条件下, 催化加氢制
催化加氢制 时,发生的主要反应有:
时,发生的主要反应有:
反应①:
反应②: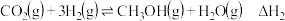
反应③:
(1)反应②的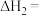
_______  ,该反应的自发条件是
,该反应的自发条件是_______ (填“低温”“高温”或“任意温度”)。
(2) 催化加氢法可制备乙烯,反应原理为
催化加氢法可制备乙烯,反应原理为 。向
。向 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示: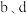 分别代表的是
分别代表的是_______ 、_______ 的物质的量随温度的变化关系。
②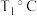 时,
时, 的平衡转化率为
的平衡转化率为_______ (结果保留三位有效数字)。
(3)一定温度下,分别按 起始物质的量之比为
起始物质的量之比为 发生反应
发生反应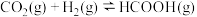 ,保持总压强为
,保持总压强为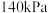 ,测得
,测得 的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为_______ 。X点条件下,用平衡分压代替平衡浓度计算的平衡常数
_______  (已知:分压=总压×物质的量分数)。
(已知:分压=总压×物质的量分数)。 材料作光电阴极,以
材料作光电阴极,以 饱和的
饱和的 的
的 溶液作电解液
溶液作电解液 ,将
,将 转化为
转化为 ,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
,原理如图丙所示。根据图示,写出光电阴极的电极反应式:_______ 。
 ),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离
),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离 ,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:(1)一定条件下,
 催化加氢制
催化加氢制 时,发生的主要反应有:
时,发生的主要反应有:反应①:

反应②:
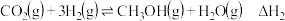
反应③:

(1)反应②的
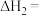
 ,该反应的自发条件是
,该反应的自发条件是(2)
 催化加氢法可制备乙烯,反应原理为
催化加氢法可制备乙烯,反应原理为 。向
。向 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
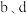 分别代表的是
分别代表的是②
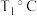 时,
时, 的平衡转化率为
的平衡转化率为(3)一定温度下,分别按
 起始物质的量之比为
起始物质的量之比为 发生反应
发生反应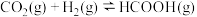 ,保持总压强为
,保持总压强为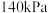 ,测得
,测得 的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
 (已知:分压=总压×物质的量分数)。
(已知:分压=总压×物质的量分数)。
 材料作光电阴极,以
材料作光电阴极,以 饱和的
饱和的 的
的 溶液作电解液
溶液作电解液 ,将
,将 转化为
转化为 ,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
您最近一年使用:0次
名校
4 . 碘及碘的化合物在生产、生活中有广泛应用。某温度下,在反应器中起始加入0.21 KI溶液,加入
KI溶液,加入 ,发生反应①和反应②。测得
,发生反应①和反应②。测得 、
、 、
、 的平衡浓度与起始
的平衡浓度与起始 关系如图所示。
关系如图所示。
①
② (棕黄色)
(棕黄色)
下列叙述正确的是
 KI溶液,加入
KI溶液,加入 ,发生反应①和反应②。测得
,发生反应①和反应②。测得 、
、 、
、 的平衡浓度与起始
的平衡浓度与起始 关系如图所示。
关系如图所示。
①

②
 (棕黄色)
(棕黄色)下列叙述正确的是
| A.反应①中还原剂、氧化剂的物质的量之比为2∶1 |
B. 的VSEPR模型和空间结构都是平面三角形 的VSEPR模型和空间结构都是平面三角形 |
C.起始 时, 时, 的平衡转化率为30% 的平衡转化率为30% |
D.该温度下, 平衡常数 平衡常数 |
您最近一年使用:0次
2024-05-19更新
|
101次组卷
|
3卷引用:甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题
5 . 随着“碳达峰”、“碳中和”战略的提出,大气中 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:
(1) 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。___________ (用文字叙述)。
(2) 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
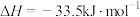 ,
,
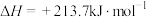 。
。
①
___________  。
。
②利于该反应自发进行的条件为___________ (填“高温”“低温”或“任意条件”)。
(3) 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
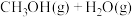
 ],其转化过程如图1所示。
],其转化过程如图1所示。___________ 。
②一定温度下,向体积为 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时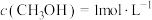 。前
。前 内,
内,
___________  ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (用分数表示)。
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是___________ (填字母)。
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C. 和
和 物质的量之比不变
物质的量之比不变
D.单位时间内,每有 键断裂,同时有
键断裂,同时有 键形成
键形成
(4) 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液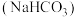 ,通过电解转化为
,通过电解转化为 及
及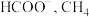 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。 转化为
转化为 的电极反应式为
的电极反应式为___________ 。
②工业生产上常采用较高电压,其目的为___________ 。
 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:(1)
 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。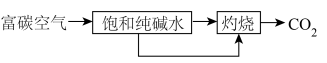
(2)
 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
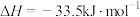 ,
,
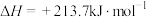 。
。①

 。
。②利于该反应自发进行的条件为
(3)
 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
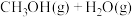
 ],其转化过程如图1所示。
],其转化过程如图1所示。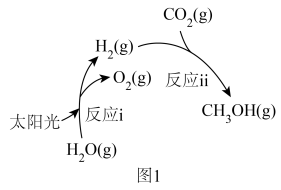
②一定温度下,向体积为
 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时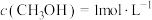 。前
。前 内,
内,
 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C.
 和
和 物质的量之比不变
物质的量之比不变D.单位时间内,每有
 键断裂,同时有
键断裂,同时有 键形成
键形成(4)
 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液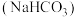 ,通过电解转化为
,通过电解转化为 及
及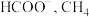 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。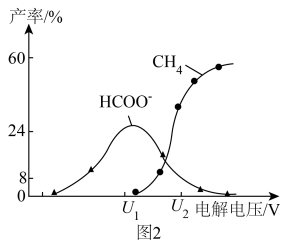
 转化为
转化为 的电极反应式为
的电极反应式为②工业生产上常采用较高电压,其目的为
您最近一年使用:0次
2024-04-19更新
|
136次组卷
|
2卷引用:甘肃省2024届高三普通高中三模化学试卷
名校
6 . 利用CO2合成二甲醚的原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比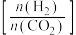 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示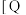 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
 CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比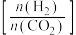 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示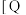 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
| A.T1K时,Kc=0.0675 | B.△H>0 |
C.X表示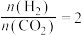 | D.催化剂可以改变CO2的平衡转化率 |
您最近一年使用:0次
2024-04-19更新
|
138次组卷
|
2卷引用:甘肃省2024届高三普通高中三模化学试卷
名校
7 . 在催化下, 加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
Ⅰ.
Ⅱ.
回答下列问题。
(1)已知: 时,部分物质的相对能量如表所示,则
时,部分物质的相对能量如表所示,则 的相对能量为
的相对能量为_______  。
。
(2)为了提高二氧化碳转化为甲酸的转化率,工业上常采用以下方法:
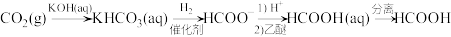
步骤1 步骤2 步骤3
①写出步骤1反应的离子方程式:_______ 。
②其他条件不变,步骤1中 转化为
转化为 的转化率与温度的关系如图所示。
的转化率与温度的关系如图所示。_______ ,后又下降的可能原因是_______ 。
③流程图步骤2中,加入乙醚的作用是_______ ,步骤3的分离方法是_______ 。
(3)保持 、恒压,
、恒压, 和
和 的投料物质的量之比为
的投料物质的量之比为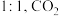 的初始分压为
的初始分压为 ,测得
,测得 的转化率
的转化率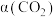 与时间t的关系如图所示。
与时间t的关系如图所示。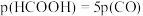 ,则反应Ⅰ的
,则反应Ⅰ的
_____ 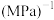 (用含
(用含 的式子表示)。
的式子表示)。
 加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。Ⅰ.

Ⅱ.

回答下列问题。
(1)已知:
 时,部分物质的相对能量如表所示,则
时,部分物质的相对能量如表所示,则 的相对能量为
的相对能量为 。
。| 物质 | 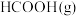 |  |
相对能量/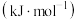 | 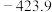 |  |
(2)为了提高二氧化碳转化为甲酸的转化率,工业上常采用以下方法:
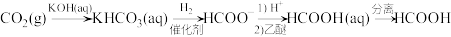
步骤1 步骤2 步骤3
①写出步骤1反应的离子方程式:
②其他条件不变,步骤1中
 转化为
转化为 的转化率与温度的关系如图所示。
的转化率与温度的关系如图所示。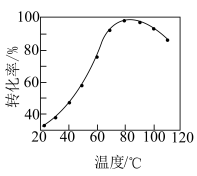
③流程图步骤2中,加入乙醚的作用是
(3)保持
 、恒压,
、恒压, 和
和 的投料物质的量之比为
的投料物质的量之比为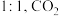 的初始分压为
的初始分压为 ,测得
,测得 的转化率
的转化率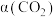 与时间t的关系如图所示。
与时间t的关系如图所示。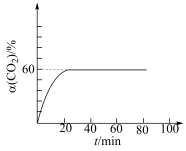
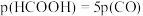 ,则反应Ⅰ的
,则反应Ⅰ的
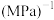 (用含
(用含 的式子表示)。
的式子表示)。
您最近一年使用:0次
2024-04-15更新
|
80次组卷
|
2卷引用:2024届甘肃省平凉市静宁县高三第四次摸底考试模拟预测化学试题
8 . 碳和碳的化合物在生产、生活中有重要作用,乙烯、甲醇、甲酸等都是重要的能源物质。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
在相同条件下,起始反应最快的是_____ (填序号)。 的
的
_____ 。
(2)甲醇水蒸气重整,总反应为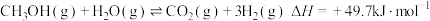 。
。
①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是_____ (填字母)。
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.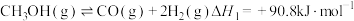
Ⅱ.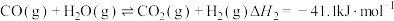
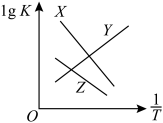
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是_____ ,理由是_____ 。
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:
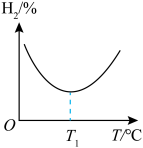
T1°C之后平衡体系中H2体积分数增大的原因是_____ 。
(3)CO2催化还原可以制备 和HCOOH:
和HCOOH:
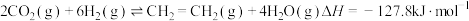 ;
;
 。
。
在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为_____ ,该温度下,甲酸化的平衡常数K=_____ (结果保留2位小数)。提示: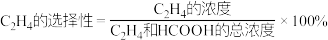
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
| 序号 | 化学反应 | E1/(kJ·mol-¹) | E2/(kJ·mol-¹) |
| ① | 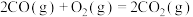 | 1954 | 2519 |
| ② | 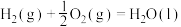 | 685 | 970 |
| ③ | 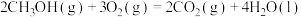 | 3526 | 4978 |
 的
的
(2)甲醇水蒸气重整,总反应为
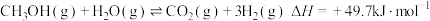 。
。①若工业生产中在恒压容器中进行该反应,下列措施可提高CH3OH的平衡转化率的是
a.原料气中掺入一定量惰性气体
b.升高温度
c.使用催化效率更高的催化剂
d.使用分子筛及时移走产生的氢气
②该过程中同时发生两个反应:
I.
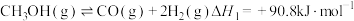
Ⅱ.
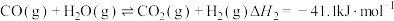
总反应、反应Ⅰ、反应Ⅱ的平衡常数对数lgK与
 变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
变化关系如图所示。图中X和Y、Z三条曲线中,表示反应Ⅰ的是
③在恒容密闭容器中,充入一定量CH3OH(g)和H2O(g),同时发生反应Ⅰ、反应Ⅱ,实验测得不同温度下,平衡体系中H2的体积分数如图所示:

T1°C之后平衡体系中H2体积分数增大的原因是
(3)CO2催化还原可以制备
 和HCOOH:
和HCOOH: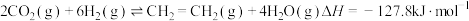 ;
; 。
。在一定温度下,在容积为1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),同时发生了乙烯化和甲酸化反应,达到平衡时C2H4的选择性为40%,体系压强减小了22.5%。则CO2总转化率为
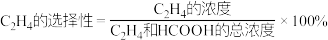
您最近一年使用:0次
解题方法
9 . 二氧化碳加氢制甲烷过程中的主要反应如下:
反应Ⅰ: ΔH1
ΔH1
反应Ⅱ: ΔH2
ΔH2
(1)已知CH4(g)、H2(g)的燃烧热ΔH依次为-893 kJ·mol-1、-285.8 kJ·mol-1;H2O(g)=H2O(1) ΔH3=-44 kJ·mol-1,则ΔH1=___________ kJ·mol-1。
(2)已知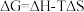 ,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
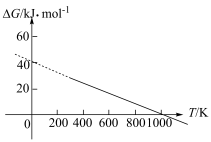
①反应Ⅱ自发进行的温度范围为___________ ;ΔH2=___________ 。
②1000 K时,将等物质的量的CO2和H2投入恒压密闭容器中,假设只发生反应Ⅱ,t min时达平衡状态,用CO2的分压变化表示t min内的平均反应速率v(CO2)=___________ kPa/min(用含t的表达式作答)(已知:分压=总压×物质的量的分数)。
(3)在恒压(p0 kPa)密闭容器中,通入5 mol CO2和20 mol H2反应,平衡时含碳物质的物质的量随温度的变化如图所示:
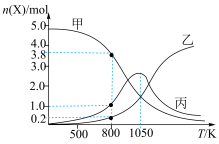
①曲线丙代表的物质的物质的量随温度升高先增大后减小的原因是___________ 。
②CH4的选择性可表示为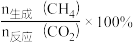 。800 K下,反应达平衡时,CH4的选择性为
。800 K下,反应达平衡时,CH4的选择性为___________ ,反应Ⅰ的分压平衡常数Kp=___________ (列出计算式即可)。
反应Ⅰ:
 ΔH1
ΔH1反应Ⅱ:
 ΔH2
ΔH2(1)已知CH4(g)、H2(g)的燃烧热ΔH依次为-893 kJ·mol-1、-285.8 kJ·mol-1;H2O(g)=H2O(1) ΔH3=-44 kJ·mol-1,则ΔH1=
(2)已知
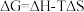 ,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
,ΔG=-2.30RTlgKp(其中R为常数,T为温度,Kp为分压平衡常数),忽略ΔH、ΔS随温度的变化。在100 kPa压强下,反应Ⅱ的ΔG随温度变化的理论计算结果如下图所示。
①反应Ⅱ自发进行的温度范围为
②1000 K时,将等物质的量的CO2和H2投入恒压密闭容器中,假设只发生反应Ⅱ,t min时达平衡状态,用CO2的分压变化表示t min内的平均反应速率v(CO2)=
(3)在恒压(p0 kPa)密闭容器中,通入5 mol CO2和20 mol H2反应,平衡时含碳物质的物质的量随温度的变化如图所示:

①曲线丙代表的物质的物质的量随温度升高先增大后减小的原因是
②CH4的选择性可表示为
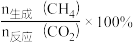 。800 K下,反应达平衡时,CH4的选择性为
。800 K下,反应达平衡时,CH4的选择性为
您最近一年使用:0次
10 . 二氧化碳催化加氢制甲醇,能助力“碳达峰”,涉及反应有:
反应①
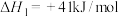
反应②
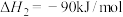
反应③

(1)反应②自发进行的条件是_______ (填“高温”、“低温”或“任意温度”),反应③
_______  。
。
(2)反应③在热力学上趋势大于反应①,其原因是_______ 。
(3)反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低_______ eV(eV为能量单位)。 下,
下, 和
和 按物质的量之比为
按物质的量之比为 进行投料,只发生反应①和反应③,平衡时CO和
进行投料,只发生反应①和反应③,平衡时CO和 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。_______ 。
②q曲线在250℃之后随温度升高而增大的原因是_______ 。
③250℃时,反应①的平衡常数
_______ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)向一定浓度的 溶液通入
溶液通入 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示(阴、阳极区溶液均为
,电解原理如图所示(阴、阳极区溶液均为 溶液)。电解过程中生成尿素的电极反应式为
溶液)。电解过程中生成尿素的电极反应式为_______ 。
反应①

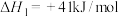
反应②

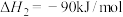
反应③


(1)反应②自发进行的条件是

 。
。(2)反应③在热力学上趋势大于反应①,其原因是
(3)反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低
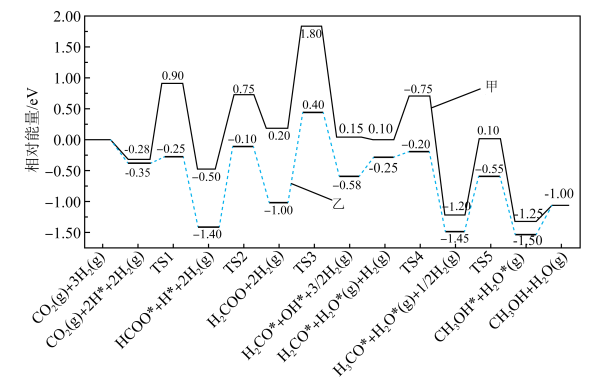
 下,
下, 和
和 按物质的量之比为
按物质的量之比为 进行投料,只发生反应①和反应③,平衡时CO和
进行投料,只发生反应①和反应③,平衡时CO和 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。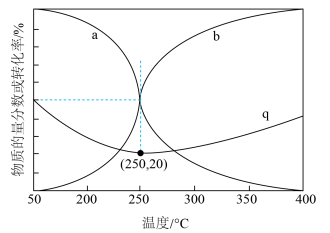
②q曲线在250℃之后随温度升高而增大的原因是
③250℃时,反应①的平衡常数

 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。(5)向一定浓度的
 溶液通入
溶液通入 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示(阴、阳极区溶液均为
,电解原理如图所示(阴、阳极区溶液均为 溶液)。电解过程中生成尿素的电极反应式为
溶液)。电解过程中生成尿素的电极反应式为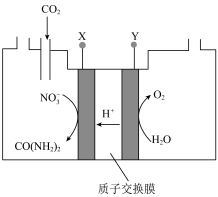
您最近一年使用:0次
2024-02-25更新
|
902次组卷
|
4卷引用:专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届四川省绵阳市某中学高三下学期“超越杯”考试理科综合试题-高中化学



