1 . 已知: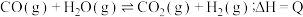 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。
(1)上述反应的化学平衡常数表达式为
___________ 。
(2) 时,向体积为
时,向体积为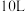 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则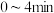 时,平均反应速率
时,平均反应速率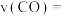
___________ 。
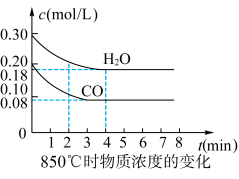
(3)若在 时进行,且
时进行,且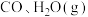 的起始浓度均为
的起始浓度均为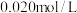 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为___________
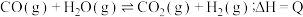 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。温度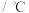 | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为

(2)
 时,向体积为
时,向体积为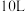 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则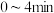 时,平均反应速率
时,平均反应速率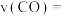

(3)若在
 时进行,且
时进行,且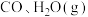 的起始浓度均为
的起始浓度均为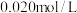 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为
您最近一年使用:0次
2 . 以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率 (H2)=
(H2)=_______ ,当平衡时c(N2)=_______ ,此时H2的转化率为_______ %,此条件下该反应的平衡常数为_______ 。
(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
(3)若在上述2L的密闭容器中,一定量的氮气和氢气发生上述反应,其化学平衡常数K与温度T的关系如表所示:
①试比较K1、K2的大小,K1_______ K2(填“>”、“<”或“=”);
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向_______ 进行(填“正反应”、“逆反应”或“已平衡”)。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率
 (H2)=
(H2)=(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 | C.降低反应体系的温度 | D.加入一定量N2 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向
您最近一年使用:0次
解题方法
3 . 顺1,2二甲基环丙烷和反1,2二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=_______ 。

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=
您最近一年使用:0次
解题方法
4 . 无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)⇌2NO2(g) ΔH=+24.4 kJ·mol-1。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______ (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______ kPa·s-1。
您最近一年使用:0次
解题方法
5 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知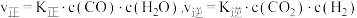 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数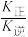 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知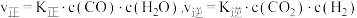 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数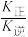 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
名校
6 . 在一定温度下,在某4L恒容容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。

(1)该反应的化学方程式为_________ (需要标注M、N的物质状态,且系数化成最简整数)。
(2)比较t2时刻,正、逆反应速率大小:v(正)_________ v(逆)(填“>”“=”或“<”)。
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)_________ mol·L-1·min-1。
(4)该反应的化学平衡常数K=_________ 。
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H_________ 0(填“>”“=”或“<”)。

(1)该反应的化学方程式为
(2)比较t2时刻,正、逆反应速率大小:v(正)
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)
(4)该反应的化学平衡常数K=
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H
您最近一年使用:0次
名校
解题方法
7 . 化学平衡常数和化学平衡计算
(1)已知在448℃时,反应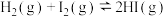 的平衡常数K为49,则该温度下反应
的平衡常数K为49,则该温度下反应 的平衡常数K′为
的平衡常数K′为_______ 。(用分数表示)
(2)某温度下,若把10mol 与30mol
与30mol 置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
_______ 。(用分数表示)
(3)恒温恒压下,在一容积可变的容器中, 达到平衡状态时,
达到平衡状态时, 、
、 、
、 各1mol,若此时再充入3mol
各1mol,若此时再充入3mol ,则平衡
,则平衡_______ 移动(填“正向”、“逆向”或“不”)
(4)以水煤气为原料合成甲醇: ,容器为恒温、恒压
,容器为恒温、恒压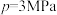 ,充入1mol
,充入1mol 和2mol
和2mol 达到平衡时
达到平衡时 的转化率为75%,平衡常数Kp=
的转化率为75%,平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)在1L真空密闭容器中加入amol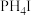 固体,t℃时发生如下反应:
固体,t℃时发生如下反应:
 ①
①
 ②
②
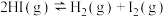 ③
③
达平衡时,体系中 ,
, ,
, ,则t°C时反应①的平衡常数K值为
,则t°C时反应①的平衡常数K值为_______ (用字母表示)
(6)查阅资料知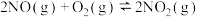 的反应历程分两步:
的反应历程分两步:
Ⅰ.
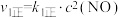 ;
;
Ⅱ.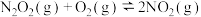 ;
; ;
;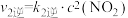
一定温度下,反应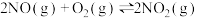 达到平衡状态,请写出用
达到平衡状态,请写出用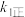 、
、 、
、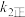 、
、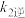 表示的平衡常数表达式
表示的平衡常数表达式
_______ 。
(1)已知在448℃时,反应
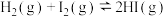 的平衡常数K为49,则该温度下反应
的平衡常数K为49,则该温度下反应 的平衡常数K′为
的平衡常数K′为(2)某温度下,若把10mol
 与30mol
与30mol 置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
(3)恒温恒压下,在一容积可变的容器中,
 达到平衡状态时,
达到平衡状态时, 、
、 、
、 各1mol,若此时再充入3mol
各1mol,若此时再充入3mol ,则平衡
,则平衡(4)以水煤气为原料合成甲醇:
 ,容器为恒温、恒压
,容器为恒温、恒压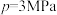 ,充入1mol
,充入1mol 和2mol
和2mol 达到平衡时
达到平衡时 的转化率为75%,平衡常数Kp=
的转化率为75%,平衡常数Kp=(5)在1L真空密闭容器中加入amol
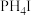 固体,t℃时发生如下反应:
固体,t℃时发生如下反应: ①
① ②
②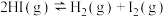 ③
③达平衡时,体系中
 ,
, ,
, ,则t°C时反应①的平衡常数K值为
,则t°C时反应①的平衡常数K值为(6)查阅资料知
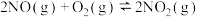 的反应历程分两步:
的反应历程分两步:Ⅰ.

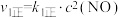 ;
;
Ⅱ.
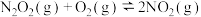 ;
; ;
;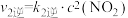
一定温度下,反应
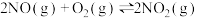 达到平衡状态,请写出用
达到平衡状态,请写出用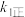 、
、 、
、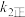 、
、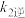 表示的平衡常数表达式
表示的平衡常数表达式
您最近一年使用:0次
名校
解题方法
8 . 氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、Pt和
、Pt和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量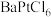 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
___________ kPa,反应 的平衡常数K=
的平衡常数K=___________ (保留两位有效数字)。
 固体加热时部分分解为
固体加热时部分分解为 、Pt和
、Pt和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量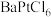 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
9 . 在一定温度下,2L密闭容器中加入0.4molSO2、0.3molO2,经5min后反应达平衡,测得c(SO3)=0.1mol/L。试求:
(1)用SO2表示该反应0~5min的反应速率为多少_______ ?
(2)平衡时SO2 的转化率为多少_______ ?
(3)平衡常数K为多少_______ ?
(1)用SO2表示该反应0~5min的反应速率为多少
(2)平衡时SO2 的转化率为多少
(3)平衡常数K为多少
您最近一年使用:0次
名校
解题方法
10 . 恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: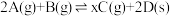 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
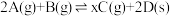 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
2022-06-02更新
|
806次组卷
|
7卷引用:江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题
江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题



