1 . 为实现“双碳”目标,某科研所研究二氧化碳制备甲醇技术可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
(1)在一定条件下,合成甲醇的过程中主要发生以下反应:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1
Ⅲ.CO(g)+2H2(g) CH3OH(g) △H3=-90.5kJ•mol-1
CH3OH(g) △H3=-90.5kJ•mol-1
反应Ⅰ的△H1=_______ ;增大反应体系的压强(缩小容积),n(CH3OH)_______ (填“变大”“变小”或“不变”)。
(2)在3.0MPa和催化剂下,向1L密闭容器中充入1molCO2和3molH2,平衡时CO2的转化率与CH3OH、CO的选择性随温度的变化如图所示。
[CH3OH或CO的选择性=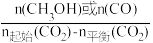 ×100%]
×100%]_______ (填化学式)的选择性;150~250℃之间,以反应______ (填“Ⅰ”或“Ⅱ”)为主。
(3)在上述条件下,反应在200℃时,反应Ⅲ的浓度平衡常数Kc=_______ L2•mol-2(用计算式表示);250℃时,反应达到平衡时测得H2的物质的量为2.0mol,CH3OH的物质的量为0.25mol,则反应Ⅱ的压强平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
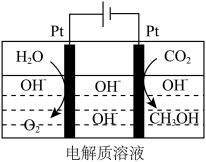
(4)该科研所除在催化剂下用氢气还原二氧化碳制取甲醇外,还研究用如图装置电解法制取甲醇。写出阴极上发生反应的电极反应式_______ 。
(1)在一定条件下,合成甲醇的过程中主要发生以下反应:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1Ⅲ.CO(g)+2H2(g)
 CH3OH(g) △H3=-90.5kJ•mol-1
CH3OH(g) △H3=-90.5kJ•mol-1反应Ⅰ的△H1=
(2)在3.0MPa和催化剂下,向1L密闭容器中充入1molCO2和3molH2,平衡时CO2的转化率与CH3OH、CO的选择性随温度的变化如图所示。
[CH3OH或CO的选择性=
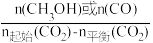 ×100%]
×100%]
(3)在上述条件下,反应在200℃时,反应Ⅲ的浓度平衡常数Kc=
(4)该科研所除在催化剂下用氢气还原二氧化碳制取甲醇外,还研究用如图装置电解法制取甲醇。写出阴极上发生反应的电极反应式
您最近一年使用:0次
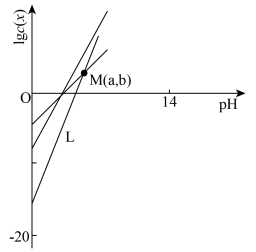
2 . 柠檬酸(H3Cit)是一种重要的三元有机中强酸。常温下,一定pH范围内,存在以下平衡: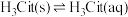 ;
; ;
; ;
;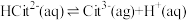 。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
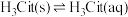 ;
; ;
; ;
;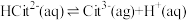 。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
| A.随pH增大,H3Cit(aq)的浓度保持不变 |
| B.直线L表示lgc(H2Cit-)的变化情况 |
C.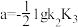 |
| D.pH<a时的某一pH范围内,存在c(HCit2-)>c(H2Cit-)>c(Cit3-) |
您最近一年使用:0次
名校
3 . "碳达峰”“碳中和”是我国社会发展重大战略之一
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
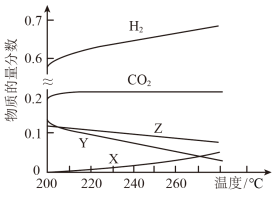
①图中Y代表___________ (填化学式)。
②体系中CO2的物质的量分数受温度影响不大,原因是___________ 。
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g) 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1
②CO2(g)+H2(g) CO(g)+H2O(g) K2
CO(g)+H2O(g) K2
请回答:
(2)反应CH4(g)+3CO2(g) 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=___________ (用K1,K2表示)。
(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。
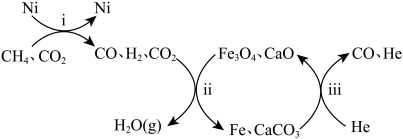
①写出过程ii产生H2O(g)的化学方程式___________ 。
②过程ii的催化剂是___________ ,若CH4和CO2按物质的量之比1:1投料,则会导致过程ii___________ 。
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因___________ 。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1③CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

①图中Y代表
②体系中CO2的物质的量分数受温度影响不大,原因是
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g)
 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1②CO2(g)+H2(g)
 CO(g)+H2O(g) K2
CO(g)+H2O(g) K2请回答:
(2)反应CH4(g)+3CO2(g)
 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。

①写出过程ii产生H2O(g)的化学方程式
②过程ii的催化剂是
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因
您最近一年使用:0次
名校
解题方法
4 . 工业上制备Ti,采用碳氯化法将 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:
①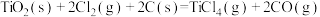
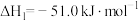
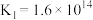
②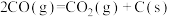
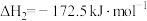
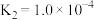
③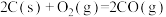
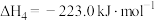
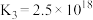 。
。
在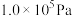 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:①
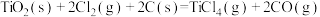
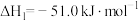
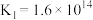
②
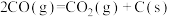
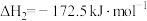
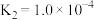
③
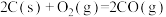
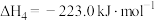
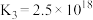 。
。在
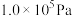 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是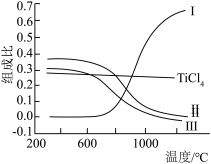
A.1000℃时,反应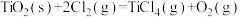 的平衡常数 的平衡常数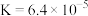 |
B.曲线III表示平衡时 的物质的量分数随温度的变化 的物质的量分数随温度的变化 |
| C.高于600℃,升高温度,主要对反应②的平衡产生影响 |
D.为保证 的平衡产率,选择反应温度应高于1000℃ 的平衡产率,选择反应温度应高于1000℃ |
您最近一年使用:0次
2023-03-23更新
|
1508次组卷
|
5卷引用:江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题
江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题(已下线)专题14 化学反应速率和化学平衡江苏省郑梁梅高级中学2022-2023学年高二下学期4月月考化学试题河北省衡水中学2023-2024学年高三上学期四调考试 化学试题(已下线)FHgkyldyjhx08
名校
解题方法
5 . 甲烷在化学工业中应用广泛。回答下列问题:
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
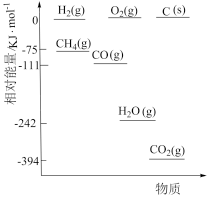
①相关物质相对能量大小如图所示,则△H1=_______ kJ·mol-1,升高温度,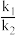
_______ (填“增大”或“减小”)。
②起始物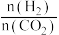 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)_______ vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=_______ Pa,反应I以物质的量分数表示的平衡常数KxI=_______ 。

(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
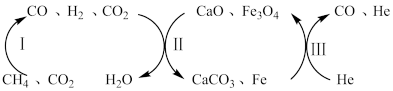
其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将_____ (填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)_______ (填“增大”、“减小”或“不变”),p(CO)_____ (填“增大”、“减小”或“不变”)。
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=
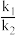

②起始物
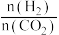 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。

其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将
您最近一年使用:0次
2023-03-19更新
|
954次组卷
|
3卷引用:山东省烟台市、德州市、滨州市2023届高三一模考试化学试题
山东省烟台市、德州市、滨州市2023届高三一模考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(原理综合题)山东省日照实验高级中学2023-2024学年高二上学期第一次阶段考试化学试题
名校
解题方法
6 .  、
、 为重要化工原料,常用于合成重要化合物。
为重要化工原料,常用于合成重要化合物。
Ⅰ.以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
ⅰ
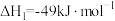
ⅱ
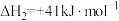
ⅲ

回答下列问题:
(1) 为分压平衡常数,各反应的
为分压平衡常数,各反应的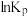 随
随 的变化如图所示。
的变化如图所示。
_______  ,其对应的曲线为
,其对应的曲线为_______ (填“a”或“c”)。
(2)在5MPa下,按照 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: 的曲线为
的曲线为_______ (填“m”或“n”)。
②解释150~250℃范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因_______ 。
③下列说法错误的是_______ (填字母)。
A. 的平衡转化率始终低于
的平衡转化率始终低于 的
的
B.温度越低,越有利于工业生产
C.加入选择性高的催化剂,可提高 的平衡转化率
的平衡转化率
D.150-400℃范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大
④270℃时CO的分压为_______ ,反应ⅱ的平衡常数为_______ (列出算式)。
Ⅱ. 超干重整
超干重整 得到的CO经偶联反应可制得
得到的CO经偶联反应可制得 (草酸)。
(草酸)。
(3)在水溶液中 、
、 和
和 物质的量分数与pH关系如图所示,则c点溶液
物质的量分数与pH关系如图所示,则c点溶液
_______ 。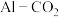 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝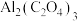
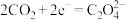 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 起催化作用,催化过程可表示为:①
起催化作用,催化过程可表示为:①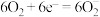 ②……
②……
(4)写出反应②的方程式_______ 。
 、
、 为重要化工原料,常用于合成重要化合物。
为重要化工原料,常用于合成重要化合物。Ⅰ.以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:ⅰ

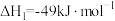
ⅱ

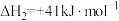
ⅲ


回答下列问题:
(1)
 为分压平衡常数,各反应的
为分压平衡常数,各反应的 随
随 的变化如图所示。
的变化如图所示。

 ,其对应的曲线为
,其对应的曲线为(2)在5MPa下,按照
 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: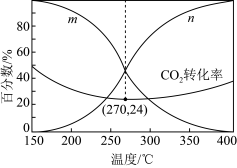
 的曲线为
的曲线为②解释150~250℃范围内
 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因③下列说法错误的是
A.
 的平衡转化率始终低于
的平衡转化率始终低于 的
的B.温度越低,越有利于工业生产

C.加入选择性高的催化剂,可提高
 的平衡转化率
的平衡转化率D.150-400℃范围内,温度升高,
 的平衡产量先减小后增大
的平衡产量先减小后增大④270℃时CO的分压为
Ⅱ.
 超干重整
超干重整 得到的CO经偶联反应可制得
得到的CO经偶联反应可制得 (草酸)。
(草酸)。(3)在水溶液中
 、
、 和
和 物质的量分数与pH关系如图所示,则c点溶液
物质的量分数与pH关系如图所示,则c点溶液
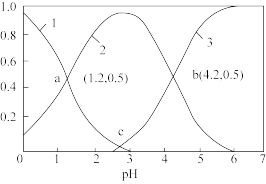
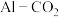 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝
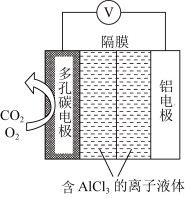
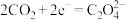 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 起催化作用,催化过程可表示为:①
起催化作用,催化过程可表示为:①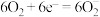 ②……
②……(4)写出反应②的方程式
您最近一年使用:0次
2022-12-04更新
|
883次组卷
|
5卷引用:山东省枣庄滕州市2022-2023学年高三上学期期中考试化学试题
名校
解题方法
7 . 利用丙烷(C3H8)在无氧条件下制备丙烯(C3H6)的反应方程式为:C3H8(g) C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
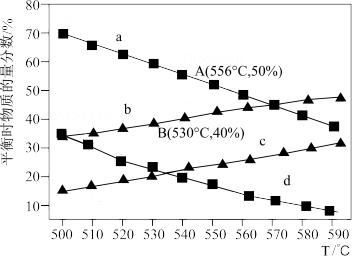
 C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
| A.c曲线表示的是0.01MPa压强下丙烯随温度变化的物质的量分数 |
| B.A点对应的该反应平衡常数Kp=1.25MPa(Kp为以分压表示的平衡常数) |
| C.B点丙烷的平衡转化率为33.3% |
| D.实际生产过程中需通入一定量水蒸气,其目的是稀释原料气,增大丙烯的平衡产率 |
您最近一年使用:0次
2022-09-04更新
|
1507次组卷
|
5卷引用:重庆市南开中学校2022-2023学年高三上学期第一次质量检测联考化学试题
重庆市南开中学校2022-2023学年高三上学期第一次质量检测联考化学试题(已下线)2022年北京高考真题变式题1-14黑龙江省牡丹江市第一高级中学2022-2023学年高二10月月考化学试题重庆市南开中学2022-2023学年高三上学期第一次质检化学试题(已下线)2022年北京高考真题化学试题变式题(选择题11-14)
8 . 甲醇是重要的化工原料,工业上可利用 生产甲醇,同时可减少温室气体二氧化碳,发生反应①:
生产甲醇,同时可减少温室气体二氧化碳,发生反应①: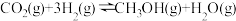

(1)下列措施中,能提高 平衡转化率的是___________。
平衡转化率的是___________。
(2)当起始物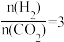 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为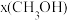 ,在
,在 下的
下的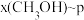 、在
、在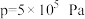 下的
下的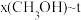 如图所示。当
如图所示。当 的平衡转化率为
的平衡转化率为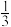 时,反应条件可能是
时,反应条件可能是___________ 。
(3)在某催化剂作用下, 和
和 除发生反应①外,还发生反应②:
除发生反应①外,还发生反应②:
 。维持压强不变,按固定初始投料比将
。维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经相同时间测得实验数据:
按一定流速通过该催化剂,经相同时间测得实验数据:
注:甲醇的选择性是指发生反应的 中转化为甲醇的百分比。
中转化为甲醇的百分比。
表中数据说明,升高温度, 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是___________ 。
(4)甲醇催化制取丙烯的过程中发生反应: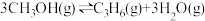 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
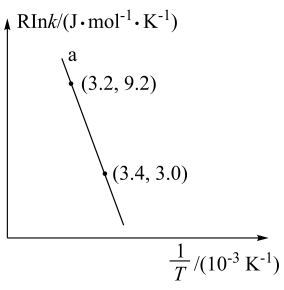
①反应的活化能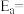
__  。
。
②当使用更高效催化剂时,在图中画出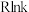 与
与 关系的示意图
关系的示意图__ 。
 生产甲醇,同时可减少温室气体二氧化碳,发生反应①:
生产甲醇,同时可减少温室气体二氧化碳,发生反应①: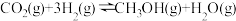

(1)下列措施中,能提高
 平衡转化率的是___________。
平衡转化率的是___________。A.在原料气中加入适量 | B.从体系中不断分离出甲醇 |
| C.循环利用原料气 | D.使用高效催化剂 |
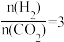 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为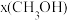 ,在
,在 下的
下的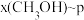 、在
、在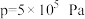 下的
下的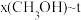 如图所示。当
如图所示。当 的平衡转化率为
的平衡转化率为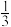 时,反应条件可能是
时,反应条件可能是
(3)在某催化剂作用下,
 和
和 除发生反应①外,还发生反应②:
除发生反应①外,还发生反应②:
 。维持压强不变,按固定初始投料比将
。维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经相同时间测得实验数据:
按一定流速通过该催化剂,经相同时间测得实验数据: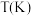 |  实际转化率(%) 实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
 中转化为甲醇的百分比。
中转化为甲醇的百分比。表中数据说明,升高温度,
 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是(4)甲醇催化制取丙烯的过程中发生反应:
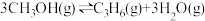 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
①反应的活化能
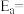
 。
。②当使用更高效催化剂时,在图中画出
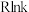 与
与 关系的示意图
关系的示意图
您最近一年使用:0次
解题方法
9 . 为应对石油短缺,一碳化学研究备受关注。一碳化学是指以分子中只含一个碳原子的化合物如甲醇、一氧化碳等为原料,制造产品的化学体系的总称。
(1)CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g)。
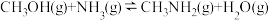
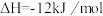
①已知该反应中相关的化学键键能数据如下:
则H—O键的键能为_________________ kJ/mol(用含有字母的代数式表示)
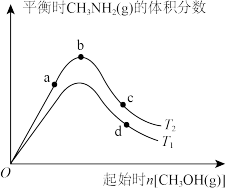
②在某恒容密闭容器中进行该反应,其他条件不变的情况下,分别测得起始时CH3OH(g)的物质的量和温度对平衡时CH3NH2(g)的体积分数的影响,如图所示:(图中T1、T2表示温度)_________ T2(填“>”、“<”或“=”);____________ (填“a”、“b”或“c”)点对应的平衡状态中反应物NH3(g)的转化率最大。b、d两点的平衡常数大小关系为Kb________ Kd(填“>”、“<”或“=”)。
(2)甲醇在工业上可利用水煤气来合成: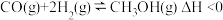 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数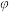 (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:________________ ,判断的理由是______________________ 。
已知v(正)=k(正)·p(CO)·p(H2)2,v(逆)=k(逆)·p(CH3OH),其中k(正)、k(逆)分别为正、逆反应速率常数,p为各组分的分压。在M点所处的温度(T3℃)和压强(p0kPa)下,反应在20分钟达到平衡时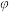 (CH3OH)=10%,该温度下反应的平恒常数KP=
(CH3OH)=10%,该温度下反应的平恒常数KP=____________ kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时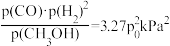 ,此时
,此时
______________ (计算结果保留两位小数)
(1)CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g)。
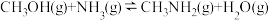
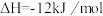
①已知该反应中相关的化学键键能数据如下:
| 共价键 | C—O | N—H | C—N | C—H |
| E/(kJ/mol) | a | b | c | d |
②在某恒容密闭容器中进行该反应,其他条件不变的情况下,分别测得起始时CH3OH(g)的物质的量和温度对平衡时CH3NH2(g)的体积分数的影响,如图所示:(图中T1、T2表示温度)
(2)甲醇在工业上可利用水煤气来合成:
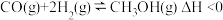 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数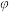 (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示: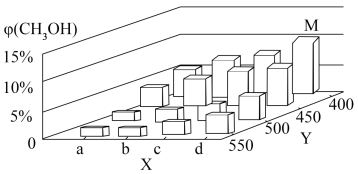
已知v(正)=k(正)·p(CO)·p(H2)2,v(逆)=k(逆)·p(CH3OH),其中k(正)、k(逆)分别为正、逆反应速率常数,p为各组分的分压。在M点所处的温度(T3℃)和压强(p0kPa)下,反应在20分钟达到平衡时
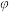 (CH3OH)=10%,该温度下反应的平恒常数KP=
(CH3OH)=10%,该温度下反应的平恒常数KP=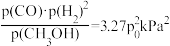 ,此时
,此时
您最近一年使用:0次
2020-06-10更新
|
469次组卷
|
2卷引用:山东省聊城市2020年普通高中学业水平等级考试模拟卷(二模)化学试题



