解题方法
1 . 对于反应N2(g)+3H2(g) 2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?_____
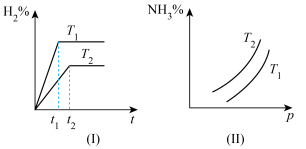
 2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
2NH3(g) ΔH<0,如何根据下列图像比较T1、T2的大小?
您最近一年使用:0次
2 . “先拐先平”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
cC(g)为例]。
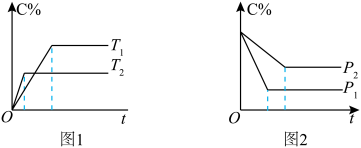
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是___________ ,温度升高,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,正反应是___________ 反应。
(2)图2中,压强p1、p2的大小关系是___________ ,压强增大,C%(C的含量)的变化是___________ ,化学平衡___________ 移动,a+b___________ c。
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g)
 cC(g)为例]。
cC(g)为例]。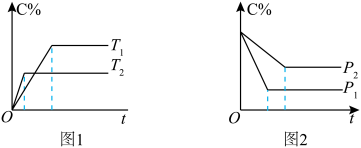
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是
(2)图2中,压强p1、p2的大小关系是
您最近一年使用:0次
名校
3 . "碳达峰”“碳中和”是我国社会发展重大战略之一
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
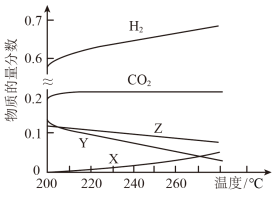
①图中Y代表___________ (填化学式)。
②体系中CO2的物质的量分数受温度影响不大,原因是___________ 。
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g) 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1
②CO2(g)+H2(g) CO(g)+H2O(g) K2
CO(g)+H2O(g) K2
请回答:
(2)反应CH4(g)+3CO2(g) 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=___________ (用K1,K2表示)。
(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。
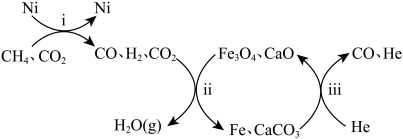
①写出过程ii产生H2O(g)的化学方程式___________ 。
②过程ii的催化剂是___________ ,若CH4和CO2按物质的量之比1:1投料,则会导致过程ii___________ 。
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因___________ 。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1③CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

①图中Y代表
②体系中CO2的物质的量分数受温度影响不大,原因是
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g)
 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1②CO2(g)+H2(g)
 CO(g)+H2O(g) K2
CO(g)+H2O(g) K2请回答:
(2)反应CH4(g)+3CO2(g)
 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。

①写出过程ii产生H2O(g)的化学方程式
②过程ii的催化剂是
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因
您最近一年使用:0次
22-23高二上·新疆哈密·期末
解题方法
4 . 工业上合成氨是在一定条件下进行反应:N2(g)+3H2(g)  2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
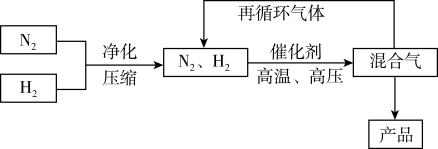
反应体系中各组分的部分性质如下表所示:
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________ 。温度升高,K值___________ (填“增大”“减小”或“不变”)。
(2)K值越大,表明___________(填序号)。
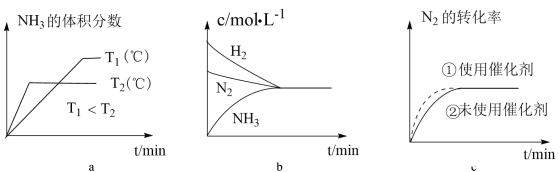
(3)对于合成氨反应而言,如图有关图像一定正确的是___________ (填字母)。
 2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
反应体系中各组分的部分性质如下表所示:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点/℃ | -210.01 | -259.23 | -77.74 |
| 沸点/℃ | -195.79 | -252.77 | -33.42 |
(1)写出该反应的化学平衡常数表达式:K=
(2)K值越大,表明___________(填序号)。
| A.其他条件相同时N2的转化率越高 |
| B.其他条件相同时NH3的产率越高 |
| C.原料中N2的含量越高 |
| D.化学反应速率越快 |

您最近一年使用:0次
5 . 回答下列问题:
Ⅰ.一定条件下,在容积为 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
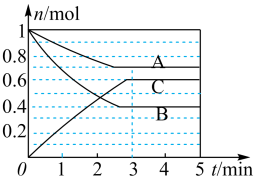
(1)达到平衡后加压,C的含量_______ (填写“变大”“变小”或“不变”)。
(2)该反应的反应速率v随时间t的关系如图所示。
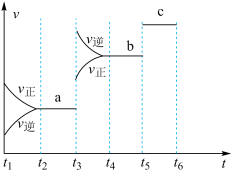
①根据图判断,在 时刻改变的外界条件是
时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,A的转化率最大的是状态_______ 。
Ⅱ.在密闭容器中充入一定量的 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。

(3)该反应的逆反应是_______ (填“吸热反应”或“放热反应”)。
(4)N点 的体积分数是
的体积分数是_______ 。
(5)M点对应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.一定条件下,在容积为
 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
(1)达到平衡后加压,C的含量
(2)该反应的反应速率v随时间t的关系如图所示。

①根据图判断,在
 时刻改变的外界条件是
时刻改变的外界条件是②a、b、c对应的平衡状态中,A的转化率最大的是状态
Ⅱ.在密闭容器中充入一定量的
 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)该反应的逆反应是
(4)N点
 的体积分数是
的体积分数是(5)M点对应的平衡常数

 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
20-21高二上·云南曲靖·阶段练习
6 . 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)⇌5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5 固体的2L恒容密闭容器中通入2mol CO,测得CO的体积分数 (CO)随时间t变化曲线如图。
(CO)随时间t变化曲线如图。
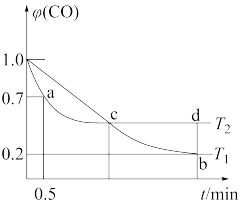
(1)此反应的平衡常数表达式____________ 。
(2)到a点时表示的化学反应速率v(CO)=____________ 。
(3)b点时CO的转化率____________ 。
(4)Kb_______ Kd(填“大于”“小于”或“等于”),原因是_______________ 。
(5)此反应的ΔH________ 0(填“大于”“小于”或“等于”)。
 (CO)随时间t变化曲线如图。
(CO)随时间t变化曲线如图。
(1)此反应的平衡常数表达式
(2)到a点时表示的化学反应速率v(CO)=
(3)b点时CO的转化率
(4)Kb
(5)此反应的ΔH
您最近一年使用:0次
名校
7 . 甲醇是重要的化工原料,发展前景广阔。研究表明, 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: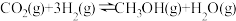
(1)反应的平衡常数表达式为K=___________ 。
(2)有利于提高平衡时 转化率的措施有
转化率的措施有___________ (填字母)。
a.使用催化剂
b.加压
c.增大 和H2的初始投料比
和H2的初始投料比
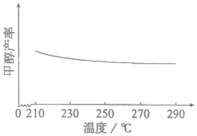
(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
___________ 0(填“>”“=”或“<”),依据是___________ 。
 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: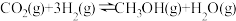
(1)反应的平衡常数表达式为K=
(2)有利于提高平衡时
 转化率的措施有
转化率的措施有a.使用催化剂
b.加压
c.增大
 和H2的初始投料比
和H2的初始投料比(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中
 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的

您最近一年使用:0次
2021-12-02更新
|
797次组卷
|
4卷引用:人教2019版选择性必修一第二章 第二节 化学平衡 课后习题
名校
8 . I.可逆反应∶mA(g)+nB(g)⇌pC(g)+qD(s) ∆H,试根据图回答∶
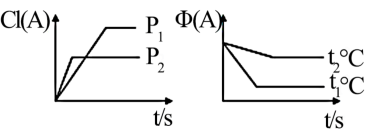
[A的转化率(%)表示为α(A)、A的含量(%)表示为φ(A)]
(1)压强P1_______ P2(填“>”,“<”或“=”下同)
(2)计量数(m+n)_______ (p)
(3)温度t1℃_______ t2℃
(4)ΔH_______ 0
II.反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
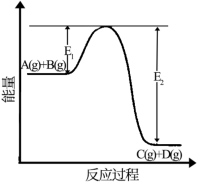
(5)该反应是_______ 反应(填“吸热”,“放热”);
(6)当反应达到平衡时,只升高温度,化学平衡向_______ (填“正反应方向”或“逆反应方向”)移动。
(7)反应体系中加入催化剂该反应的反应热_______ (填增大”“减小”“不变”);

[A的转化率(%)表示为α(A)、A的含量(%)表示为φ(A)]
(1)压强P1
(2)计量数(m+n)
(3)温度t1℃
(4)ΔH
II.反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(5)该反应是
(6)当反应达到平衡时,只升高温度,化学平衡向
(7)反应体系中加入催化剂该反应的反应热
您最近一年使用:0次
2021-09-15更新
|
567次组卷
|
4卷引用:新疆乌鲁木齐市第二十中学2019-2020学年高二上学期期中考试化学试题
新疆乌鲁木齐市第二十中学2019-2020学年高二上学期期中考试化学试题安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
2021高三·全国·专题练习
9 . 一定量的CO2与足量的C在恒压密闭容器中发生反应:C(s)+CO2(g)=2CO(g) ΔH=+173 kJ·mol-1,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:

(1)650 ℃时CO2的平衡转化率为___________ 。
(2)t1 ℃时平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);该温度下达平衡后若再充入等物质的量的CO和CO2气体,则平衡___________ (填“正向”“逆向”或“不”)移动,原因是___________ 。

(1)650 ℃时CO2的平衡转化率为
(2)t1 ℃时平衡常数Kp=
您最近一年使用:0次
2021-05-07更新
|
670次组卷
|
5卷引用:小题29 化学平衡的相关计算——备战2021年高考化学经典小题考前必刷(全国通用)
(已下线)小题29 化学平衡的相关计算——备战2021年高考化学经典小题考前必刷(全国通用)江苏省扬州市高邮市临泽中学2021-2022学年高二9月阶段测试化学试卷江苏省高邮市临泽镇高中2021-2022学年高二上学期9月阶段测试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期期中考试化学试题浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题
2021·吉林延边·模拟预测
名校
解题方法
10 . CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
(1)达到平衡时,反应a,b对比:CO2的体积分数φ(a)_______ φ(b)(填“>”、“<”或“=”))。
(2)下列能说明反应a达到平衡状态的是_______ (填字母)。
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
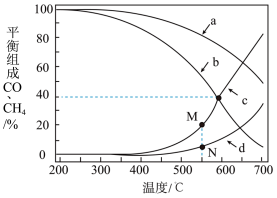
(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为_______ 。
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
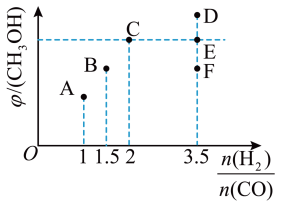
(5)当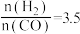 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(6) =
=_______ 时,CH3OH的体积分数最大。
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
| CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
(2)下列能说明反应a达到平衡状态的是
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。

(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。

(5)当
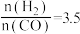 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的(6)
 =
=
您最近一年使用:0次
2021-03-04更新
|
819次组卷
|
4卷引用:第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测
(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测江苏省扬州中学2021-2022学年高二上学期期中考试化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题



