名校
解题方法
1 . 关于煤的处理是工业重要的生产工艺,从煤的气化到液化是重要环节。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:
Ⅰ.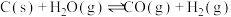

Ⅱ.
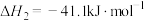
①下列说法正确的是_______ 。
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系_______ (填“吸收”或“放出”)热量_______ kJ,反应Ⅰ的平衡常数
_______ MPa(以分压表示,分压=总压×物质的量分数)。
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为
 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
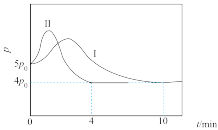
①曲线Ⅱ所对应的改变的条件可能为_______ 。
②体系总压强先增大的原因为_______ ,后减小的原因为_______ 。
③该条件下 的平衡转化率为
的平衡转化率为_______ %(结果保留三位有效数字)。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和
 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:Ⅰ.
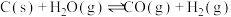

Ⅱ.

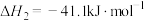
①下列说法正确的是
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率②反应平衡时,
 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为

 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
①曲线Ⅱ所对应的改变的条件可能为
②体系总压强先增大的原因为
③该条件下
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
名校
2 . 一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应: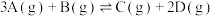 。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
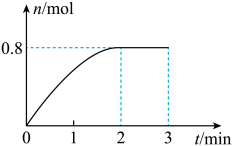
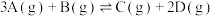 。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
| A.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
| B.2 min后,通入Ne气会使正反应速率加快,逆反应速率也加快 |
| C.反应过程中A和B的转化率之比为1∶1 |
D.从开始到平衡,用A表示该反应的化学反应速率为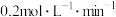 |
您最近一年使用:0次
2023-04-23更新
|
252次组卷
|
2卷引用:安徽省合肥六校联盟2022-2023学年高一下学期期中联考化学试题
名校
解题方法
3 . 下列图示与对应的叙述相符的是


A.图1表示反应: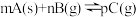  在一定温度下,B的平衡转化率(B%)与压强变化的关系如图所示,则x点正反应速率大于逆反应速率 在一定温度下,B的平衡转化率(B%)与压强变化的关系如图所示,则x点正反应速率大于逆反应速率 |
B.图2是可逆反应:  的速率时间图像,在t1时刻改变条件只能是加入催化剂 的速率时间图像,在t1时刻改变条件只能是加入催化剂 |
C.图3表示对于化学反应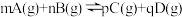 ,A的百分含量与温度(T)的变化情况,则该反应的 ,A的百分含量与温度(T)的变化情况,则该反应的 |
| D.图4所示图中的阴影部分面积的含义是该物质物质的量的变化量 |
您最近一年使用:0次
2021-11-13更新
|
1012次组卷
|
11卷引用:安徽省黄山市屯溪第一中学2023-2024学年高一上学期11月月考 化学试题
安徽省黄山市屯溪第一中学2023-2024学年高一上学期11月月考 化学试题安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题安徽省黄山市2022-2023学年高二上学期期末考试化学试题湖北省华中师范大学第一附属中学2021-2022学年高二上学期期中检测化学试题湖北省襄阳市第五中学2022-2023学年高二上学期9月化学试题湖北省恩施市第一中学2022-2023学年高二上学期11月月考化学试题黑龙江省哈尔滨市德强学校2022-2023学年高二上学期期末考试化学试题河南省南阳市第一中学校2022-2023学年高二上学期第二次月考化学试题辽宁省东北育才中学少儿部2023-2024学年高二上学期第一次月考化学试题重庆市三峡名校联盟2023-2024学年高二上学期12月月考化学试题江苏省江阴市华士高级中学2023-2024学年高二上学期12月学情调研化学(选修)试卷
名校
4 . 反应:L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )

 bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
| A.上述反应是放热反应 | B.上述反应是吸热反应 |
| C.a+1>b | D.a+1<b |
您最近一年使用:0次
2019-10-11更新
|
63次组卷
|
3卷引用:安徽省阜阳市阜南县实验中学2019-2020学年高一下学期6月月考化学试题
安徽省阜阳市阜南县实验中学2019-2020学年高一下学期6月月考化学试题(已下线)2010—2011学年浙江省海盐元济高级中学高二3月月考化学试卷宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题
名校
5 . 反应N2O4(g) 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的转化率:b>c |
| D.由b点到a点,可以用加热的方法 |
您最近一年使用:0次
2018-07-25更新
|
3282次组卷
|
11卷引用:安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题
安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题【全国校级联考】辽宁省抚顺市六校2017-2018学年高一下学期期末考试化学试题安徽省宣城市郎溪县郎溪中学2018-2019学年高二上学期直升部返校考化学试题四川省成都市外国语学校2019届高三上学期开学考试化学试题吉林省长春汽车经济开发区第六中学2018-2019学年高二上学期第一次月考化学试题福建省莆田市私立一中2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——化学反应速率及其影响因素专练(已下线)2.3.3 温度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)黑龙江省大庆市东风中学2021-2022学年高二上学期期中考试化学试题福建省福州第三中学2022-2023学年高二上学期半期考试化学试题福建省漳州市正兴学校2023-2024学年高二上学期10月月考化学试卷
名校
6 . 在容积一定的密闭容器中,反应A2(g)+B2(g) xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间)
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间)
 xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间)
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) 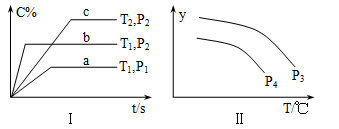
| A.P3<P4,y为A2转化率 |
| B.P3<P4,y为A2浓度 |
| C.P3>P4,y为混合气密度 |
| D.P3>P4,y为C的体积分数 |
您最近一年使用:0次
2017-02-17更新
|
336次组卷
|
5卷引用:安徽省六安市第一中学2019-2020学年高一下学期期末考试化学试题
7 . 可逆反应m A(s)+n B(g) e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是
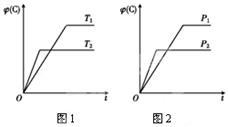
 e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是
| A.平衡后,若使用催化剂,C的体积分数将增大 |
| B.平衡后,若温度升高,化学平衡向正反应方向移动 |
| C.平衡后,增加A的质量化学平衡向正反应方向移动 |
| D.化学方程式中,化学计量数的关系为n<e +f |
您最近一年使用:0次
2016-09-22更新
|
474次组卷
|
4卷引用:安徽省定远重点中学2017-2018学年高一下学期教学段考化学试题



