解题方法
1 . 氮及其化合物在生产、生活中具有广泛的应用。
(1)已知一定条件下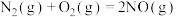
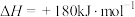 。1mol
。1mol 分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则
分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则 的键能为
的键能为___________ 。
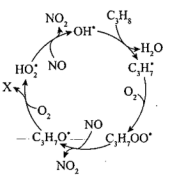
(2)某些过氧由基可以将NO氧化为 ,其反应机理如图所示(标*的为自由基)。X的分子式为
,其反应机理如图所示(标*的为自由基)。X的分子式为___________ ,总反应的化学方程式为___________ 。
(3)反应 的速率方程可表示为
的速率方程可表示为 ,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
根据表中数据计算,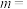
___________ ,
___________ 。温度为650K时该反应的速率常数
___________ 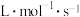 。
。
(4) 储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,反应的化学方程式:
,反应的化学方程式: 。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
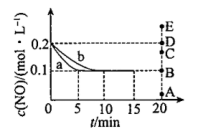
①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线___________ 。
②曲线b表示的反应前10min内CO的平均反应速率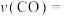
___________  。
。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是___________ 点。
(1)已知一定条件下
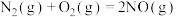
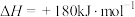 。1mol
。1mol 分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则
分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则 的键能为
的键能为(2)某些过氧由基可以将NO氧化为
 ,其反应机理如图所示(标*的为自由基)。X的分子式为
,其反应机理如图所示(标*的为自由基)。X的分子式为
(3)反应
 的速率方程可表示为
的速率方程可表示为 ,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:| 实验编号 | 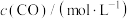 | 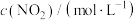 | 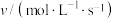 |
| ① | 0.025 | 0.040 | 2.2×10-4 |
| ② | 0.050 | 0.040 | 4.4×10-4 |
| ③ | 0.025 | 0.120 | 6.6×10-4 |
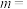


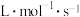 。
。(4)
 储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,反应的化学方程式:
,反应的化学方程式: 。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线
②曲线b表示的反应前10min内CO的平均反应速率
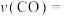
 。
。③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是
您最近半年使用:0次
解题方法
2 . 向2L恒容密闭容器中同时加入2
 和6
和6
 ,在催化剂作用下,发生反应:
,在催化剂作用下,发生反应:
ⅰ.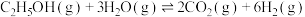

ⅱ.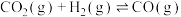

 。
。
平衡时 和
和 的选择性[CO的选择性
的选择性[CO的选择性 ]及
]及 的产率随温度的变化如图所示。下列说法错误的是
的产率随温度的变化如图所示。下列说法错误的是

 和6
和6
 ,在催化剂作用下,发生反应:
,在催化剂作用下,发生反应:ⅰ.
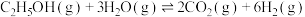

ⅱ.
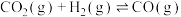

 。
。平衡时
 和
和 的选择性[CO的选择性
的选择性[CO的选择性 ]及
]及 的产率随温度的变化如图所示。下列说法错误的是
的产率随温度的变化如图所示。下列说法错误的是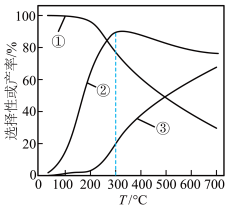
A.某温度下平衡后,向该容器中再加入1 乙醇,乙醇的平衡转化率会减小 乙醇,乙醇的平衡转化率会减小 |
| B.即使采用更高效的催化剂,反应ⅰ的正、逆反应的活化能之差也不变 |
| C.300℃之后以反应ⅰ为主 |
D.乙醇的平衡转化率为80%、 的选择性为60%时, 的选择性为60%时,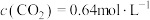 |
您最近半年使用:0次
名校
3 . 我国向世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳捕捉和碳利用技术则是关键,其中 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: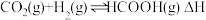 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
(1)已知: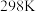 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。
则
_________  ,此条件下
,此条件下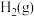 的燃烧热
的燃烧热
________ (填“大于”、“小于”或“等于”) 的燃烧热
的燃烧热 。
。
(2) 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
(3)恒容密闭容器中充入一定量的 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。
(4)恒温、恒容的密闭容器中充入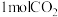 ,
,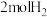 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
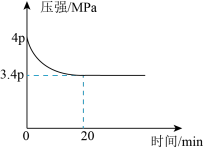
① ,用
,用 表示的化学反应速率为
表示的化学反应速率为___________ 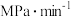 ;
;
②此反应的分压平衡常数
___________ ( 为以分压表示的平衡常数,
为以分压表示的平衡常数,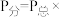 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: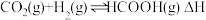 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:(1)已知:
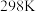 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。| 物质 |  | 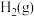 |  |
相对能量/( ) ) |  | 0 |  |

 ,此条件下
,此条件下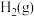 的燃烧热
的燃烧热
 的燃烧热
的燃烧热 。
。(2)
 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。A.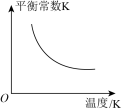 | B.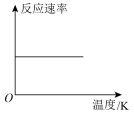 | C.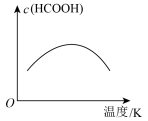 | D. |
(3)恒容密闭容器中充入一定量的
 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。A.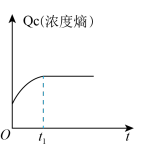 | B. | C. | D. |
(4)恒温、恒容的密闭容器中充入
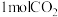 ,
,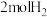 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
①
 ,用
,用 表示的化学反应速率为
表示的化学反应速率为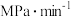 ;
;②此反应的分压平衡常数

 为以分压表示的平衡常数,
为以分压表示的平衡常数,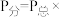 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
您最近半年使用:0次
名校
解题方法
4 . 将 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: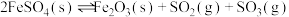 。平衡时
。平衡时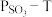 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: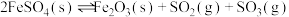 。平衡时
。平衡时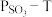 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.当容器中 时,说明该反应处于平衡状态 时,说明该反应处于平衡状态 |
| B.由图可知,此反应随着温度升高,反应速率增大,平衡常数减小 |
C.660K时,该反应的平衡总压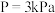 、平衡常数 、平衡常数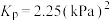 |
D.升高温度,上述容器中进一步发生反应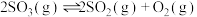 ,平衡时 ,平衡时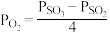 |
您最近半年使用:0次
名校
解题方法
5 . 关于煤的处理是工业重要的生产工艺,从煤的气化到液化是重要环节。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:
Ⅰ.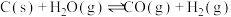

Ⅱ.
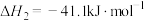
①下列说法正确的是_______ 。
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系_______ (填“吸收”或“放出”)热量_______ kJ,反应Ⅰ的平衡常数
_______ MPa(以分压表示,分压=总压×物质的量分数)。
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为
 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
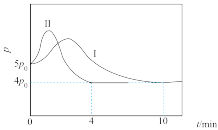
①曲线Ⅱ所对应的改变的条件可能为_______ 。
②体系总压强先增大的原因为_______ ,后减小的原因为_______ 。
③该条件下 的平衡转化率为
的平衡转化率为_______ %(结果保留三位有效数字)。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和
 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:Ⅰ.
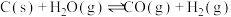

Ⅱ.

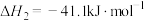
①下列说法正确的是
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率②反应平衡时,
 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为

 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
①曲线Ⅱ所对应的改变的条件可能为
②体系总压强先增大的原因为
③该条件下
 的平衡转化率为
的平衡转化率为
您最近半年使用:0次
名校
解题方法
6 . 在恒容密闭容器中通入X并发生反应:2X(g)=Y(g),T1、T2温度下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是


| A.该反应进行到M点放出的热量大于进行到W点放出的热量 |
| B.T2温度下,在0- t1,时间内,v(Y)=a-b/t1mol·L-1min-1 |
| C.该反应的ΔH<0 |
| D.M点时向容器内充入一定量惰性气体,平衡向正反应方向移动 |
您最近半年使用:0次
2023-12-27更新
|
111次组卷
|
2卷引用:安徽省马鞍山市当涂第一中学2023-2024学年高二上学期1月期末化学试题
名校
7 . 一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应: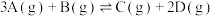 。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
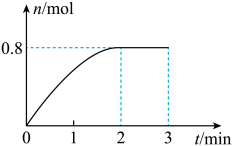
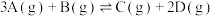 。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
| A.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
| B.2 min后,通入Ne气会使正反应速率加快,逆反应速率也加快 |
| C.反应过程中A和B的转化率之比为1∶1 |
D.从开始到平衡,用A表示该反应的化学反应速率为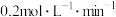 |
您最近半年使用:0次
2023-04-23更新
|
250次组卷
|
2卷引用:安徽省合肥六校联盟2022-2023学年高一下学期期中联考化学试题
解题方法
8 . 一定温度下,在甲、乙、丙三个体积均为1L的恒容密闭容器中发生甲醇合成二甲醚的反应: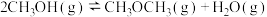 ,起始时各物质的物质的量及平衡时各物质的物质的量如表所示。下列说法错误的是
,起始时各物质的物质的量及平衡时各物质的物质的量如表所示。下列说法错误的是
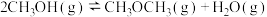 ,起始时各物质的物质的量及平衡时各物质的物质的量如表所示。下列说法错误的是
,起始时各物质的物质的量及平衡时各物质的物质的量如表所示。下列说法错误的是| 容器 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
 |  |  | ||
| 甲 | 387 | 0.20 | 0.080 | 0.080 |
| 乙 | 387 | 0.40 | ||
| 丙 | 207 | 0.20 | 0.090 | 0.090 |
| A.该反应的正反应为放热反应 |
| B.甲容器中反应比丙容器中反应达到平衡状态所需时间长 |
C.平衡时,甲、乙容器中 的转化率相同 的转化率相同 |
D.若起始时向甲容器中充入 、 、 和 和 ,则反应向正反应方向进行 ,则反应向正反应方向进行 |
您最近半年使用:0次
解题方法
9 . 现有下列三个图像:

A.N2(g) + 3H2(g) 2NH3(g) △H<0 2NH3(g) △H<0 |
B.2SO3(g)  2SO2(g) +O2(g) △H>0 2SO2(g) +O2(g) △H>0 |
C.2HI(g)  H2(g) + I2(g) △H>0 H2(g) + I2(g) △H>0 |
D.4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) △H<0 4NO(g) + 6H2O(g) △H<0 |
您最近半年使用:0次
名校
10 . 在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
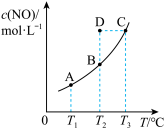
 CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
| A.该反应的ΔH > 0 |
| B.若该反应在T1、T2时的平衡常数分别为K1、K2 ,则K1 > K2 |
C.在T2时,若反应体系处于状态D,则此时一定有 正< 正< 逆 逆 |
| D.在T3时,若混合气体的平均摩尔质量不再变化,则可以判断反应达到平衡状态 |
您最近半年使用:0次
2022-11-28更新
|
151次组卷
|
2卷引用:安徽省亳州市第二完全中学2022-2023学年高二上学期期中教学质量检测化学试题



