名校
1 . 在密闭容器中发生如下反应:aA(g)+bB(g) cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
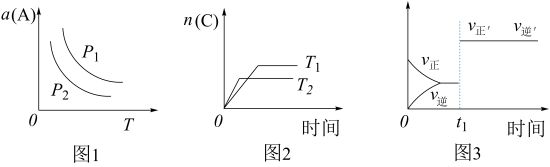
 cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
| A.如图1反应:若p1>p2,则该反应只能在高温下自发进行 |
| B.如图2反应:此反应的△H<0,且T1>T2 |
| C.如图3反应:表示t1时刻可能是使用催化剂对反应速率的影响 |
| D.如图3反应:表示t1时刻增大B的浓度对反应速率的影响 |
您最近一年使用:0次
2020-02-28更新
|
379次组卷
|
3卷引用:安徽省滁州市定远县育才学校2021-2022学年高二(普通班)下学期开学摸底考试化学试题
名校
解题方法
2 . 一定条件下正戊烷(CH3CH2CH2CH2CH3)发生两种裂解反应:
Ⅰ.CH3CH2CH2 CH2CH3 (g)⇋CH3CH===CH2(g)+CH3 CH3 (g) ΔH1=+274.2 kJ·mol-1
Ⅱ.CH3CH2CH2CH2CH3(g)⇋CH3CH2CH3(g)+CH2===CH2(g) ΔH2=+122.7 kJ·mol -1
回答下列问题:
(1)在恒温恒压的密闭容器中,充入一定量的正戊烷发生裂解反应,起始时容器体积为 a L,一段时间反应达到平衡后容器体积变为 b L,此时正戊烷的转化率 α(正戊烷)=_________ ;向反应体系中充入一定量的水蒸气(水 蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将_____ (填“增大”“减小”或“不变”),原因为_______________ 。
(2)温度为 T ℃时,往压强恒为 100 kPa 的密闭容器中充入 1 mol·L-1 CH3CH=CH2和 2 mol·L-1 CH3CH3发生反应:CH3CH===CH2(g)+CH3CH3(g) ⇋CH3CH2CH3(g)+CH2===CH2(g)ΔH3。测得 CH3CH2CH3的物质的量浓度随时间 t 的变化如图中曲线Ⅰ所示。
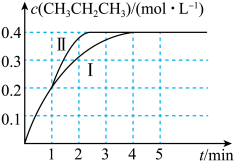
①ΔH3=_____ 。
②该反应的平衡常数 Kp=_____ 。(Kp 为以分压表示的平衡常数,分压=总压×物质的量分数,计算结果 保留 2 位小数)。
③若在 1 min 时,改变某一反应条件,曲线Ⅰ变为曲线Ⅱ,则改变的条件为_____ 。
(3)将 0.1 mol CH3CH3完全燃烧后的气体通入 100 mL 3 mol·L-1的 NaOH 溶液中,充分反应后所得溶液中离子浓度的大小顺序为_____ 。
(4)以稀硫酸为电解质溶液,CH3CH3燃料电池的负极反应式为_____ 。
Ⅰ.CH3CH2CH2 CH2CH3 (g)⇋CH3CH===CH2(g)+CH3 CH3 (g) ΔH1=+274.2 kJ·mol-1
Ⅱ.CH3CH2CH2CH2CH3(g)⇋CH3CH2CH3(g)+CH2===CH2(g) ΔH2=+122.7 kJ·mol -1
回答下列问题:
(1)在恒温恒压的密闭容器中,充入一定量的正戊烷发生裂解反应,起始时容器体积为 a L,一段时间反应达到平衡后容器体积变为 b L,此时正戊烷的转化率 α(正戊烷)=
(2)温度为 T ℃时,往压强恒为 100 kPa 的密闭容器中充入 1 mol·L-1 CH3CH=CH2和 2 mol·L-1 CH3CH3发生反应:CH3CH===CH2(g)+CH3CH3(g) ⇋CH3CH2CH3(g)+CH2===CH2(g)ΔH3。测得 CH3CH2CH3的物质的量浓度随时间 t 的变化如图中曲线Ⅰ所示。

①ΔH3=
②该反应的平衡常数 Kp=
③若在 1 min 时,改变某一反应条件,曲线Ⅰ变为曲线Ⅱ,则改变的条件为
(3)将 0.1 mol CH3CH3完全燃烧后的气体通入 100 mL 3 mol·L-1的 NaOH 溶液中,充分反应后所得溶液中离子浓度的大小顺序为
(4)以稀硫酸为电解质溶液,CH3CH3燃料电池的负极反应式为
您最近一年使用:0次
11-12高三上·安徽·阶段练习
名校
解题方法
3 . 温度为T0时,在容积固定的密闭容器中发生  未配平
未配平 反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为
反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为  、
、 时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
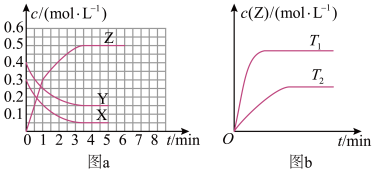
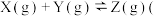 未配平
未配平 反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为
反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为  、
、 时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
A.发生反应时,各物质的反应速率大小关系为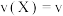 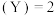 v v 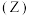 |
B.图a 中反应达到平衡时,Y 的转化率为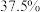 |
C. 时,该反应的平衡常数为 时,该反应的平衡常数为 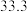 |
D.该反应正反应的反应热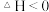 |
您最近一年使用:0次
2020-02-06更新
|
135次组卷
|
7卷引用:2012届安徽省安师大附中高三上学期第四次模拟考试化学试卷
(已下线)2012届安徽省安师大附中高三上学期第四次模拟考试化学试卷2015届安徽省六校教育研究会高三联考化学试卷【全国百强校】山西省临汾市第一中学2018-2019学年高二上学期10月月考化学试题(已下线)2019年4月14日《每日一题》三轮复习—— 每周一测北京市昌平区新学道临川学校2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡的图像分析(强化练习)辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题
4 . 煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2中Cl元素的价态为_______ 。
(2)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表:
①在NaClO2溶液脱硝的主要 反应中,参加反应的n(ClO2-):n(NO)=_________ ,增加压强,NO的转化率______ (填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐_______ (填“升高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______ 脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________ 。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如下图所示:
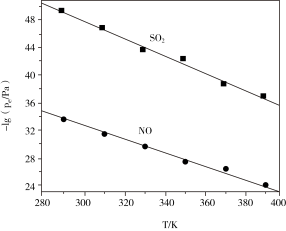
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____ (填“增大”“不变”或“减小”)。
②反应ClO2−+2SO32−===2SO42−+Cl−的平衡常数K表达式为___________ 。
(1)NaClO2中Cl元素的价态为
(2)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表:
| 离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
| c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①在NaClO2溶液脱硝的
②随着吸收反应的进行,吸收剂溶液的pH逐渐
③由实验结果可知,脱硫反应速率
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如下图所示:

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均
②反应ClO2−+2SO32−===2SO42−+Cl−的平衡常数K表达式为
您最近一年使用:0次
名校
5 . 反应N2O4(g) 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是

 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
| A.A、C两点的反应速率:A>C |
| B.A、C两点气体的颜色:A深,C浅 |
| C.A、B两点气体的平均相对分子质量:A>B |
| D.B、C两点化学平衡常数:B<C |
您最近一年使用:0次
2020-01-19更新
|
283次组卷
|
16卷引用:安徽省合肥市六校2019-2020学年高二上学期期末考试化学试题
安徽省合肥市六校2019-2020学年高二上学期期末考试化学试题(已下线)2011-2012学年江西省高安中学高二下学期期中考试化学试卷(已下线)2014高考名师推荐化学化学平衡图像的分析2015-2016学年辽宁省沈阳二中高二上10月月考化学试卷2015-2016学年海南省嘉积中学高二上12月段考化学试卷2016届福建省三明一中高三上学期第二次月考化学试卷湖北省宜昌市葛洲坝中学2017-2018学年高二上学期期中考试化学试题内蒙古杭锦后旗奋斗中学2018届高三上学期第三次月考化学试题四川省阆中中学2017-2018学年高二下学期第一次月考化学试题福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题【全国百强校】江苏省南菁高级中学2017-2018学年高二下学期期中考试化学试题【百强校首发】四川省成都市双流棠湖中学2019-2020学年高二下学期第一次在线月考化学试题江西省宜春中学 高安二中 上高二中 樟树中学 丰城中学五校2021届高三上学期联考化学试题福建省泰宁第一中学2020届高三上学期第二次阶段考试化学试题黑龙江省哈尔滨市三中2021-2022学年高二上学期第一学段考试化学(理科)试题江西省宜春市万载中学2021-2022学年高二上学期第二次月考化学试题
解题方法
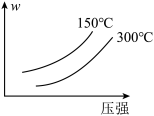
6 . 可逆反应A2 + 3B2(?) 2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是
2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是
 2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是
2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是
| A.该反应为吸热反应 |
| B.反应物B2为气体 |
| C.升高温度,逆反应速率减慢 |
| D.增大压强,A2转化率减小 |
您最近一年使用:0次
名校
解题方法
7 . COCl2的分解反应为: COCl2(g)=Cl2(g)+CO(g) △H=+108 kJ•mol-1。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是
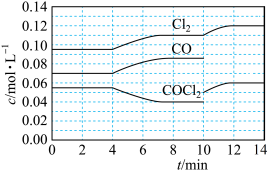

| A.第 4min 时,改变的反应条件是升高温度 |
| B.第 6min 时,V 正(COCl2)>V 逆(COCl2) |
| C.第 8min 时的平衡常数 K=2.34 |
| D.第 10min 到 14min 未标出 COCl2的浓度变化曲线 |
您最近一年使用:0次
2020-01-01更新
|
364次组卷
|
5卷引用:安徽省合肥市第十中学2021届高三第三次阶段检测化学试题
安徽省合肥市第十中学2021届高三第三次阶段检测化学试题河南省郑州市2020届高三第一次模拟考试化学试题2020届高三《新题速递·化学》1月第02期(考点01-06)(已下线)第22讲 化学平衡常数及转化率的计算(精练)-2022年高考化学一轮复习讲练测河南省郑州市郊县2020-2021学年高二上学期期中考试化学试题
11-12高三上·湖南·阶段练习
名校
解题方法
8 . 可逆反应aA(g)+bB(g)⇌ cC(g)+dD(g)△H同时符合下列两图中各曲线的是


| A.a+b>c+d T1>T2 △H>0 | B.a+b>c+d T1<T2 △H<0 |
| C.a+b<c+d T1>T2 △H>0 | D.a+b<c+d T1<T2 △H<0 |
您最近一年使用:0次
2019-12-19更新
|
1812次组卷
|
51卷引用:2013-2014学年安徽师大附中高二下学期期中考查化学试卷
(已下线)2013-2014学年安徽师大附中高二下学期期中考查化学试卷安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题(已下线)2011届湖南省十二校联考高三上学期第一次考试化学试卷(已下线)2012-2013学年山东济宁鱼台一中高二上学期期中考试化学试卷(已下线)2013-2014学年福建省长乐第一中学高二上学期第二次月考化学试卷2015-2016学年湖北省襄州区一中高二上学期10月月考化学试卷2016届黑龙江省哈尔滨三十二中高三上学期期末考试化学试卷2016-2017学年湖南省衡阳一中高二上10月月考化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷河北省正定中学2016-2017学年高一下学期期末考试化学试题【区级联考】天津市武清区2018-2019学年高二上学期期中质量调查化学试题浙江省宁波市余姚中学2018-2019学年高二上学期期中考试化学试题陕西省渭南市渭南中学2018-2019学年高二上学期第三次月考化学试题山东省沂水外国语2018-2019学年高二上学期第三次月考化学试卷青海省海东市第二中学2018-2019学年高一下学期期中考试化学试题辽宁省大连海湾高级中学2019-2020学年高二上学期第一次质量检测化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析海南省海南枫叶国际学校2019-2020学年高二上学期期中考试化学试题江苏省盐城市大丰区新丰中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市会泽县第一中学2019-2020高二上学期开学考试化学试题河北省衡水市第十四中学2019-2020学年高二上学期第三次调研考试化学试题河北省新乐市第一中学2019-2020学年高二上学期第二次月考化学试题山东省枣庄市滕州市第一中学2019-2020高二上学期期末考试化学试题辽宁省大连市瓦房店市实验高级中学2020-2021学年高二上学期10月月考化学试题吉林省吉林市第二中学2021届高三上学期9月份考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题天津市宝坻九中2020-2021学年高二上学期第一次月考化学试题天津市静海瀛海学校2020-2021学年高二上学期11月联考化学试题四川省成都市实验外国语学校(西区)2020-2021学年高二上学期12月月考化学测试卷福建省泉州市2020-2021学年高二上学期期末教学质量跟踪监测化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期中考试化学(理)试题陕西省咸阳市泾干中学2021-2022学年高二上学期第二次月考化学试题山西省运城市芮城中学2021-2022学年高二上学期阶段性月考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题河南省新蔡县第一高级中学2021-2022学年高二上学期9月月考化学试题湖南省临澧县第一中学2021-2022学年高二上学期期中段考化学试题(已下线)2.3.3 化学平衡中的图像问题(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)湖南省常德市临澧县第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题广东省惠州市博罗县2022-2023学年高二上学期期中考试化学试题陕西省渭南市尚德中学2022-2023学年高二上学期第一次质量检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第一中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市兆麟中学2023-2024学年高二上学期第一次月考化学试题广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题广东省普宁二中实验学校2023-2024学年高二上学期第三次月考化学试题青海省西宁市海湖中学2023-2024学年高二下学期开学考试化学试卷
名校
9 . 在一定条件下,固定容积的密闭容器中反应2NO2(g) O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )
O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )
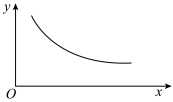
 O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )
O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )
| A.当X表示压强时,Y表示NO2的转化率 |
| B.当X表示温度时,Y表示O2的物质的量 |
| C.当X表示反应时间时,Y表示混合气体的密度 |
| D.当X表示NO2的物质的量时,Y表示O2的物质的量 |
您最近一年使用:0次
2019-12-15更新
|
87次组卷
|
5卷引用:【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题
名校
10 . 在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)⇌xC(g),符合如图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
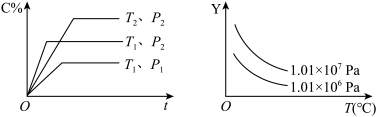

| A.反应物A的百分含量 | B.平衡混合气体中物质B的百分含量 |
| C.平衡混合气体的密度 | D.平衡混合气体的平均摩尔质量 |
您最近一年使用:0次
2019-12-05更新
|
268次组卷
|
16卷引用:安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题
安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题(已下线)2010—2011学年浙江省嘉兴一中高二下学期期中考试化学试卷(已下线)2010-2011学年江苏省五校联考高二下学期期末考试化学试题(已下线)2011-2012年江苏宿迁泗洪县洪翔中学高二下学期期中考试化学试卷2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高二上期中化学卷2015-2016学年甘肃省甘谷一中高二上期末化学试卷浙江省温州市求知中学2018-2019学年高二上学期期中考试(选考)化学试题内蒙古自治区固阳县一中2018-2019学年高二上学期期中考试理科综合化学试题云南省普洱市澜沧县第一中学2018-2019学年高二下学期期末考试化学试题甘肃省定西市岷县第一中学2019-2020学年高二下学期开学测试化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精练)-2021年高考化学一轮复习讲练测吉林省抚松县第六中学2020-2021学年高二下学期摸底考试化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期期中考试化学试题重庆市黔江中学校2022-2023学年高二上学期10月考试化学试卷



