名校
1 . 在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
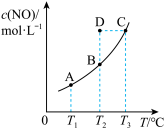
 CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
| A.该反应的ΔH > 0 |
| B.若该反应在T1、T2时的平衡常数分别为K1、K2 ,则K1 > K2 |
C.在T2时,若反应体系处于状态D,则此时一定有 正< 正< 逆 逆 |
| D.在T3时,若混合气体的平均摩尔质量不再变化,则可以判断反应达到平衡状态 |
您最近一年使用:0次
2022-11-28更新
|
151次组卷
|
2卷引用:安徽省亳州市第二完全中学2022-2023学年高二上学期期中教学质量检测化学试题
解题方法
2 . 落实“双碳”目标,发展绿色能源,首先是对氢能源的开发利用。利用甲烷制氢是当前研究的热点。涉及的反应如下:
反应Ⅰ: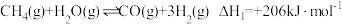
反应Ⅱ: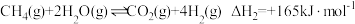
反应Ⅲ:
回答下列问题:
(1)反应Ⅰ的活化能为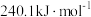 ,反应Ⅰ逆反应的活化能为
,反应Ⅰ逆反应的活化能为_______  。研究发现,以单一负载型
。研究发现,以单一负载型 催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生
催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生 吸附,在活性位“#”上被吸附的
吸附,在活性位“#”上被吸附的 发生分解反应生成表面碳,表面碳再与
发生分解反应生成表面碳,表面碳再与 结合生成
结合生成 ,其催化反应机理的反应式如下:
,其催化反应机理的反应式如下:
ⅰ.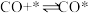 快速平衡
快速平衡
ⅱ.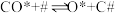 慢反应
慢反应
ⅲ.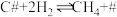 快反应
快反应
ⅳ._______ 快反应
反应ⅳ的反应式为_______ ;反应Ⅰ逆反应的决速步骤是_______ (填反应序号)。
(2) 时,在某密闭容器中通入一定量的
时,在某密闭容器中通入一定量的 和
和 ,加入金属镍做催化剂,在一定温度下发生上述反应。
,加入金属镍做催化剂,在一定温度下发生上述反应。
①为提高 的平衡转化率,除改变温度外,还可以采取的措施是
的平衡转化率,除改变温度外,还可以采取的措施是_______ 。
②恒温恒容条件下,起始时 和
和 的浓度分别为
的浓度分别为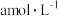 和
和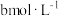 ,达平衡时
,达平衡时 和
和 的浓度分别为
的浓度分别为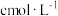 和
和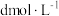 。达平衡时,
。达平衡时, 的浓度是
的浓度是_______  ,反应Ⅰ的平衡常数K是
,反应Ⅰ的平衡常数K是_______ 。(用含a、b、c、d的代数式表示)
③在该温度下,反应Ⅲ的标准平衡常数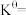
_______ 。[已知:分压=总压×该组分物质的量分数,对于反应 ,
,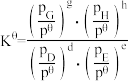 ,其中
,其中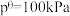 ,
,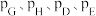 为各组分的平衡分压]
为各组分的平衡分压]
(3)在某一给定进料比的情况下,温度、压强对平衡体系中 物质的量分数的影响如下图:
物质的量分数的影响如下图:
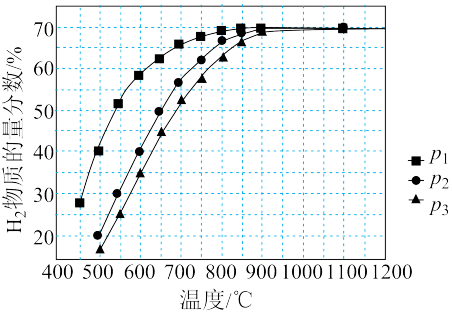
压强由大到小的顺序为_______ ,体系温度未达到 时,
时, 物质的量分数几乎为0的原因是
物质的量分数几乎为0的原因是_______ 。
反应Ⅰ:
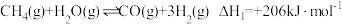
反应Ⅱ:
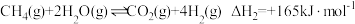
反应Ⅲ:

回答下列问题:
(1)反应Ⅰ的活化能为
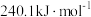 ,反应Ⅰ逆反应的活化能为
,反应Ⅰ逆反应的活化能为 。研究发现,以单一负载型
。研究发现,以单一负载型 催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生
催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生 吸附,在活性位“#”上被吸附的
吸附,在活性位“#”上被吸附的 发生分解反应生成表面碳,表面碳再与
发生分解反应生成表面碳,表面碳再与 结合生成
结合生成 ,其催化反应机理的反应式如下:
,其催化反应机理的反应式如下:ⅰ.
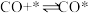 快速平衡
快速平衡ⅱ.
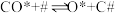 慢反应
慢反应ⅲ.
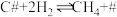 快反应
快反应ⅳ._______ 快反应
反应ⅳ的反应式为
(2)
 时,在某密闭容器中通入一定量的
时,在某密闭容器中通入一定量的 和
和 ,加入金属镍做催化剂,在一定温度下发生上述反应。
,加入金属镍做催化剂,在一定温度下发生上述反应。①为提高
 的平衡转化率,除改变温度外,还可以采取的措施是
的平衡转化率,除改变温度外,还可以采取的措施是②恒温恒容条件下,起始时
 和
和 的浓度分别为
的浓度分别为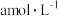 和
和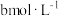 ,达平衡时
,达平衡时 和
和 的浓度分别为
的浓度分别为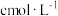 和
和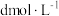 。达平衡时,
。达平衡时, 的浓度是
的浓度是 ,反应Ⅰ的平衡常数K是
,反应Ⅰ的平衡常数K是③在该温度下,反应Ⅲ的标准平衡常数
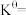
 ,
,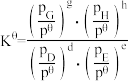 ,其中
,其中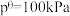 ,
,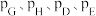 为各组分的平衡分压]
为各组分的平衡分压](3)在某一给定进料比的情况下,温度、压强对平衡体系中
 物质的量分数的影响如下图:
物质的量分数的影响如下图:
压强由大到小的顺序为
 时,
时, 物质的量分数几乎为0的原因是
物质的量分数几乎为0的原因是
您最近一年使用:0次
2022-11-09更新
|
482次组卷
|
5卷引用:安徽省合肥市肥东县综合高中2022-2023学年高三上学期期末考试化学试题
安徽省合肥市肥东县综合高中2022-2023学年高三上学期期末考试化学试题山东省潍坊市2022-2023学年高三上学期期中考试化学考试题山东省2022~2023学年高三上学期期中考试化学试题(已下线)化学(全国乙卷单科卷)-学易金卷:2023年高考第一次模拟考试卷山东省潍坊高密市第三中学2023-2024学年高三11月月考化学试题
名校
解题方法
3 . 对于可逆反应mA(s)+nB(g)⇌eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是
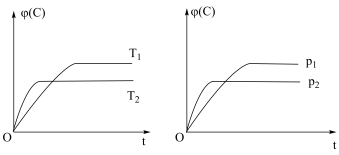

| A.达到平衡后,若使用催化剂,C的体积分数将增大 |
| B.该反应的ΔH<0 |
| C.化学方程式中,n>e+f |
| D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
您最近一年使用:0次
2022-09-19更新
|
880次组卷
|
24卷引用:安徽省蚌埠市怀远禹泽、固镇县汉兴学校2023-2024学年高二上学期12月期末联考化学试题
安徽省蚌埠市怀远禹泽、固镇县汉兴学校2023-2024学年高二上学期12月期末联考化学试题黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期(A)班月考化学试题山东省淄博市淄川中学2019-2020学年高二上学期期中考试化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高二上学期期中考试化学试题湖南省岳阳市平江县第一中学2020-2021学年高二上学期10月联考化学试题甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题天津市武清区杨村第一中学2021-2022学年高二上学期第一次月考化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题天津市静海区四校2021-2022学年高二上学期11月阶段性检测化学试题(已下线)专题2 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题湖南省益阳市箴言中学2021-2022学年高二上学期第三次月考化学试题三峡名校联盟2021-2022学年高二上学期联考化学试题天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题河南省温县第一高级中学2022-2023学年高二上学期第二次月考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高二上学期期中考试化学试题浙江省杭州市长河高级中学2022-2023学年高二上学期期中考试化学试题章末检测卷(二)化学反应的方向、限度与速率黑龙江省齐齐哈尔市第八中学校2022-2023学年高二上学期11月期中考试化学试题浙江省台州市台州八校联盟2022-2023学年高二上学期11月期中联考化学试题山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第一次质量检测化学试题天津市北辰区2023-2024学年高二上学期期中考试化学试题湖北省部分高中联考协作体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 将二氧化碳转化为甲醇等液体燃料是理想的能源补充形式。二氧化碳加氢制甲醇的反应原理为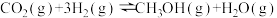 ,
, 。回答下列问题:
。回答下列问题:
(1)不同温度下,向2L的恒容密闭容器中充入1molCO2和3molH2反应相同一段时间,得到以下关系图:
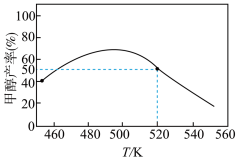
520K时,若增加CO2的浓度,能___________ (填“提高”或“降低”)H2的转化率,此时该反应的平衡常数K=___________ 。在该温度下,再向容器中加入H2和CH3OH(g)各1mol,平衡将___________ (填“正向移动”“逆向移动”或“不移动”)。
(2)在温度t1、t2、t3下,分别将等物质的量的CO2和H2投入到三个等容容器中发生上述反应,平衡时CH3OH(g)的物质的量分数与温度﹑压强的关系如下图所示:
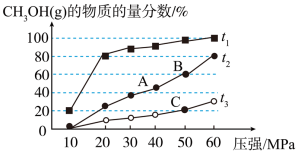
①由上图可知t1、t2、t3的大小关系为___________ 。
②下列说法正确的是___________ (填标号)。
A.采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO2的转化率
B.平衡常数:KB>KC
C.在t1温度、20MPa状态下再通入等物质的量的CO2和H2,达新平衡时H2的体积分数减小
D.t3温度下,混合气体的密度不随时间的变化而变化说明反应已达平衡
(3)工业上可利用CO(g)和H2O(g)来制氢气。已知反应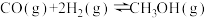
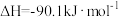 ;则利用CO(g)和H2O(g)来制氢气的热化学方程式为
;则利用CO(g)和H2O(g)来制氢气的热化学方程式为___________ 。
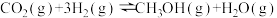 ,
, 。回答下列问题:
。回答下列问题:(1)不同温度下,向2L的恒容密闭容器中充入1molCO2和3molH2反应相同一段时间,得到以下关系图:

520K时,若增加CO2的浓度,能
(2)在温度t1、t2、t3下,分别将等物质的量的CO2和H2投入到三个等容容器中发生上述反应,平衡时CH3OH(g)的物质的量分数与温度﹑压强的关系如下图所示:

①由上图可知t1、t2、t3的大小关系为
②下列说法正确的是
A.采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO2的转化率
B.平衡常数:KB>KC
C.在t1温度、20MPa状态下再通入等物质的量的CO2和H2,达新平衡时H2的体积分数减小
D.t3温度下,混合气体的密度不随时间的变化而变化说明反应已达平衡
(3)工业上可利用CO(g)和H2O(g)来制氢气。已知反应
 ;则利用CO(g)和H2O(g)来制氢气的热化学方程式为
;则利用CO(g)和H2O(g)来制氢气的热化学方程式为
您最近一年使用:0次
名校
5 . 现有下列四个图像:
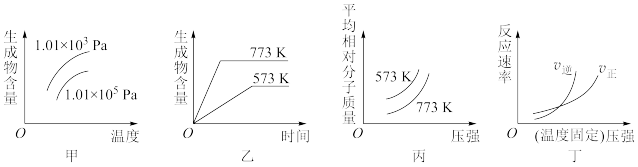
下列反应中全部符合上述图像的反应是

下列反应中全部符合上述图像的反应是
| A.N2(g)+3H2(g)⇌2NH3(g) ΔH1<0 |
| B.2SO3(g)⇌2SO2(g)+O2(g) ΔH2>0 |
| C.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH3<0 |
| D.H2(g)+CO(g)⇌C(s)+H2O(g) ΔH4>0 |
您最近一年使用:0次
2021-12-28更新
|
638次组卷
|
45卷引用:2015-2016学年安徽省宣城郎溪中学高二上学期第三次月考化学试卷
2015-2016学年安徽省宣城郎溪中学高二上学期第三次月考化学试卷(已下线)2011届山东省潍坊市诸城一中高三12月阶段测试化学试卷(已下线)2011-2012年黑龙江双鸭山一中高二上学期期中考试化学试卷(已下线)2012-2013学年山东省威海市高二上学期期末考试化学试卷(已下线)2014-2015学年河南省汝州市高二上学期第一次月考化学试卷(已下线)2014-2015学年湖南省衡阳市第八中学高二上学期期中考试化学试卷2015-2016学年黑龙江省红兴隆第一高级中学高二上期中理科化学试卷2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷2015-2016学年贵州省思南中学高二上二次月考化学试卷2016届陕西省蒲城尧山补习学校高三上学期第四次质检化学试卷2015-2016学年辽宁师大附中高一下学期6月月考化学试卷2016-2017学年辽宁省大连市第二十中学高二上9月月考化学试卷2016-2017学年黑龙江省铁人中学高二上开学测化学卷2017届湖北省武钢三中高三上学期11月月考化学试卷2018版化学(苏教版)高考总复习专题七题型冲关--巧解平衡及速率图像题甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题湖北省华中师范大学第一附属中学2018届高三上学期期中考试化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题【市级联考】湖南省娄底市2018-2019学年高二上学期期中考试化学试题江苏省泰州市第二中学2017-2018学年高二上学期期中考试化学试题云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题【校级联考】湖北省宜昌市协作体2018-2019学年高二上学期期末考试化学试题江西省赣州市南康中学2019-2020学年高二上学期第一次月考化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2019-2020学年高二上学期期中考试化学试题甘肃省定西市岷县第二中学2019-2020学年高二上学期期中考试化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题甘肃省兰州市第十中学、民族中学2019-2020学年高二上学期期末考试化学试题广西钦州市2019-2020学年高二下学期期末教学质量监测化学试题河南省兰考县第三高级中学卫星试验部2020-2021学年高二上学期第一次月考化学试题辽宁省联合校2020-2021学年高二上学期第一次月考化学试题江西省南昌市第十中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市第一中学2021-2022学年高二上学期学情反馈(一)化学试题河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题湖北省十堰市2016-2017学年高二上学期期末调研考试化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二上学期期中考试化学试题江苏省盐城市大丰区新丰中学2021-2022学年高二上学期期中考试化学(选修)试题云南省丽江市第一高级中学2021-2022学年高二上学期元月考化学试题江苏省徐州市睢宁县第一中学2021-2022学年高二下学期第一次月考化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省竹溪县第二高级中学2021-2022学年高二上学期12月月考化学试题
6 . 在体积均为1.0L的恒容密闭容器甲、乙中,起始投料量如表,在不同温度下发生反应:CO2(g)+C(s) 2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是

 2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是| 容器 | n(CO2)/mol | n(C)/mol | n(CO)/mol |
| 甲 | 0.1 | 0.3 | 0 |
| 乙 | 0 | 0 | 0.4 |

| A.曲线Ⅰ对应的是甲容器 |
| B.a、b两点所处状态的压强大小关系:9pa>14pb |
C.c点:CO的体积分数>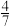 |
| D.900K时,若起始向容器乙中加入CO、CO2、C各1mol,则v(正)>v(逆) |
您最近一年使用:0次
2021-12-27更新
|
2466次组卷
|
15卷引用:安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷
安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷上海市金山区2022届高三一模化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)江西省宜春市奉新县第一中学2021-2022学年高二下学期第一次月考化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题山东省青岛第二中学2022-2023学年高二上学期期中考试化学试题辽宁省大连市滨城高中联盟2022-2023学年高二上学期期中考试化学试题湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题湖南省攸县第三中学2022-2023学年高三第六次月考化学试题湖南省常德市第一中学2023届高三第五次月考化学试题山东省滕州市第一中学2023-2024学年高二上学期10月月考化学试题河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
7 . 向体积为2L的恒容密闭容器中通入1.5mol CH4(g)和1.5 mol H2O(g),发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。 在不同温度(Ta、Tb)下测得容器中n(CO) 随时间的变化曲线如图。下列说法正确的是
CO(g)+3H2(g)。 在不同温度(Ta、Tb)下测得容器中n(CO) 随时间的变化曲线如图。下列说法正确的是
 CO(g)+3H2(g)。 在不同温度(Ta、Tb)下测得容器中n(CO) 随时间的变化曲线如图。下列说法正确的是
CO(g)+3H2(g)。 在不同温度(Ta、Tb)下测得容器中n(CO) 随时间的变化曲线如图。下列说法正确的是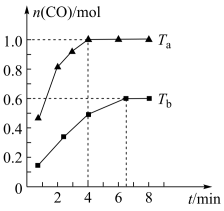
| A.Ta<Tb |
| B.该反应是放热反应 |
| C.Tb时,CH4的平衡转化率是60% |
D.Ta时,平衡后体系的压强为起始压强的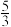 |
您最近一年使用:0次
2021-12-10更新
|
525次组卷
|
7卷引用:安徽省滁州市定远县育才学校2022-2023学年高二下学期期末化学试卷
名校
解题方法
8 . 下列图示与对应的叙述不相符的是
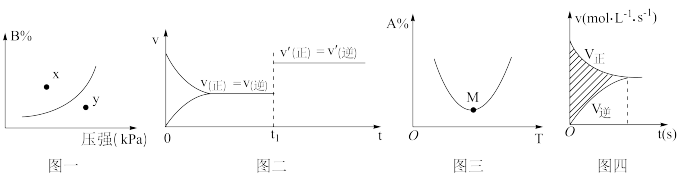

A.图一表示反应: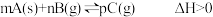 ,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系,则x点时 ,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系,则x点时 正> 正> 逆 逆 |
B.图二是可逆反应: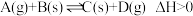 的速率时间图象,则在t1时刻改变条件可能是加入催化剂 的速率时间图象,则在t1时刻改变条件可能是加入催化剂 |
C.图三表示对于化学反应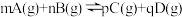 ,A的百分含量与温度(T)的变化情况,则该反应的 ,A的百分含量与温度(T)的变化情况,则该反应的 |
| D.图四所示图中的阴影部分面积的含义是反应物的物质的量减少量 |
您最近一年使用:0次
名校
9 . 分别在T1℃、T2℃、T3℃时,向三个500mL的恒容密闭容器中均充入1molN2和2.5molH2,发生反应:N2(g)+3H2(g) 2NH3(g) △H<0。实验测得反应tmin时N2的体积分数如图所示。下列说法正确的是
2NH3(g) △H<0。实验测得反应tmin时N2的体积分数如图所示。下列说法正确的是
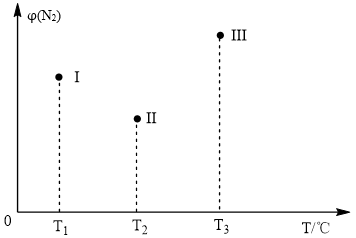
 2NH3(g) △H<0。实验测得反应tmin时N2的体积分数如图所示。下列说法正确的是
2NH3(g) △H<0。实验测得反应tmin时N2的体积分数如图所示。下列说法正确的是
| A.tmin时,Ⅱ和Ⅲ一定达到平衡 |
| B.2v(NH3)=3v(H2)时,三容器均达平衡状态 |
| C.平衡后容器Ⅰ中混合气体平均相对分子质量最小 |
| D.已知tmin时,Ⅲ中c(N2)=1mol•L-1,此时反应平衡常数K=0.5 |
您最近一年使用:0次
2021-11-14更新
|
171次组卷
|
4卷引用:安徽省宣城市六校2021-2022学年高二上学期期中联考化学试题
名校
解题方法
10 . 下列图示与对应的叙述相符的是


A.图1表示反应: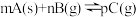  在一定温度下,B的平衡转化率(B%)与压强变化的关系如图所示,则x点正反应速率大于逆反应速率 在一定温度下,B的平衡转化率(B%)与压强变化的关系如图所示,则x点正反应速率大于逆反应速率 |
B.图2是可逆反应:  的速率时间图像,在t1时刻改变条件只能是加入催化剂 的速率时间图像,在t1时刻改变条件只能是加入催化剂 |
C.图3表示对于化学反应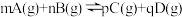 ,A的百分含量与温度(T)的变化情况,则该反应的 ,A的百分含量与温度(T)的变化情况,则该反应的 |
| D.图4所示图中的阴影部分面积的含义是该物质物质的量的变化量 |
您最近一年使用:0次
2021-11-13更新
|
1012次组卷
|
11卷引用:安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题
安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题安徽省黄山市2022-2023学年高二上学期期末考试化学试题安徽省黄山市屯溪第一中学2023-2024学年高一上学期11月月考 化学试题湖北省华中师范大学第一附属中学2021-2022学年高二上学期期中检测化学试题湖北省襄阳市第五中学2022-2023学年高二上学期9月化学试题湖北省恩施市第一中学2022-2023学年高二上学期11月月考化学试题黑龙江省哈尔滨市德强学校2022-2023学年高二上学期期末考试化学试题河南省南阳市第一中学校2022-2023学年高二上学期第二次月考化学试题辽宁省东北育才中学少儿部2023-2024学年高二上学期第一次月考化学试题重庆市三峡名校联盟2023-2024学年高二上学期12月月考化学试题江苏省江阴市华士高级中学2023-2024学年高二上学期12月学情调研化学(选修)试卷



