名校
解题方法
1 . 在恒容密闭容器中通入X并发生反应:2X(g)=Y(g),T1、T2温度下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是


| A.该反应进行到M点放出的热量大于进行到W点放出的热量 |
| B.T2温度下,在0- t1,时间内,v(Y)=a-b/t1mol·L-1min-1 |
| C.该反应的ΔH<0 |
| D.M点时向容器内充入一定量惰性气体,平衡向正反应方向移动 |
您最近半年使用:0次
2023-12-27更新
|
111次组卷
|
2卷引用:北京市中关村中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
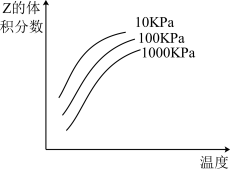
2 . 如图是温度和压强对 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气态 |
| C.X和Y中只有一种为气态,Z为气态 |
| D.温度升高时,Z的转化率变大 |
您最近半年使用:0次
名校
3 . 甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g) △H。在体积可变的密闭容器中投入0.5molCO和0.75molH2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
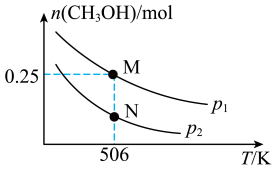
(1)根据图象判断△H_______ 0(填“<”或“>”);M点H2的转化率为_______ 。
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=_______ 。
(3)下列叙述能说明上述反应达到化学平衡状态的_______ (填字母序号)。
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率_______ (填“增大”、“不变”或“减小”)。

(1)根据图象判断△H
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=
(3)下列叙述能说明上述反应达到化学平衡状态的
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率
您最近半年使用:0次
名校
4 . 工业上可用“氨催化氧化法”生产NO,以氨气、氧气为原料,在Pt-Rh合金催化剂存在下生成NO和副产物N2,两个竞争反应化学方程式如下:
Ⅰ.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
Ⅱ.4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示: ×100%
×100%
下列说法不正确的是
Ⅰ.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)Ⅱ.4NH3(g)+3O2(g)
 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示:

 ×100%
×100%下列说法不正确的是
| A.400℃时,主要发生反应Ⅱ |
| B.由图分析工业上用氨催化氧化制备HNO3,最佳温度约为840℃ |
| C.520℃时,NH3的有效转化率约为66.7% |
| D.840℃后,NO的物质的量下降,可能是反应I平衡逆向移动所致 |
您最近半年使用:0次
2023-04-12更新
|
928次组卷
|
7卷引用:北京市顺义区2023届高三下学期第二次化学统练题
北京市顺义区2023届高三下学期第二次化学统练题北京市第八中学2023-2024学年高三上学期期中练习化学试题(已下线)20231218+12月月考1737051759696343040北京市第十四中学2023-2024学年高三上学期12月月考化学试题北京师范大学实验中学2023-2024学年高三上学期12月月考化学试卷(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)FHgkyldyjhx07
名校
解题方法
5 . I.某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。

(1)该反应的化学方程式为_______ 。
(2)反应开始至2 min,气体Z的平均反应速率
_______ 。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的_______ 倍。
②若容器内温度升高,X的转化率减小,则该反应的正反应为_______ (填“放热”或“吸热”)反应。
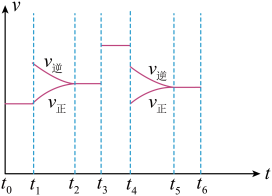
(4)上述反应在 内反应速率与时间图像如图所示,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是_______(填字母)。
内反应速率与时间图像如图所示,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是_______(填字母)。
Ⅱ.电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(5)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母序号)。
A.碳棒 B.锌板 C.铜板
(6)图2中,钢闸门C做_______ 极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为_______ ,检测该电极反应产物的方法是_______ 。

(1)该反应的化学方程式为
(2)反应开始至2 min,气体Z的平均反应速率

(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的
②若容器内温度升高,X的转化率减小,则该反应的正反应为
(4)上述反应在
 内反应速率与时间图像如图所示,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是_______(填字母)。
内反应速率与时间图像如图所示,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是_______(填字母)。
A.在 时增大了压强 时增大了压强 | B.在 时加入催化剂 时加入催化剂 |
C.在 时降低了温度 时降低了温度 | D. 时X的转化率最高 时X的转化率最高 |
Ⅱ.电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(5)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择
A.碳棒 B.锌板 C.铜板
(6)图2中,钢闸门C做
您最近半年使用:0次
名校
解题方法
6 . 在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是
 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是A.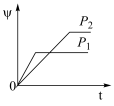 | B.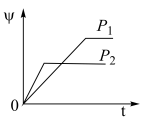 |
C.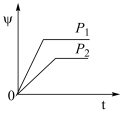 | D.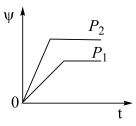 |
您最近半年使用:0次
2021-03-03更新
|
911次组卷
|
87卷引用:2015届北京市房山区高三4月模拟练习化学试卷
2015届北京市房山区高三4月模拟练习化学试卷北京市第三十五中学2022-2023学年高二上学期10月月考化学试题北京市北京医学院附属中学2022-2023学年高二上学期期中考试化学试题(已下线)2010年福建厦门理工学院附中高二化学期中阶段性测试试卷(已下线)吉林省长春外国语学校2010-2011学年高二第一次月考化学试题(已下线)2010年江西省德兴市四校联考高二上学期期中考试化学试卷(已下线)2010年青海省青海师大附中高二上学期期中考试化学试卷(已下线)2011-2012年山东省莒南县三中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省新余九中高二上学期期中考试化学试卷(已下线)2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省牡丹江一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年甘肃兰州一中高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷(已下线)2012-2013学年吉林省实验中学高二上学期期末考试化学试卷(已下线)2012年苏教版高中化学选修4 2.3化学平衡的移动练习卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年江苏省江都区丁沟中学高二下学期期中考试化学试卷(已下线)2014秋安徽省淮北师范大学附属实验中学高二上学期期中化学试卷2014-2015学年宁夏育才中学高二上学期期中化学试卷2014-2015湖南省益阳六中高二上学期期中考试化学(理)试卷2015-2016湖南省衡阳四中高二12月学科联赛化学试卷2015-2016湖南省衡阳县四中高二12月学科联赛化学试卷2015-2016学年西藏日喀则中学高二上12月月考化学试卷2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2015-2016学年广西南宁市八中高二下学期期中段考化学试卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2016-2017学年山东省德州市陵城一中高二上10月月考化学试卷2015-2016学年甘肃省白银市靖远一中高二上期中化学试卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷2016-2017学年山西省大同一中高二12月月考化学试卷2016-2017学年湖南省长沙一中高一上月考三化学试卷陕西省西安中学2016-2017学年高二(平行班)上学期期末考试化学试题2016-2017学年黑龙江省鸡西市第十九中学高二上学期期末考试化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题山西省朔州市第二中学2016-2017学年高一下学期期末考试化学试题广西桂林市2016-2017学年高二下学期期末质量检测化学试题山西省朔州市第一中学2017-2018学年高二8月月考化学试题吉林省汪清县第六中学2018届高三9月月考化学试题吉林省汪清县第六中学2017-2018学年高二9月月考化学试题甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题福建省莆田市第二十五中学2017-2018学年高二12月月考化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期中考试化学试题2甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第二章 章末知识测评(二)黑龙江省鸡西市第十九中学2018-2019学年高二(理)上学期期中考试化学试题【市级联考】吉林省公主岭市2018-2019学年高二上学期期末考试化学试题陕西省黄陵中学高新部2018-2019学年高一下学期期末考试化学试题河北省唐山市开滦第二中学2018-2019学年高二下学期期末考试化学试题黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题上海燎原双语学校2018-2019学年高三化学期中试题广东省潮州市潮安区颜锡祺中学2019-2020学年高二上学期期中考试化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期期中考试化学试题吉林省辽源市田家炳高级中学2019-2020学年高二12月月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第二次月考化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第一次月考化学试题吉林省长春外国语学校2019-2020学年高一下学期期末考试化学(理)试题河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题湖南省新宁县崀山培英学校2020-2021学年高二上学期期中考试化学试题陕西省咸阳百灵中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw118福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题青海省北外附属西宁新华联国际学校2020-2021学年高二上学期期末考试化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期第一次月考化学试题山东省淄博市第七中学2019-2020学年高二上学期第一次月考化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(理)试题山西省侯马市第一中学校2021-2022年高二上学期期中测试化学试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题四川省泸州市泸县第一中学2021-2022学年高二下学期入学考试化学试题陕西省千阳中学2020-2021学年高二上学期期中化学(理科)试题上海市控江中学2022-2023学年高二上学期9月阶段测化学试题海南省鑫源中学2021-2022学年高二上学期期中考试化学试题河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期期中考试化学试题福建省平潭翰英中学2021-2022学年高二上学期期中考试化学试题宁夏中卫市中宁县2022-2023学年高二上学期质量测查(期末)化学试题浙江省宁波效实中学2022-2023学年高一下学期期中考试化学(选考班)试题广东省东莞市东华高级中学2023-2024学年高二上学期期中联考化学试卷河北省百师联盟2023-2024学年高二上学期1月期末大联考化学试题河北省石家庄市赵县七县联考2023-2024学年高二上学期1月期末化学试题黑龙江省伊春市铁力市马永顺中学校2023-2024学年高二上学期期末考试化学试题
名校
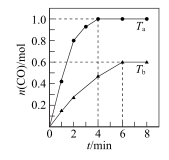
7 . 向体积为10L的恒容密闭容器中通入1.1 mol CH4(g)和1.1molH2O(g)制备H2,反应原理为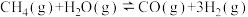 (正反应吸热)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如下图所示。下列说法正确的是
(正反应吸热)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如下图所示。下列说法正确的是
 (正反应吸热)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如下图所示。下列说法正确的是
(正反应吸热)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如下图所示。下列说法正确的是
| A.温度Ta<Tb |
B.Ta时,CH4的平衡转化率 |
| C.Tb时,平衡时再充入1.1 mol CH4,平衡常数增大 |
| D.Tb时,若改为恒温恒压容器,平衡时n(CO)>0.6mol |
您最近半年使用:0次
2021-02-03更新
|
295次组卷
|
2卷引用:北京市东城区2020-2021学年高二上学期期末考试化学试题
名校
解题方法
8 . T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C的变化如图所示。
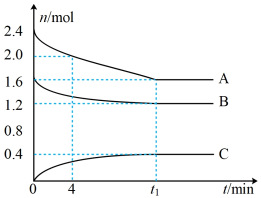
(1)写出反应的化学方程式______ 。
(2)0~4min时,A的平均反应速率为______ 。
(3)已知:K(300℃)>K(350℃),该反应是______ (填“吸热”或“放热”)反应。
(4)T℃时,反应的平衡常数为______ (保留到小数点后2位)。
(5)到达平衡时B的转化率为______ 。
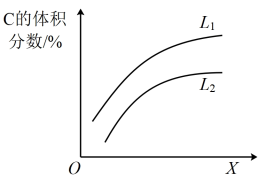
(6)如图是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是______ (填“温度”或“压强”)。判断L1_____ L2(填“>”或“<”),理由是_____ 。

(1)写出反应的化学方程式
(2)0~4min时,A的平均反应速率为
(3)已知:K(300℃)>K(350℃),该反应是
(4)T℃时,反应的平衡常数为
(5)到达平衡时B的转化率为
(6)如图是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是

您最近半年使用:0次
2020-11-09更新
|
438次组卷
|
5卷引用:北京市丰台区 2020-2021 学年高三上学期期中考试化学试题
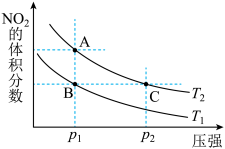
9 . 反应N2O4(g) 2NO2(g);ΔH=+57 kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);ΔH=+57 kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
 2NO2(g);ΔH=+57 kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);ΔH=+57 kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( ) 
| A.A、C两点的反应速率:A>C | B.B、C两点的反应速率:B=C |
| C.由状态B到状态A,可以用加热的方法 | D.A、C两点气体的颜色:A深,C浅 |
您最近半年使用:0次
2020-10-30更新
|
117次组卷
|
2卷引用:北京市第二十二中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
10 . 一定条件下,在容积为3 L的密闭容器中,发生反应CO(g)+2H2(g) CH3OH(g)ΔH<0,在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是( )
CH3OH(g)ΔH<0,在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是( )

 CH3OH(g)ΔH<0,在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是( )
CH3OH(g)ΔH<0,在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是( )
| A.平衡常数K(300 ℃)<K(500 ℃) |
| B.300 ℃,当容器内压强不变时说明反应已经达到平衡 |
| C.在其他条件不变的情况下,将处于E点的体系的容积压缩到原来的1/2,氢气的浓度减小 |
D.500 ℃,从反应开始到平衡,氢气的平均反应速率:v(H2)=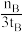 mol·L-1·min-1 mol·L-1·min-1 |
您最近半年使用:0次
2020-10-15更新
|
105次组卷
|
4卷引用: 北京市第五中学2023-2024学年高二上学期10月月考化学试题



