陕西省千阳中学2020-2021学年高二上学期期中化学(理科)试题
陕西
高二
期中
2022-10-01
121次
整体难度:
适中
考查范围:
化学反应原理
一、单选题 添加题型下试题
| A.能发生有效碰撞的分子叫活化分子 | B.升温,活化分子百分数增大,反应速率增大 |
| C.增大反应物浓度,活化分子百分数增大 | D.催化剂能增大活化分子百分数,速率增大 |
| A.v(A)=0.5mol/(L·s) | B.v(B)=0.3mol/(L·s) |
| C.v(C)=0.8mol/(L·s) | D.v(D)=1.0mol/(L·s) |
【知识点】 化学反应速率与化学计量数之间的关系解读
 2AB(g)的能量变化如图所示,则下列叙述中不正确的是
2AB(g)的能量变化如图所示,则下列叙述中不正确的是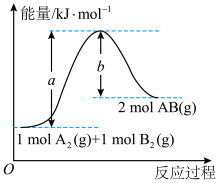
| A.该反应的活化能为a kJ·mol-1 | B.该反应的逆反应的活化能为b kJ·mol-1 |
| C.该反应的ΔH=+(a-b) kJ·mol-1 | D.使用催化剂,a的数值减小,ΔH也减小 |
 C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1:1 ⑦混合气体总质量 ⑧混合气体总体积
| A.①②③④⑤⑥⑦⑧ | B.①③④⑤ | C.①②③④⑤⑦ | D.①③④⑤⑧ |
【知识点】 化学平衡状态 化学平衡状态本质及特征解读 化学平衡状态的判断方法解读


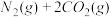
 。
。下列说法不正确的是
| A.升高温度可使该反应的逆反应速率降低 | B.使用高效催化剂可有效提高正反应速率 | C.反应达到平衡后,N0的反应速率保持恒定 | D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
【知识点】 影响化学反应速率的因素 化学平衡状态 化学平衡状态的判断方法解读
 2AB2(g)的ΔH<0,下列说法正确的是( )
2AB2(g)的ΔH<0,下列说法正确的是( )| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
【知识点】 影响化学反应速率的外因 化学平衡的移动及其影响因素
| A.化学反应速率:乙>甲 | B.平衡后N2的浓度:乙>甲 |
| C.H2的平衡转化率:乙>甲 | D.平衡混合气体中H2的体积分数:乙>甲 |
 pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是| A.化学计量数:m+n<p | B.平衡向正反应方向移动了 |
| C.物质B的转化率减小了 | D.物质C的质量分数增加了 |
【知识点】 化学平衡的移动及其影响因素
 ;
; 。在一定条件下分别向三个容器中充入的气体量和
。在一定条件下分别向三个容器中充入的气体量和 如下表所示:
如下表所示:| 容器 | 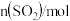 | 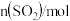 |  | 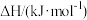 |
| 甲 | 2 | 1 | 0 |  |
| 乙 | 1 | 0.5 | 0 |  |
| 丙 | 1 | 0.5 | 1 |  |
根据以上数据,下列选项正确的是
A.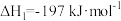 | B.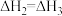 |
C. | D. |
 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是A.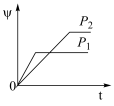 | B.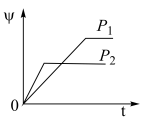 |
C.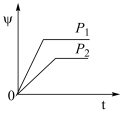 | D.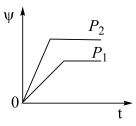 |
 Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是| A.X的平衡转化率为40% |
B.若将容器体积变为20L,则Z的平衡浓度小于原来的 |
| C.若增大压强,则Y的平衡转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |
【知识点】 化学平衡的移动及其影响因素 化学平衡的有关计算
 cC(g) +dD(g)符合下图。则下列叙述正确的是
cC(g) +dD(g)符合下图。则下列叙述正确的是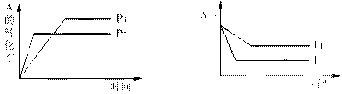
| A.a+b < c+d;正反应吸热 | B.a+b > c+d;正反应放热 |
| C.a+b < c+d;正反应放热 | D.a+b > c+d;正反应吸热 |

| A.达到平衡后,加入催化剂,C%增大 |
| B.达到平衡后,若升温,平衡向左移动 |
| C.化学方程式中n<p+q |
| D.达到平衡后,增加A的量有利于平衡向右移动 |
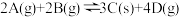 ,平衡常数随温度和压强的变化如表所示。下列判断正确的是
,平衡常数随温度和压强的变化如表所示。下列判断正确的是平衡常数 压强/MPa 温度/℃ | 1.0 | 1.5 | 2.0 |
| 300 | a | b | 16 |
| 516 | c | 64 | e |
| 800 | 160 | f | g |
| A.g>f |
B. |
| C.2.0MPa、800℃时,A的转化率最小 |
| D.1.5MPa、300℃时,B的转化率为50% |
 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1.保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法错误的是
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1.保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法错误的是| A.平衡不移动 | B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1 |
| C.再达平衡时,C的体积分数增大 | D.再达平衡时,正反应速率增大,逆反应速率也增大 |
【知识点】 影响化学平衡的因素 压强对化学平衡移动的影响解读
A.Kp=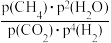 |
| B.升高温度,若Kp 增大,则该反应为吸热反应 |
| C.该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小 |
D.t℃时,反应 CH4(g)+H2O(g)⇌ CH4(g)+H2O(g)⇌ CO2(g)+2H2 (g)的平衡常数Kp= CO2(g)+2H2 (g)的平衡常数Kp= a a |
 N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是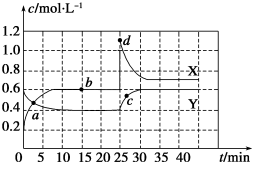
| A.如混合气体的压强不再发生改变,说明反应已达化学平衡状态 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点 |
| C.25~30 min内用NO2表示的平均化学反应速率是0.08 mol·L-1·min-1 |
| D.反应进行至25 min时,曲线发生变化的原因是增加N2O4的浓度 |
| A.焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 |
| B.熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 |
| C.由焓判据和熵判据组合而成的复合判据,更适合于过程自发性的判断 |
| D.焓减小的反应通常是自发的,因此不需要任何条件即可发生 |
二、填空题 添加题型下试题
 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如下图: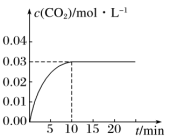
(1)根据图上数据,该温度(800 ℃)下的平衡常数K=
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有___________(填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3 mol的水蒸气,重新达到平衡后,H2O的转化率
II、在一定温度下,10L密闭容器中加入
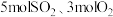 ,反应到达平衡时有
,反应到达平衡时有 发生了反应,试填写下列空格:
发生了反应,试填写下列空格:(4)平衡时体系中O2的体积分数为
(5)若平衡时容器内压强为P,则反应前容器内的压强为
III、一密封体系中发生下列反应:N2 +3H2
 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图: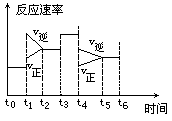
回答下列问题:
(6)t1时刻体系中是什么条件发生了变化?
(7)下列各时间段时,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
【知识点】 化学平衡的有关计算 化学平衡图像分析 化学平衡状态的判断方法解读
 与黄色的CrO
与黄色的CrO 有平衡关系: Cr2O
有平衡关系: Cr2O + H2O
+ H2O 2CrO
2CrO + 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
+ 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。(1)向上述溶液中加入NaOH溶液,则平衡
(2)向已加入NaOH溶液的溶液中再加入过量稀硫酸,则溶液应是
(3)向原溶液中加入硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡
II、 在一定条件下,反应xA 十yB
 zC达到平衡。
zC达到平衡。(4)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则x、,y、,z之间的关系是
(5)若C是气体,且x + y=z,增大压强如果平衡发生移动,则A的转化率将
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K =
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)。
| A.容器中压强不变 | B.混合气体中 c(CO)不变 |
| C.υ正(H2)=υ逆(H2O) | D.c(CO2)=c(CO) |
II、 高炉炼铁中发生的基本反应之一如下:
FeO(g) +CO(g)
 Fe(g) + CO2(g) △H > 0,其平衡常数
Fe(g) + CO2(g) △H > 0,其平衡常数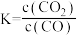 ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。(5)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值
(6)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态
试卷分析
导出试卷题型(共 21题)
试卷难度
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 影响化学反应速率的因素 碰撞理论及活化能 活化能及其对反应速率的影响 催化剂对化学反应速率的影响 | |
| 2 | 0.85 | 化学反应速率与化学计量数之间的关系 | |
| 3 | 0.85 | 化学反应热的计算 吸热反应和放热反应 根据△H=生成物的总能量之和-反应物的总能量之和进行计算 | |
| 4 | 0.85 | 化学平衡状态 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 5 | 0.65 | 影响化学反应速率的因素 化学平衡状态 化学平衡状态的判断方法 | |
| 6 | 0.65 | 影响化学反应速率的外因 化学平衡的移动及其影响因素 | |
| 7 | 0.65 | 化学平衡的移动及其影响因素 等效平衡 等效平衡的建立 等效平衡理论的综合应用 | |
| 8 | 0.65 | 化学平衡的移动及其影响因素 | |
| 9 | 0.65 | 盖斯定律与热化学方程式 化学平衡的有关计算 等效平衡的建立 等效平衡理论的综合应用 | |
| 10 | 0.65 | 化学平衡的移动及其影响因素 外界条件对化学平衡影响的图像 产物的物质的量与温度、压强的图像关系分析 | |
| 11 | 0.65 | 化学平衡的移动及其影响因素 化学平衡的有关计算 | |
| 12 | 0.4 | 外界条件对化学平衡影响的图像 与转化率变化有关图像的分析 | |
| 13 | 0.85 | 化学平衡的移动 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 14 | 0.65 | 压强对化学平衡移动的影响 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 转化率的相关计算及判断 | |
| 15 | 0.65 | 影响化学平衡的因素 压强对化学平衡移动的影响 | |
| 16 | 0.85 | 影响化学平衡的因素 化学平衡常数的概念及表达方式 化学平衡常数的计算 | |
| 17 | 0.65 | 化学反应速率计算 化学反应速率与化学计量数之间的关系 化学平衡状态的判断方法 勒夏特列原理的应用 | |
| 18 | 0.65 | 焓判据 熵判据 复合判据 | |
| 二、填空题 | |||
| 19 | 0.65 | 化学平衡的有关计算 化学平衡图像分析 化学平衡状态的判断方法 | |
| 20 | 0.65 | 化学平衡的移动及其影响因素 浓度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 21 | 0.65 | 化学平衡状态的判断方法 化学平衡常数的概念及表达方式 化学平衡常数的有关计算 | |



