解题方法
1 . 对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH−TΔS确定,若ΔH−TΔS<0,则自发进行,否则不能自发进行。下列说法中,正确的是
| A.反应焓变是决定反应能否自发进行的唯一因素 |
| B.温度、压强一定时,熵增加的反应一定能自发进行 |
| C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| D.固体的溶解过程只与焓变有关 |
您最近一年使用:0次
2020-11-25更新
|
347次组卷
|
5卷引用:选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)湖北省孝感市2021-2022学年高二上学期期中联考化学试题浙江省温州市平阳县万全综合高级中学2021-2022学年高二上学期期中考试化学试题内蒙古自治区赤峰市第二实验中学2020-2021学年高二上学期10月月考化学试题(已下线)2.4 化学反应进行的方向-2021-2022学年高二化学课后培优练(人教版选修4)
2 . 下列说法正确的是
| A.食物在常温下腐败是自发进行 | B.凡是放热反应都是自发的 |
| C.自发反应都是熵增大的反应 | D.原电池的反应是属于不是自发反应 |
您最近一年使用:0次
2020-11-25更新
|
184次组卷
|
3卷引用:福建省泉州市第六中学2022-2023学年高二上学期期中考化学试题
福建省泉州市第六中学2022-2023学年高二上学期期中考化学试题(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
3 . 碳和氮的氢化物是广泛的化工原料,回答下列问题:
(1)工业上合成氨的反应为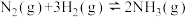
 ,反应过程中能量变化如图所示。
,反应过程中能量变化如图所示。
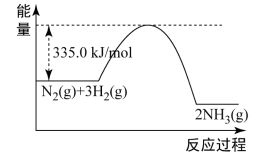
①反应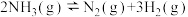 的活化能为
的活化能为________ kJ/mol,有利于该反应自发进行的条件是_________ 。
②合成氨时加入铁粉可以加快生成 的速率,在上图中画出加入铁粉后的能量变化曲线
的速率,在上图中画出加入铁粉后的能量变化曲线_______ 。
(2) 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。回答下列问题:
),还对温室气体的减排具有重要意义。回答下列问题:
①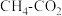 催化重整反应为
催化重整反应为
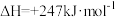 。某温度下,在体积为2L的容器中加入2mol
。某温度下,在体积为2L的容器中加入2mol 、1mol
、1mol 以及催化剂进行重整反应,5min达到平衡时
以及催化剂进行重整反应,5min达到平衡时 的转化率是50%。0-5min平均反应速率
的转化率是50%。0-5min平均反应速率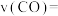
_________ 
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如表:
由上表判断,催化剂X______ Y(填“优于”或“劣于”),理由是____________________ 。
(1)工业上合成氨的反应为
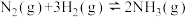
 ,反应过程中能量变化如图所示。
,反应过程中能量变化如图所示。
①反应
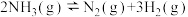 的活化能为
的活化能为②合成氨时加入铁粉可以加快生成
 的速率,在上图中画出加入铁粉后的能量变化曲线
的速率,在上图中画出加入铁粉后的能量变化曲线(2)
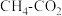 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。回答下列问题:
),还对温室气体的减排具有重要意义。回答下列问题:①
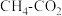 催化重整反应为
催化重整反应为
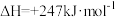 。某温度下,在体积为2L的容器中加入2mol
。某温度下,在体积为2L的容器中加入2mol 、1mol
、1mol 以及催化剂进行重整反应,5min达到平衡时
以及催化剂进行重整反应,5min达到平衡时 的转化率是50%。0-5min平均反应速率
的转化率是50%。0-5min平均反应速率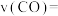

②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如表:
积碳反应 | 消碳反应 | ||
| 75 | 172 | |
活化能/( | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X
您最近一年使用:0次
2020-11-24更新
|
205次组卷
|
2卷引用:浙江省杭州市富阳区第二中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
4 . 以下判断正确的是
A.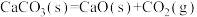 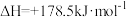 ,该反应低温才能自发 ,该反应低温才能自发 |
B.通常化学反应的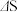 越大,越有利于反应自发进行,所以 越大,越有利于反应自发进行,所以 时反应必能自发 时反应必能自发 |
C.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
| D.放热反应都可以自发进行,而吸热反应不能自发进行 |
您最近一年使用:0次
2020-11-24更新
|
331次组卷
|
4卷引用:浙江省杭州市富阳区第二中学2020-2021学年高二上学期期中考试化学试题
5 . 乙烯的产量是衡量一个国家石油化工水平的标志。回答下列问题:
(1)石油工业中利用正丁烷催化裂化生产烯烃:
反应ⅠC4H10(g) C2H6(g)+C2H4(g);
C2H6(g)+C2H4(g);
反应ⅡC4H10(g) CH4(g)+C3H6(g)。
CH4(g)+C3H6(g)。
①反应Ⅰ能自发进行的条件是___ 。
A.高温B.低温C.任何温度
②一定温度下,向10L恒容密闭容器中充入2mol正丁烷,发生催化裂化反应,达平衡时测得气体压强是原来的1.75倍,且两种烯烃产物的质量相等。则正丁烷的平衡转化率为___ ,此温度下该反应Ⅰ的平衡常数为___ 。
(2)石油工业中还常用乙烷生产乙烯,原理如下:
反应Ⅲ乙烷热裂解:C2H6(g) C2H4(g)+H2(g) ΔH3;
C2H4(g)+H2(g) ΔH3;
反应Ⅳ乙烷氧化热裂解:C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g) ΔH4= -110kJ·mol-1。
C2H4(g)+H2O(g) ΔH4= -110kJ·mol-1。
已知:
①根据键能估算乙烷热裂解的ΔH3=___ kJ·mol-1。
②从能量角度分析乙烷氧化热裂解制乙烯较乙烷热裂解制乙烯的优点___ 。
(3)以CO2为原料也可以催化加氢合成乙烯,其原理为:
反应Ⅴ主反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH5<0;
C2H4(g)+4H2O(g) ΔH5<0;
反应Ⅵ副反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH6<0。
CH3OH(g)+H2O(g) ΔH6<0。
①某催化剂作用下,在相同反应时间内,测得不同温度下CO2转化率与C2H4产率的变化曲线如图1。下列说法正确的是___ 。
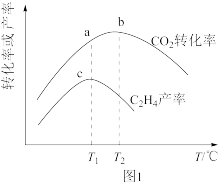
A. CO2转化率越大,越有利于C2H4的生成
B. a点是主反应的平衡转化率,b点是副反应的平衡转化率
C.T1℃时催化剂的选择性最好,有利于提高生成C2H4的平衡转化率
D.T1~T2之间C2H4产率变化趋势和CO2转化率不一致,原因可能是主反应被抑制,使C2H4产率降低
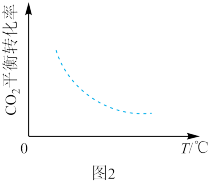
②向恒压密闭容器中充入1molCO2和3molH2模拟合成乙烯,CO2平衡转化率与温度的关系如图2所示。在图中作出改为恒容容器中,其他条件不变时CO2平衡转化率随温度变化的曲线___ 。
(1)石油工业中利用正丁烷催化裂化生产烯烃:
反应ⅠC4H10(g)
 C2H6(g)+C2H4(g);
C2H6(g)+C2H4(g);反应ⅡC4H10(g)
 CH4(g)+C3H6(g)。
CH4(g)+C3H6(g)。①反应Ⅰ能自发进行的条件是
A.高温B.低温C.任何温度
②一定温度下,向10L恒容密闭容器中充入2mol正丁烷,发生催化裂化反应,达平衡时测得气体压强是原来的1.75倍,且两种烯烃产物的质量相等。则正丁烷的平衡转化率为
(2)石油工业中还常用乙烷生产乙烯,原理如下:
反应Ⅲ乙烷热裂解:C2H6(g)
 C2H4(g)+H2(g) ΔH3;
C2H4(g)+H2(g) ΔH3;反应Ⅳ乙烷氧化热裂解:C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g) ΔH4= -110kJ·mol-1。
C2H4(g)+H2O(g) ΔH4= -110kJ·mol-1。已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 613 | 436 |
②从能量角度分析乙烷氧化热裂解制乙烯较乙烷热裂解制乙烯的优点
(3)以CO2为原料也可以催化加氢合成乙烯,其原理为:
反应Ⅴ主反应2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH5<0;
C2H4(g)+4H2O(g) ΔH5<0;反应Ⅵ副反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH6<0。
CH3OH(g)+H2O(g) ΔH6<0。①某催化剂作用下,在相同反应时间内,测得不同温度下CO2转化率与C2H4产率的变化曲线如图1。下列说法正确的是

A. CO2转化率越大,越有利于C2H4的生成
B. a点是主反应的平衡转化率,b点是副反应的平衡转化率
C.T1℃时催化剂的选择性最好,有利于提高生成C2H4的平衡转化率
D.T1~T2之间C2H4产率变化趋势和CO2转化率不一致,原因可能是主反应被抑制,使C2H4产率降低
②向恒压密闭容器中充入1molCO2和3molH2模拟合成乙烯,CO2平衡转化率与温度的关系如图2所示。在图中作出改为恒容容器中,其他条件不变时CO2平衡转化率随温度变化的曲线

您最近一年使用:0次
6 . 已知NH4NO3溶于水,溶液温度降低。则该过程中( )
| A.ΔH>0,ΔS>0 | B.ΔH>0,ΔS<0 | C.ΔH<0,ΔS>0 | D.ΔH<0,ΔS<0 |
您最近一年使用:0次
名校
解题方法
7 . 一定温度和压强下,当△H-T△S<0时,反应能自发进行。下列反应△H>0,△S>0的是( )
| A.HCl(g)+NH3(g)=NH4Cl(s) |
| B.高温下能自发进行的反应:2N2O5(g)=4NO2(g)+O2(g) |
| C.2H2(g)+O2(g)=2H2O(l) |
| D.任何温度下均能自发进行的反应:COCl2(g)=CO(g)+Cl2(g) |
您最近一年使用:0次
2020-11-24更新
|
354次组卷
|
8卷引用:山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题
山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题【市级联考】河北省唐山市2019-2020学年高二上学期期末考试化学试题(已下线)2.3 化学反应的方向(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)第三节 化学反应的方向 河南省洛阳市第三高级中学2022-2023学年高二上学期12月月考化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题
8 . 下列有关说法正确的是
A.在稀溶液中, ; ;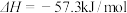 ,若将含0.5molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于 ,若将含0.5molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于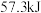 |
B.在一密闭容器中发生反应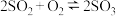 ,增大压强,平衡正向移动, ,增大压强,平衡正向移动,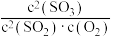 的值增大 的值增大 |
C.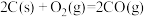 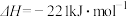 ,则C的燃烧热 ,则C的燃烧热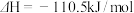 |
| D.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
您最近一年使用:0次
名校
解题方法
9 . 反应CH3OH(g)+NH3(g)=CH3NH2(g)+H2O(g)在高温下才能自发向右进行,则该反应的ΔH、ΔS应为( )
| A.ΔH>0、ΔS<0 | B.ΔH<0、ΔS>0 |
| C.ΔH>0、ΔS>0 | D.ΔH<0、ΔS<0 |
您最近一年使用:0次
2020-11-24更新
|
126次组卷
|
24卷引用:2016-2017学年江西省赣州市十四校高二上学期期中化学试卷
2016-2017学年江西省赣州市十四校高二上学期期中化学试卷湖北省沙市中学2017-2018学年高二上学期期中考试化学试题安徽省江淮名校2017-2018学年高二期中考试化学试题【校级联考】湖南省醴陵二中、醴陵四中2018-2019学年高二上学期期中联考化学试题【校级联考】湖南省醴陵一中、攸县一中2018-2019学年高二(理)上学期期中联考化学试题【市级联考】吉林省吉林市普通高中2018-2019学年高二上学期期中考试化学试题贵州省思南中学2019-2020学年高二上学期期中考试化学试题福建省平和一中、南靖一中等五校2019-2020学年高二年上学期期中联考化学试题福建省漳州市第八中学2019-2020学年高二上学期期中考试化学试题安徽省合肥市2019—2020学年高二下学期期中考试化学试题吉林省榆树市第一高级中学2020-2021学年高二上学期期中考试化学试题贵州省北师大遵义附属高级中学2020-2021学年高二上学期期中考试化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题新疆哈密市第八中学2021-2022学年高二上学期期中考试化学试题2015-2016学年福建省三明一中高二下第一次月考化学试卷2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷2016-2017学年江西省宜春市奉新一中高二上月考二化学卷(已下线)2.4 化学反应进行的方向云南省中央民族大学附属中学芒市国际学校2017-2018学年高二上学期末考试化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高二下学期第一次月考化学试题人教版高二化学选修4 第二章 第四节 化学反应进行的方向练习题甘肃省张掖市高台县第一中学2018-2019学年高二上学期期末考试理科化学试题江西省宜春市上高二中2023-2024学年高二上学期第三次月考化学试题 高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第四节 化学反应进行的方向 化学反应进行的方向
名校
10 . 下列有关化学反应方向及其判据的说法中错误的是( )
| A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)] |
| B.自发反应的熵一定增大,非自发反应的熵一定减小 |
| C.反应:CaCO3(s)=CaO(s)+CO2(g)ΔH>0能否自发进行与温度有关 |
| D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ·mol-1能自发进行是因为体系有自发地向混乱度增大的方向转变的倾向 |
您最近一年使用:0次

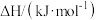
 )
)

