名校
解题方法
1 . 利用甲烷可以除去 ,反应为
,反应为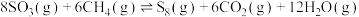 。下列说法正确的是
。下列说法正确的是
 ,反应为
,反应为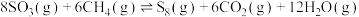 。下列说法正确的是
。下列说法正确的是A.上述反应的 |
B.上述反应的化学平衡常数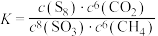 |
C.及时分离出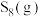 ,正反应速率增大,平衡向正反应方向移动 ,正反应速率增大,平衡向正反应方向移动 |
D.上述反应中生成1mol 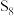 ,转移电子的数目约为 ,转移电子的数目约为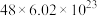 |
您最近一年使用:0次
解题方法
2 . 化学与生活、科技、生产联系紧密。下列说法错误的是
| A.钙钛矿太阳能电池可将太阳能直接转化为电能 |
| B.热的纯碱溶液除油污的原理涉及到盐类的水解和酯类的水解 |
C.反应 能自发进行,说明该反应 能自发进行,说明该反应 |
| D.航海船只的船底镶嵌锌块利用了阴极电保护法保护船体 |
您最近一年使用:0次
名校
解题方法
3 . I.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为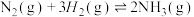
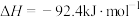 ,
,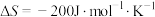 。请回答下列问题:
。请回答下列问题:
(1)常温下,合成氨反应________ (填“能”或“不能”)自发进行,其平衡常数表达式K=________ 。
(2)________ 温(填“高”或“低”)有利于提高反应速率,________ 温(填“高”或“低”)有利于提高平衡转化率,综合考虑催化剂活性等因素,工业常采用400∼500℃。
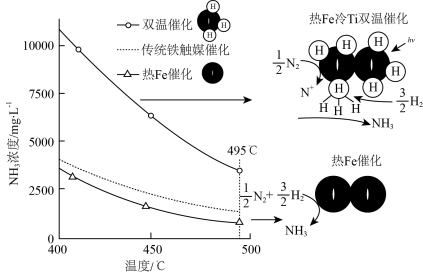
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)________________ 。
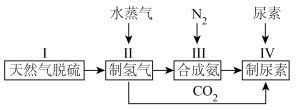
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下: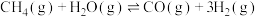 ,
, ,恒容容器中,对于以上反应,能加快反应速率的是
,恒容容器中,对于以上反应,能加快反应速率的是________ 。
A.升高温度 B.充入He C.加入催化剂
(5)已知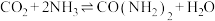 ,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成
,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成________ 吨尿素。
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:________ ;
(7)在b点,溶液中各离子浓度由大到小的排列顺序是________ ;
(8)在cd段发生反应的离子方程式为________ 。
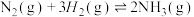
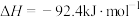 ,
,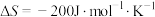 。请回答下列问题:
。请回答下列问题:(1)常温下,合成氨反应
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:
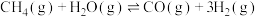 ,
, ,恒容容器中,对于以上反应,能加快反应速率的是
,恒容容器中,对于以上反应,能加快反应速率的是A.升高温度 B.充入He C.加入催化剂
(5)已知
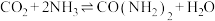 ,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成
,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
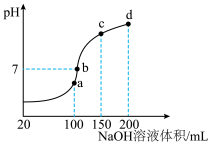
(7)在b点,溶液中各离子浓度由大到小的排列顺序是
(8)在cd段发生反应的离子方程式为
您最近一年使用:0次
名校
4 . 运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
生产氢气:将水蒸气通过红热的炭即产生水煤气,其反应为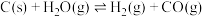
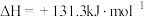 ,
,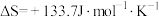
(1)试判断该反应在常温下能否自发进行_________ 。(写出计算过程)
(2)写出该反应的平衡常数表达式___________ 。
生产氢气:将水蒸气通过红热的炭即产生水煤气,其反应为
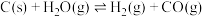
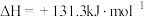 ,
,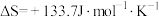
(1)试判断该反应在常温下能否自发进行
(2)写出该反应的平衡常数表达式
您最近一年使用:0次
解题方法
5 . 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列有关说法正确的是
4NO(g)+6H2O(g),下列有关说法正确的是
 4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列有关说法正确的是
4NO(g)+6H2O(g),下列有关说法正确的是| A.该反应只有在高温条件下能自发进行 |
| B.该反应的正反应的活化能小于逆反应的活化能 |
| C.达到平衡时,升高温度,v(正)减小、v(逆)增加 |
| D.c(NH3):c(O2):c(NO):c(H2O)=4:5:4:6时,说明反应达到平衡 |
您最近一年使用:0次
名校
6 . I.汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。已知4CO(g)+2NO2(g) 4CO2(g)+N2(g)
4CO2(g)+N2(g)  H=-1200kJ/mol。
H=-1200kJ/mol。
(1)该反应在___________ (填“高温、低温或任何温度”)下能自发进行。
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___________ (填标号)。
(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___________ 乙(填“>、=、<或不确定”,下同)。
②NO2的平衡浓度:甲___________ 乙。
③甲中CO的转化率为50%,该反应的平衡常数为___________ 。
II.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:在1.0L恒容密闭容器中投入1.25molCO2和1.75molH2发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:___________ 反应,p1、p2、p3从大到小的关系排序为___________ 。
(5)M点对应的平衡常数K=___________ ,在p2及512K时,图中N点v正___________ v逆(填“>”<”或“=”)。
 4CO2(g)+N2(g)
4CO2(g)+N2(g)  H=-1200kJ/mol。
H=-1200kJ/mol。(1)该反应在
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___________ (填标号)。
A. | B.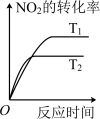 | C.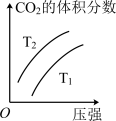 | D.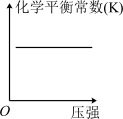 |
(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲
②NO2的平衡浓度:甲
③甲中CO的转化率为50%,该反应的平衡常数为
II.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:在1.0L恒容密闭容器中投入1.25molCO2和1.75molH2发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示: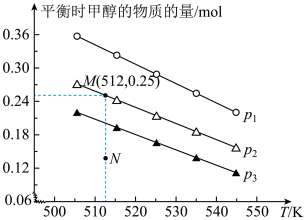
(5)M点对应的平衡常数K=
您最近一年使用:0次
名校
解题方法
7 . 一定条件下,在密闭容器中利用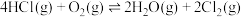 制备
制备 ,下列有关说法正确的是
,下列有关说法正确的是
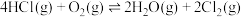 制备
制备 ,下列有关说法正确的是
,下列有关说法正确的是A.若断开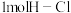 键的同时有 键的同时有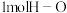 键断开,则表明该反应达到平衡状态 键断开,则表明该反应达到平衡状态 |
B.提高 ,该反应的平衡常数增大 ,该反应的平衡常数增大 |
C.使用催化剂,可以提高 的平衡转化率 的平衡转化率 |
D.该反应在一定条件下可自发进行,则该反应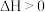 |
您最近一年使用:0次
名校
解题方法
8 . 已知, 生产甲醇过程主要发生以下反应:
生产甲醇过程主要发生以下反应:
反应I.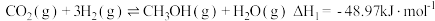
反应II.
反应III.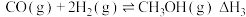
(1)反应III中, H=
H=_____________  ,该反应在
,该反应在_______ 条件下能自发进行。
A.在低温条件下自发进行 B.在高温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(2)反应III中, 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示: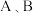 两点压强大小关系是pA
两点压强大小关系是pA_____________ pB(填“ 、
、 、
、 ”)。
”)。
② 三点平衡常数
三点平衡常数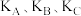 的大小关系为
的大小关系为_____________ 。 时,由D点到A点过程中正、逆反应速率之间的关系:v正
时,由D点到A点过程中正、逆反应速率之间的关系:v正_____________ v逆。(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)完成下列问题。
①向某恒温恒压密闭容器中充入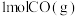 和
和 ,下列能说明反应III达到平衡的是
,下列能说明反应III达到平衡的是_______ 。
A.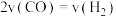
B.两种反应物转化率的比值不再改变
C.容器内混合气体的平均相对分子质量不再改变
D.容器内混合气体的密度不再改变
②在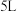 恒容密闭容器中充入
恒容密闭容器中充入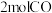 和
和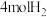 ,在
,在 和
和 条件下经
条件下经 达到平衡状态。在该条件下,v(H2)=
达到平衡状态。在该条件下,v(H2)=_______ 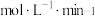 。
。
(4)已知: 的选择性
的选择性 ,不考虑催化剂活性温度,为同时提高
,不考虑催化剂活性温度,为同时提高 的平衡转化率和甲醇的选择性,应选择的反应条件是
的平衡转化率和甲醇的选择性,应选择的反应条件是_______ ,说明其原因_____________________ 。
A.低温低压 B.低温高压 C.高温高压 D.高温低压
 生产甲醇过程主要发生以下反应:
生产甲醇过程主要发生以下反应:反应I.
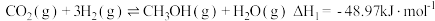
反应II.

反应III.
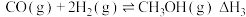
(1)反应III中,
 H=
H= ,该反应在
,该反应在A.在低温条件下自发进行 B.在高温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(2)反应III中,
 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示: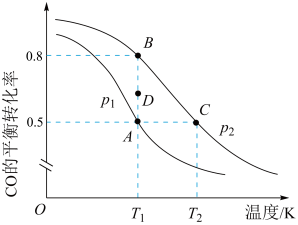
 两点压强大小关系是pA
两点压强大小关系是pA 、
、 、
、 ”)。
”)。②
 三点平衡常数
三点平衡常数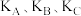 的大小关系为
的大小关系为 时,由D点到A点过程中正、逆反应速率之间的关系:v正
时,由D点到A点过程中正、逆反应速率之间的关系:v正 ”、“
”、“ ”或“
”或“ ”)。
”)。(3)完成下列问题。
①向某恒温恒压密闭容器中充入
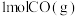 和
和 ,下列能说明反应III达到平衡的是
,下列能说明反应III达到平衡的是A.
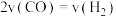
B.两种反应物转化率的比值不再改变
C.容器内混合气体的平均相对分子质量不再改变
D.容器内混合气体的密度不再改变
②在
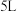 恒容密闭容器中充入
恒容密闭容器中充入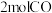 和
和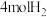 ,在
,在 和
和 条件下经
条件下经 达到平衡状态。在该条件下,v(H2)=
达到平衡状态。在该条件下,v(H2)=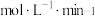 。
。(4)已知:
 的选择性
的选择性 ,不考虑催化剂活性温度,为同时提高
,不考虑催化剂活性温度,为同时提高 的平衡转化率和甲醇的选择性,应选择的反应条件是
的平衡转化率和甲醇的选择性,应选择的反应条件是A.低温低压 B.低温高压 C.高温高压 D.高温低压
您最近一年使用:0次
9 . “碳中和”目标如期实现的关键技术之一是CO2的再资源化利用。
(1)将二氧化碳转化为甲醇是目前研究的热点之一,在催化剂作用下主要发生以下反应:
Ⅰ.
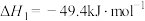
Ⅱ.
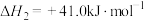
Ⅲ.

反应Ⅲ自发进行的条件及判断依据是__________ 。
(2)保持压强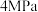 ,将起始
,将起始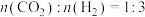 的混合气体匀速通过装有催化剂的反应管,只发生上述反应Ⅰ和反应Ⅱ,测得出口处CO2的转化率和甲醇的选择性[
的混合气体匀速通过装有催化剂的反应管,只发生上述反应Ⅰ和反应Ⅱ,测得出口处CO2的转化率和甲醇的选择性[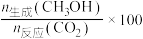 %]与温度的关系如图1、图2所示。
%]与温度的关系如图1、图2所示。 %,计算340℃时三种催化剂的催化效率之比
%,计算340℃时三种催化剂的催化效率之比
__________ 。
②随着温度的升高,CO2转化率增大,但甲醇选择性降低的原因是__________ 。
(3)甲醇再应用:在催化剂作用下,工业用甲醇空气氧化法制甲醛。
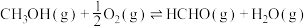
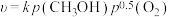
该反应为下面两个基元反应的合并:
反应Ⅰ: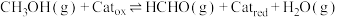

反应Ⅱ: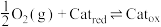

k、k1、k2为速率方程常数,分压p等于其物质的量分数乘以总压,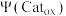 为氧化态催化剂的物质的量分数;
为氧化态催化剂的物质的量分数;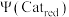 为还原态催化剂的物质的量分数;反应Ⅰ为决速步。
为还原态催化剂的物质的量分数;反应Ⅰ为决速步。
下列说法不正确 的是__________。
(4)处理CO2吸收液:用惰性电极电解吸收液(成分为饱和NaHCO3溶液),阴极区通入CO2共同电解,阴极产物为常见有机物,阳极气体产物吸收后再应用。
现用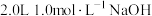 溶液吸收阳极逸出的气体,不考虑气体溶解残留,当电路中转移
溶液吸收阳极逸出的气体,不考虑气体溶解残留,当电路中转移 时,所得溶液中
时,所得溶液中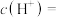
__________  。
。
(已知 的电离常数
的电离常数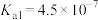 ,
,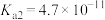 )
)
(1)将二氧化碳转化为甲醇是目前研究的热点之一,在催化剂作用下主要发生以下反应:
Ⅰ.

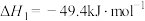
Ⅱ.

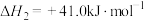
Ⅲ.


反应Ⅲ自发进行的条件及判断依据是
(2)保持压强
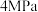 ,将起始
,将起始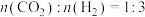 的混合气体匀速通过装有催化剂的反应管,只发生上述反应Ⅰ和反应Ⅱ,测得出口处CO2的转化率和甲醇的选择性[
的混合气体匀速通过装有催化剂的反应管,只发生上述反应Ⅰ和反应Ⅱ,测得出口处CO2的转化率和甲醇的选择性[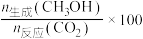 %]与温度的关系如图1、图2所示。
%]与温度的关系如图1、图2所示。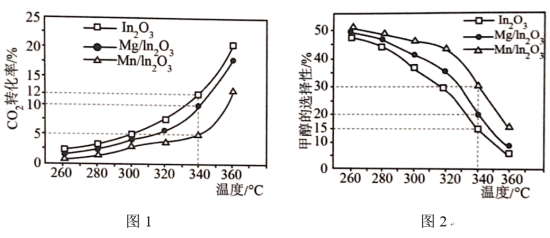
 %,计算340℃时三种催化剂的催化效率之比
%,计算340℃时三种催化剂的催化效率之比
②随着温度的升高,CO2转化率增大,但甲醇选择性降低的原因是
(3)甲醇再应用:在催化剂作用下,工业用甲醇空气氧化法制甲醛。
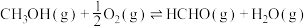
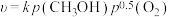
该反应为下面两个基元反应的合并:
反应Ⅰ:
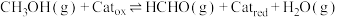

反应Ⅱ:
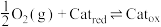

k、k1、k2为速率方程常数,分压p等于其物质的量分数乘以总压,
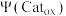 为氧化态催化剂的物质的量分数;
为氧化态催化剂的物质的量分数;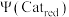 为还原态催化剂的物质的量分数;反应Ⅰ为决速步。
为还原态催化剂的物质的量分数;反应Ⅰ为决速步。下列说法
| A.改用更高效的催化剂可提高反应Ⅰ的平衡转化率 |
B.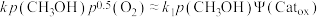 |
| C.Catred在体系中含量很低,升高温度会适当增加Catred在体系中的含量 |
D.若 和 和 的分压增大相同倍数, 的分压增大相同倍数, 比 比 对总反应速率的影响大 对总反应速率的影响大 |
现用
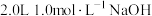 溶液吸收阳极逸出的气体,不考虑气体溶解残留,当电路中转移
溶液吸收阳极逸出的气体,不考虑气体溶解残留,当电路中转移 时,所得溶液中
时,所得溶液中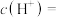
 。
。(已知
 的电离常数
的电离常数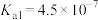 ,
,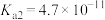 )
)
您最近一年使用:0次
名校
10 . 工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3
(1)反应Ⅰ的熵变ΔS___________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=___________ ,反应Ⅲ自发进行的条件是___________ (填“低温”、“高温”、“任何温度”)。
(2)下列关于尿素合成的说法正确的是___________。
(3)1mol CO(NH2)2(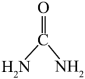 )中含有
)中含有___________ molπ键。NH 离子的VSEPR模型是
离子的VSEPR模型是___________ ,空间构型是___________ 。
(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
反应Ⅰ:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1反应Ⅱ:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3(1)反应Ⅰ的熵变ΔS
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=(2)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后其余气体可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
| D.保持压强不变,降低氨碳比[n(NH3)/n(CO2)]可提高反应Ⅰ中NH3的平衡转化率 |
 )中含有
)中含有 离子的VSEPR模型是
离子的VSEPR模型是(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
| A.N的半径较小 | B.N的未成对电子数较多 |
| C.N的电负性较大 | D.N的第一电离能较高 |
您最近一年使用:0次



