名校
1 . 25℃时,三种酸的电离平衡常数如下:
(1)一般情况下,当温度升高时,
_______ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是_______ (填序号);
a、 b、
b、 c、
c、 d、
d、
(3)下列反应不能发生的是_______ (填序号)
a.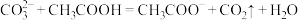
b.
c.
d.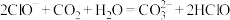
(4)用蒸馏水稀释 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是_______ (填序号);
a.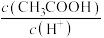 b.
b. c.
c. d.
d.
| 化学式 |  |  |  |
| 电离平衡常数 |  |  , , |  |
(1)一般情况下,当温度升高时,

(2)下列四种离子结合质子能力最强的是
a、
 b、
b、 c、
c、 d、
d、
(3)下列反应不能发生的是
a.
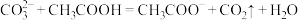
b.

c.

d.
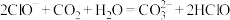
(4)用蒸馏水稀释
 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是a.
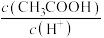 b.
b. c.
c. d.
d.
您最近一年使用:0次
2022-11-08更新
|
355次组卷
|
5卷引用:章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)
(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题江西省遂川中学2021-2022学年高二上学期第二次月考化学(B卷)试题天津市第二十一中学2022-2023学年高二上学期期中调研化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
2 . 下列关于醋酸性质的描述,不能证明它是弱电解质的是
| A.0.1mol·L-1的醋酸溶液中H+浓度约为10-3mol·L-1 |
| B.醋酸溶液中存在CH3COOH分子 |
| C.CH3COONa溶液pH大于7 |
| D.5mL0.1mol·L-1的醋酸溶液与5mL0.1mol·L-1的KOH溶液恰好完全中和 |
您最近一年使用:0次
2022-11-02更新
|
337次组卷
|
5卷引用:第三章 第一节 弱电解质的电离(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)
(已下线)第三章 第一节 弱电解质的电离(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)福建省仙游一中、莆田二中、莆田四中2020-2021学年高二上学期期末联考化学试题广东省化州市第一中学2020-2021学年高二上学期10月月考化学试题四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
13-14高一上·重庆·期末
名校
解题方法
3 . 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
| 非电解质 | C12H22O11(蔗糖) | BaSO4 | C2H5OH | H2O |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-30更新
|
487次组卷
|
66卷引用:1.2.1 电解质的电离-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)
(已下线)1.2.1 电解质的电离-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第1节 水与水溶液人教版(2019)高一必修第一册 第一章 物质及其变化 第二节 离子反应 教材帮(已下线)3.1 弱电解质的电离(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.1.1 强电解质与弱电解质 弱电解质的电离平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)1.2.1 电解质和非电解质-同步学习必备知识(已下线)2012-2013学年重庆市重庆一中高一上学期期末考试化学试卷(已下线)2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷2016届山东省枣庄第三中学高三上10月阶段质检化学试卷2016届辽宁省沈阳东北育才学校高三上第三次模拟化学试卷2015-2016学年湖南省娄底市湘中名校高二上期末理化学试卷2015-2016学年甘肃省嘉峪关市第一中学高二上学期期末化学试卷2016-2017学年黑龙江哈尔滨师大附中高二上期中化学卷河北省邯郸三中2017-2018学年高二上学期第二次月考化学试卷辽宁省阜新二高2017-2018学年高一上学期第二次月考化学试卷陕西省黄陵中学2017-2018学年高二(普通班)上学期期末考试化学试题新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题黑龙江省伊春市第二中学2017-2018学年高二下学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】(已下线)2018年9月30日《每日一题》人教选修4每周一测(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)甘肃省武威市第十八中学2018-2019学年高二上学期期末考试化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期期末考试化学试题【全国百强校】四川省南充市阆中中学2018-2019学年高二下学期3月月考化学试题【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二下学期第一次月考化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题重庆市云阳江口中学校2020届高三上学期第一次月考化学试题甘肃省静宁县第一中学2019-2020学年高二上学期第一次月考化学试题黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期期中考试(A班)化学试题安徽省滁州市定远县育才学校2019-2020学年高一上学期期中考试(实验班)化学试题江西省上饶市上饶中学2019-2020学年高二上学期第二次月考化学(理科实验、重点)试题河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(普通班)(已下线)【南昌新东方】2019 南大附中 高二上 期末云南省玉溪市峨山彝族自治县第一中学2019-2020学年高二下学期期中考试化学试题内蒙古自治区呼和浩特市内蒙古师范大学附属中学2019-2020学年高二上学期期中考试化学试题河南省洛阳市第一高级中学2021届高三9月月考化学试题内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期第一次月考化学试题陕西省延安市吴起高级中学2020-2021学年高二上学期第一次月考化学试题辽宁省铁岭市开原市第二高级中学2020-2021学年高二上学期期初考试化学试题吉林省长春市第二十九中学2020-2021学年高二上学期第二学程考试化学(理)试题新疆昌吉州教育共同体2020-2021学年高二上学期期中考试化学试题甘肃省白银市会宁县第一中学2020-2021学年高二上学期第二次月考化学试题(已下线)练习1 离子反应-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)吉林省长春市第二十九中学2020-2021学年高二上学期期末考试化学试题吉林省汪清县第六中学2020-2021学年高二上学期期末考试化学试题(已下线)第04讲 离子反应 离子方程式(精讲)-2022年一轮复习讲练测江西省鄱阳县第一中学2019-2020学年高二上学期第二次检测化学试题山东省济宁市微山县第二中学2021-2022学年高一上学期第一学段考试化学试题湖北省新高考联考协作体2021-2022学年高二上学期10月联考化学试题江西省南昌市八一中学、洪都中学等4校2021-2022学年高二上学期期中联考化学试题江西省九校2021-2022学年高二上学期期中联考化学试题云南省弥勒市第二中学2020-2021学年高二下学期期中考试化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第二学程考试化学试题四川省内江市威远中学校2021-2022学年高二下学期第一次月考化学试题上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题黑龙江省双鸭山市集贤县一中、四中等2021-2022学年高二下学期期末考试化学试题上海市风华中学2021-2022学年高一上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题安徽省怀宁县第二中学2021-2022学年高二上学期期中考试化学试题辽宁省新民市第一高级中学2021-2022学年高二上学期10月月考化学试题(已下线)第2章能力提升测评-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)新疆阿克苏地区阿瓦提县第四中学2022-2023学年高一上学期第二次诊断性测试化学试题黑龙江省佳木斯市第十二中学2022-2023学年高三上学期开学考试化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题湖南省常德市西洞庭管理区第一中学2022-2023学年高二上学期第二次月考化学试题广西百色市德保高中2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
4 . 用 溶液分别滴定20.00ml
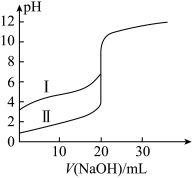
溶液分别滴定20.00ml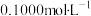 的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
 溶液分别滴定20.00ml
溶液分别滴定20.00ml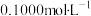 的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
| A.I、II分别表示盐酸和醋酸的滴定曲线 |
| B.pH=7时,滴定盐酸消耗的V(NaOH)大于醋酸消耗的V(NaOH) |
C.V(NaOH)=20.00mL时,两溶液中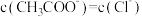 |
D.V(NaOH)=10.00mL时,醋酸溶液中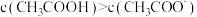 |
您最近一年使用:0次
2022-10-17更新
|
798次组卷
|
5卷引用:实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)北京市北京师范大学附属实验中学2022-2023学年高三上学期月考化学试题河南省鹤壁市高中2022-2023学年高二上学期11月居家测试一化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(选择题11-13)广西壮族自治区苍梧中学2022-2023学年高二下学期3月月考化学试题
22-23高一上·全国·课时练习
解题方法
5 . 强、弱电解质
强电解质与弱电解质比较
强电解质与弱电解质比较
| 强电解质 | 弱电解质 | |
| 定义 | ||
| 溶液中存在微粒种类 | ||
| 举例 | ①强酸: ②强碱: ③绝大部分盐: | ①弱酸: ②弱碱: ③水 |
您最近一年使用:0次
6 . 下列事实中,不能说明甲酸(HCOOH)是弱电解质的是
| A.用相同物质的量浓度的盐酸和甲酸溶液做导电性实验,甲酸溶液的灯光较暗 |
| B.甲酸是共价化合物 |
| C.用pH试纸测得0.1 mol·L-1HCOONa溶液的pH>7 |
| D.常温下,新配制的0.1mol·L-1甲酸溶液的pH约为2.37 |
您最近一年使用:0次
2022-10-04更新
|
115次组卷
|
3卷引用:苏教2020版选择性必修1专题3第四单元 沉淀溶解平衡课后习题
10-11高二上·广东东莞·期中
名校
解题方法
7 . 从下列实验事实所引出的相应结论正确的是
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,析出S沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | 物质的量浓度相同的盐酸和醋酸分别与等质量的、形状相同的锌粒反应 | 反应开始时速率相同 |
| D | 在容积可变的密闭容器中发生反应H2(g)+I2(g)  2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 | 正反应速率加快,逆反应速率不变 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-28更新
|
440次组卷
|
25卷引用:高二人教版选修4 第二章 第二节 影响化学反应速率的因素
高二人教版选修4 第二章 第二节 影响化学反应速率的因素鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节综合训练(已下线)2010年广东省东莞市五校联考高二上学期期中考试化学卷(已下线)2013-2014学年江西省南昌市四校联考高二上学期期中考试化学试卷2015-2016学年四川省宜宾市第三中学高二上学期期中测试化学试卷辽宁省大连育明高级中学2018届高三人教版选修四9.8同步周测二化学试题江西省赣州市崇义中学2017-2018学年高二上学期第一次月考化学试题辽宁省庄河市高级中学2017-2018学年高二10月月考化学试题江苏省启东中学2017-2018学年高一(创新班)上学期期中考试化学试题江西省南昌市第十中学2018-2019学年高二上学期第一次月考化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题江西省赣县三中2018-2019学年高二上学期9月月考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题江西省九江市九江第一中学2019-2020高二上期期中考试化学试题(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》(已下线)【南昌新东方】江西省九江第一中学2019-2020学年高二上学期期中考试化学试题山西省临猗县临晋中学2020-2021学年高二9月月考化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第一次月考化学试题河北省张家口市第一中学2021-2022学年高二上学期10月月考化学试题甘肃省镇原县第二中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题七 化学反应速率与化学平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)山东省潍坊实验中学2022-2023学年高二上学期第一次单元过关检测化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题河南省平顶山市汝州第一高级中学2022-2023学年高二10月月考化学试题(已下线)第1讲 化学反应速率及其影响因素
名校
解题方法
8 . 在一定条件下发生下列反应,其中属于盐类水解反应的是
A. |
B. |
C. |
D. |
您最近一年使用:0次
2022-09-26更新
|
1200次组卷
|
20卷引用:水溶液中的离子反应与平衡——课时5盐类水解
(已下线)水溶液中的离子反应与平衡——课时5盐类水解第1课时 盐类的水解2015-2016学年福建省泉州市四校高二上学期期末化学试卷黑龙江省大庆中学2017-2018学年高二上学期期中考试化学试题福建省三明市第一中学2017-2018学年高二上学期第二次月考化学试题甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期末考试化学试题江西省乐平三中2021-2022高二上学期9月月考化学试题(已下线)周末培优3 盐类的水解-2021-2022学年高二化学课后培优练(人教版选修4)黑龙江省大庆实验中学2021-2022学年高二上学期期中考试化学试题宁夏石嘴山市平罗中学2021-2022学年高二下学期期中考试化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期末考试化学试题 (已下线)第19讲 盐类的水解-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)黑龙江省双鸭山市第一中学2022-2023学年高二上学期期中考试化学试题黑龙江省饶河县高级中学2022-2023学年高二上学期期中考试化学试题福建省莆田第十五中学2022-2023学年高二下学期第一次月考(3月)化学试题新疆维吾尔自治区塔城地区2022-2023学年高二下学期开学考试化学试题山西省阳泉市第一中学校2022-2023学年高二上学期11月期中考试化学试题四川省成都市天府新区太平中学2022-2023学年高二上学期期中考试化学试题广东省潮州市潮安区凤塘中学2023-2024学年高二上学期月考化学试题
9 . 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如图:
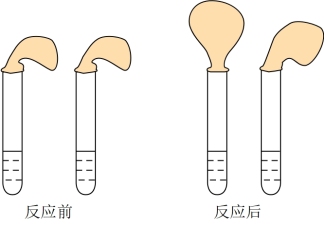
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH____ 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:____ 。
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第____ 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂(选填“A”“B’“C”“D”下同)。
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂。
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA

甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为
 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA
您最近一年使用:0次
2022-09-25更新
|
265次组卷
|
2卷引用:微专题(6) 一元强酸与一元弱酸的比较
名校
10 . 25℃时,以0.10 mol∙L−1盐酸滴定0.10 mol∙L−1一元碱YOH的滴定曲线如图所示,下列表述错误的是
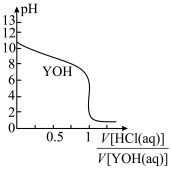

| A.YOH的电离方程式为YOH=Y++OH- | B.此实验可选用甲基橙作指示剂 |
| C.YOH的电离平衡常数Kb≈1×10−5 | D.滴定时盐酸盛放在带活塞的滴定管中 |
您最近一年使用:0次
2022-09-25更新
|
373次组卷
|
3卷引用:实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)河南省豫北名校2022-2023学年高二上学期9月教学质量检测化学试题河南省汝州市第一高级中学2022-2023学年高二上学期11月月考化学试题



