名校
1 . 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇。
该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=‒116 kJ/mol
(1)已知:CO(g)+ O2(g)=CO2(g) △H2= ‒283 kJ/mol
O2(g)=CO2(g) △H2= ‒283 kJ/mol
H2(g)+ O2(g)=H2O(g) △H3= ‒242kJ/mol
O2(g)=H2O(g) △H3= ‒242kJ/mol
则表示l mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:_______________ 。
(2)下列措施中有利于增大该反应的反应速率的是_______ (填字母代号)。
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(3)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为l mol)与CO平衡转化率的关系。

请回答:
①在上述三种温度中,曲线Z对应的温度是_________ ;
②利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=__________ 。
(4)一氧化碳可将金属氧化物还原为金属单质和二氧化碳。四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时,lg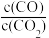 与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是
与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是________ (填化学式)。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________ mol/L。
该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=‒116 kJ/mol
(1)已知:CO(g)+
 O2(g)=CO2(g) △H2= ‒283 kJ/mol
O2(g)=CO2(g) △H2= ‒283 kJ/molH2(g)+
 O2(g)=H2O(g) △H3= ‒242kJ/mol
O2(g)=H2O(g) △H3= ‒242kJ/mol则表示l mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:
(2)下列措施中有利于增大该反应的反应速率的是
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(3)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为l mol)与CO平衡转化率的关系。

请回答:
①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)一氧化碳可将金属氧化物还原为金属单质和二氧化碳。四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时,lg
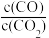 与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是
与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
2020-08-24更新
|
86次组卷
|
2卷引用:湖南省衡阳市第一中学2021届高三上学期第一次月考化学试题
解题方法
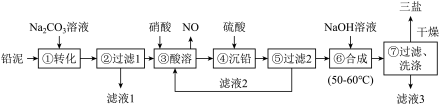
2 . 三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。
已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
(1)步骤①转化的目的是_______ ,滤液1中的溶质为Na2CO3和_______ (填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________ (任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________ 。
(3)滤液2中可循环利用的溶质的化学式为_______ 。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______ mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________ 。
(5)步骤⑥合成三盐的化学方程式为____________ ,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________ 。

已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
| 化合物 | PbSO4 | PbCO3 |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 |
| Ksp | 1.82×10-8 | 1.46×10-13 |
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是
(3)滤液2中可循环利用的溶质的化学式为
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是
(5)步骤⑥合成三盐的化学方程式为
您最近一年使用:0次



