名校
解题方法
1 . 镍氢电池是一种新型绿色电池,利用废旧镍氢电池的金属电极芯(主要成分为 Ni(OH)2、Co(OH)2及少量铁、铝的氧化物等)生产硫酸镍、碳酸钴工艺流程如下图:
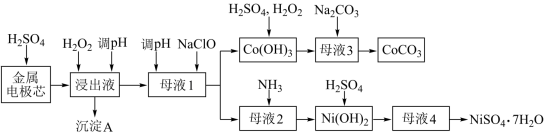
已知:部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
回答下列问题:
(1)用硫酸浸取金属电极芯时,提高浸取效率的方法有_______ (写出一种合理方法即可),向 Co(OH)3 中加入H2O2 的目的是_______ 。
(2)沉淀 A 的主要成分是_______ (填化学式),“浸出液”调节 pH 的范围为_______ 。
(3)“母液3”中控制Na2CO3用量使终点pH 为9.5,此时c(Co2+)小于_______ mol∙L-1(已知:Ksp[Co(OH)2]=1.6×10-15)。
(4)用滴定法测定 NiSO4∙7H2O 产品中镍元素含量。取 2.00g 样品,酸溶后配成 100mL 溶液,取 20.00mL 于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为 0.100mol∙L-1 的 Na2H2Y 标准液滴定,重复操作2~3 次,消耗 Na2H2Y 标准液平均值为 12.40mL。
已知:i. Ni2++H2Y2-=[NiY]2-+2H+;ii. 紫脲酸胺:紫色试剂,遇 Ni2+显橙黄色。
①滴定至终点的现象是_______ ;②样品中镍元素的质量分数为_______ %(保留 3 位有效数字)。
(5)NiSO4 在强碱溶液中和 NaClO 反应,可制得碱性镍镉电池电极材料 NiOOH,该反应的离子方程式为_______ 。

已知:部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
| 离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
| 开始沉淀时 pH | 6.3 | 1.5 | 3.4 | 6.2 | 7.15 |
| 完全沉淀时 pH | 8.3 | 2.8 | 4.7 | 8.9 | 9.15 |
(1)用硫酸浸取金属电极芯时,提高浸取效率的方法有
(2)沉淀 A 的主要成分是
(3)“母液3”中控制Na2CO3用量使终点pH 为9.5,此时c(Co2+)小于
(4)用滴定法测定 NiSO4∙7H2O 产品中镍元素含量。取 2.00g 样品,酸溶后配成 100mL 溶液,取 20.00mL 于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为 0.100mol∙L-1 的 Na2H2Y 标准液滴定,重复操作2~3 次,消耗 Na2H2Y 标准液平均值为 12.40mL。
已知:i. Ni2++H2Y2-=[NiY]2-+2H+;ii. 紫脲酸胺:紫色试剂,遇 Ni2+显橙黄色。
①滴定至终点的现象是
(5)NiSO4 在强碱溶液中和 NaClO 反应,可制得碱性镍镉电池电极材料 NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-03-17更新
|
401次组卷
|
2卷引用:湖南省衡阳县第四中学2022-2023学年高三下学期4月月考化学试题
名校
解题方法
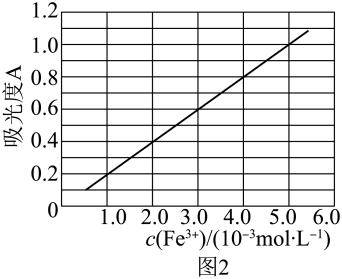
2 . 透明铁黄(FeOOH)是一种分散性良好的铁系颜料。工业上采用硫铁矿熔烧去硫后烧渣(主要成分为 、FeO、
、FeO、 、
、 、不考虑其他杂质)制备透明铁黄工艺流程如下:
、不考虑其他杂质)制备透明铁黄工艺流程如下:
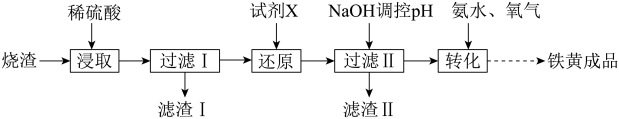
(1)浸取液中 的核外电子排布式为
的核外电子排布式为_______ 。
(2)“过滤I”后,滤液中所含金属阳离子有_______ 。
(3)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为_______ 。
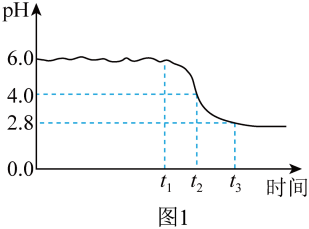
(4)制备铁黄:向一定浓度 溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
已知:25℃时, 完全沉淀(离子浓度
完全沉淀(离子浓度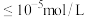 )的
)的 。
。
①滴加氨水产生沉淀,当pH为6.0时,溶液中残留 浓度为
浓度为_______ mol/L。
②请写出0~ 时段发生的化学方程式
时段发生的化学方程式_______ ; ~
~ 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:_______ 。
(5)制得的透明铁黄中往往混有氧化铁,可用分光光度法测定透明铁黄的含量。已知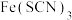 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。_______
 、FeO、
、FeO、 、
、 、不考虑其他杂质)制备透明铁黄工艺流程如下:
、不考虑其他杂质)制备透明铁黄工艺流程如下:
(1)浸取液中
 的核外电子排布式为
的核外电子排布式为(2)“过滤I”后,滤液中所含金属阳离子有
(3)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为
(4)制备铁黄:向一定浓度
 溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
已知:25℃时,
 完全沉淀(离子浓度
完全沉淀(离子浓度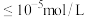 )的
)的 。
。①滴加氨水产生沉淀,当pH为6.0时,溶液中残留
 浓度为
浓度为②请写出0~
 时段发生的化学方程式
时段发生的化学方程式 ~
~ 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:(5)制得的透明铁黄中往往混有氧化铁,可用分光光度法测定透明铁黄的含量。已知
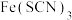 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
您最近一年使用:0次
2022-09-03更新
|
279次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月期中化学试题
名校
解题方法
3 . 下图是一种处理废锌锰干电池的流程,电池内除铜帽、锌皮(含少量铁)、石墨棒外,还含有MnOOH、ZnCl2、NH4Cl、C及有机物等糊状填充物。
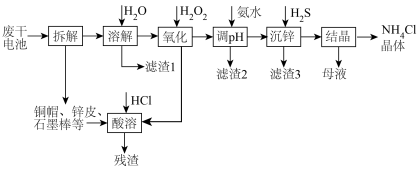
回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有_______ ;(写一条即可)
(2)将“滤渣1”灼烧有 生成,产生
生成,产生 的化学方程式为
的化学方程式为_______ ;
(3)“氧化”过程中,还原产物是_______ ;
(4)“滤渣2”的主要成分是_______ ;
(5)“调pH”时,应控制溶液pH的范围是_______ ;(已知:“溶解”后的溶液中c(Zn2+)=0.10mol/L,忽略滴加 、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
(6)写出“沉锌”的离子方程式________ ;
(7)测定NH4Cl晶体中的氮元素含量:准确称取样品0.100g放至锥形瓶中,加适量的水完全溶解,再加5mL中性甲醛溶液(足量),摇匀,静置,用0.100mol/L的NaOH标准溶液平行滴定三次,消耗标准溶液的平均体积为18.50mL,则样品中氮元素的质量分数为_______ 。
[已知:4 +6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
+6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]

回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有
(2)将“滤渣1”灼烧有
 生成,产生
生成,产生 的化学方程式为
的化学方程式为(3)“氧化”过程中,还原产物是
(4)“滤渣2”的主要成分是
(5)“调pH”时,应控制溶液pH的范围是
 、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)(6)写出“沉锌”的离子方程式
(7)测定NH4Cl晶体中的氮元素含量:准确称取样品0.100g放至锥形瓶中,加适量的水完全溶解,再加5mL中性甲醛溶液(足量),摇匀,静置,用0.100mol/L的NaOH标准溶液平行滴定三次,消耗标准溶液的平均体积为18.50mL,则样品中氮元素的质量分数为
[已知:4
 +6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
+6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
您最近一年使用:0次
2022-05-07更新
|
323次组卷
|
2卷引用:湖南省株洲市醴陵市第一中学2023届高三月考(五)化学试题
名校
4 . CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如图:
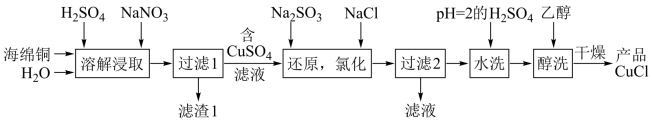
(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
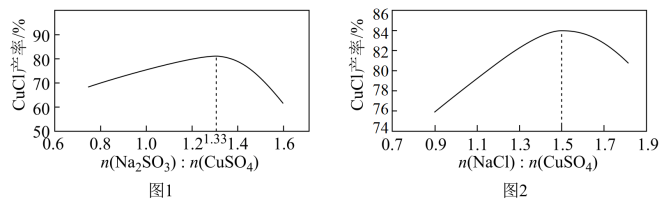
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___ 。
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___ 。
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是___ 。
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为___ 。
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数___ (写计算过程)。

(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O
 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数
您最近一年使用:0次
2021-12-22更新
|
738次组卷
|
7卷引用:湖南省益阳市第一中学2021-2022学年高二下学期期末考试化学试题
湖南省益阳市第一中学2021-2022学年高二下学期期末考试化学试题江苏省前黄高级中学、如东中学、姜堰中学2021-2022学年高三上学期12月份阶段性测试化学试题江苏省姜堰中学、如东中学、前黄中学三校2021- 2022学年高三联考化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省徐州市第七中学2021-2022学年高三下学期2月检测化学试题(已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)
名校
5 . 通过佛尔哈德法可以测定三氯氧磷(POCl3)样品中Cl元素的含量,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是
| A.滴定选用的指示剂为甲基橙 |
B.本次实验测得Cl元素的质量分数为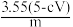 % % |
| C.硝基苯的作用为防止沉淀被氧化 |
| D.若取消步骤Ⅲ,测定结果偏大 |
您最近一年使用:0次
2021-05-20更新
|
687次组卷
|
4卷引用:湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题
湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题辽宁省葫芦岛市2021届高三第二次模拟考试化学试题(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)2023年高考山东卷化学真题变式题(选择题6-10)
名校
解题方法
6 . MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如图。
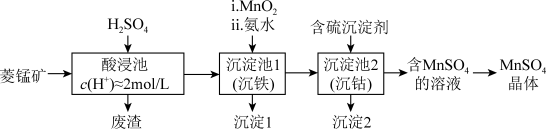
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括Mn2+、Co2+、____________ 。
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:_____________ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
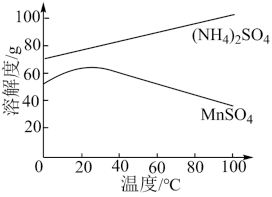
(4)图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为_________ ,洗涤干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗 (NH4)2Fe(SO4)2溶液的体积为c mL,MnO4-重新变成Mn2+。
①补全步骤ⅱ中反应的离子方程式:__________ 。
2Mn2++ S2O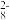 +_____ = MnO
+_____ = MnO + +__+
+ +__+
②废渣中锰元素的质量分数为________ 。
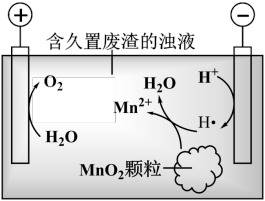
(6)废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用下图装置提取MnO2中的锰元素。图中“H·”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的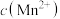 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是__________ (写出两条)。


资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为

(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗 (NH4)2Fe(SO4)2溶液的体积为c mL,MnO4-重新变成Mn2+。
①补全步骤ⅱ中反应的离子方程式:
2Mn2++ S2O
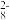 +_____ = MnO
+_____ = MnO + +__+
+ +__+ ②废渣中锰元素的质量分数为
(6)废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用下图装置提取MnO2中的锰元素。图中“H·”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的
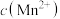 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是
您最近一年使用:0次
2021-05-20更新
|
875次组卷
|
11卷引用:湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题
湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题北京市海淀区2021届高三一模化学试题福建省厦门英才学校2021届高三4模考试化学试题河北省武邑中学2021届高考七模化学试题(已下线)微专题18 金属及其化合物制备流程(Mn)-备战2022年高考化学考点微专题北京市第一七一中学2021-2022学年高二上学期12月月考化学试题陕西省西安市长安区2021-2022学年高三上学期期末质量检测化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题北京市第一六六中学2023-2024学年高三上学期期中考试化学试题北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷北京市第八中学2023-2024学年高三上学期12月月考化学试题
解题方法
7 . 铝灰主要含有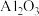 、
、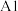 ,以及少量
,以及少量 和
和 的氧化物,下边是利用铝灰制备净水剂
的氧化物,下边是利用铝灰制备净水剂 的工艺流程,回答相关问题:
的工艺流程,回答相关问题:

已知:金属离子浓度为 时生成氢氧化物沉淀的
时生成氢氧化物沉淀的
(1)气体x的分子式是___________ ,酸浸充分后溶液中的金属阳离子是___________ 。
(2)操作Ⅰ和Ⅱ用到的玻璃仪器有烧杯、玻璃棒、___________ 。
(3)加过量 溶液的目的是
溶液的目的是___________ 。
(4)棕色沉淀含 。操作①加入
。操作①加入 反应的离子方程式是
反应的离子方程式是___________ ,判断该反应完成的现象是___________ 。
(5)操作②调 的范围是
的范围是___________ 。
(6) 可制作聚合硫酸铝
可制作聚合硫酸铝 ,它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若
,它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则
,则
___________ 。引起聚合硫酸铝形态多变的基本成分是 离子,可用实验测定其含量。称取
离子,可用实验测定其含量。称取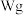 试样,将其移入锥形瓶中,用移液管加入
试样,将其移入锥形瓶中,用移液管加入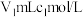 盐酸,充分溶解聚合物后,加
盐酸,充分溶解聚合物后,加 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用
氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液
氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中
。则聚合硫酸铝中 的质量分数为
的质量分数为___________ 。
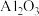 、
、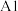 ,以及少量
,以及少量 和
和 的氧化物,下边是利用铝灰制备净水剂
的氧化物,下边是利用铝灰制备净水剂 的工艺流程,回答相关问题:
的工艺流程,回答相关问题:
已知:金属离子浓度为
 时生成氢氧化物沉淀的
时生成氢氧化物沉淀的
 |  |  | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(2)操作Ⅰ和Ⅱ用到的玻璃仪器有烧杯、玻璃棒、
(3)加过量
 溶液的目的是
溶液的目的是(4)棕色沉淀含
 。操作①加入
。操作①加入 反应的离子方程式是
反应的离子方程式是(5)操作②调
 的范围是
的范围是(6)
 可制作聚合硫酸铝
可制作聚合硫酸铝 ,它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若
,它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则
,则
 离子,可用实验测定其含量。称取
离子,可用实验测定其含量。称取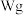 试样,将其移入锥形瓶中,用移液管加入
试样,将其移入锥形瓶中,用移液管加入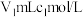 盐酸,充分溶解聚合物后,加
盐酸,充分溶解聚合物后,加 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用
氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液
氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中
。则聚合硫酸铝中 的质量分数为
的质量分数为
您最近一年使用:0次
2021-03-05更新
|
317次组卷
|
2卷引用:2024届湖南省衡阳县第四中学高三上学期第一次月考化学试题
名校
8 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
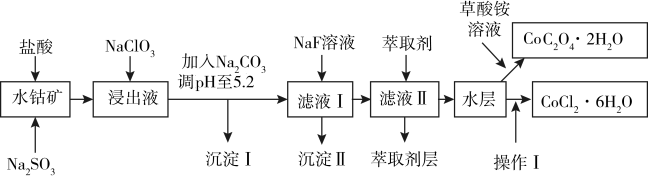
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3目的是___ 。
(2)NaClO3在浸出液中发生反应的离子方程式为___ 。
(3)加入Na2CO3调pH至5.2,目的是___ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__ 。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___ 、__ 、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___ (回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____ 。[已知:CoC2O4·2H2O的摩尔质量为183g·mol−1]

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为
您最近一年使用:0次
2019-11-22更新
|
785次组卷
|
6卷引用:湖南省长沙市长郡中学2021-2022学年高三下学期第一次模考化学试题
解题方法
9 . 回答下列问题
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为___________ 。
(2)常温下,用 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡___________ (填“向左”、“向右”或“不”)移动。试计算该溶液中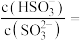
___________ (常温下 的电离平衡常数
的电离平衡常数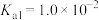 ,
,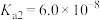 )。
)。
(3)保险粉样品中 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为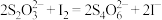 。准确称取
。准确称取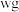 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用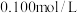 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
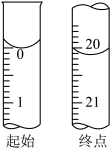
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是___________ 。滴定起始和终点的液面位置如图所示。则样品的纯度为___________ 。(设 的摩尔质量为
的摩尔质量为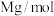 )
)
(4)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为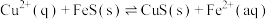 。下列有关叙述正确的是
。下列有关叙述正确的是___________ 。
a、
b、达到平衡时
c、该反应平衡常数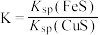
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为(2)常温下,用
 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡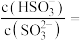
 的电离平衡常数
的电离平衡常数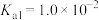 ,
,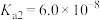 )。
)。(3)保险粉样品中
 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为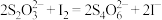 。准确称取
。准确称取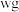 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用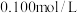 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是 的摩尔质量为
的摩尔质量为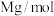 )
)
(4)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为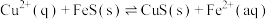 。下列有关叙述正确的是
。下列有关叙述正确的是a、

b、达到平衡时

c、该反应平衡常数
您最近一年使用:0次
名校
解题方法
10 . 铁、镍及其化合物在工业上有广泛的应用。
Ⅰ.从某矿渣[成分为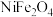 (铁酸镍)、
(铁酸镍)、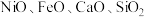 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:
(1)用95℃热水浸泡的目的是________________ ;
(2)矿渣中部分 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是________ ;
(3)向“浸取液”中加入 以除去溶液中
以除去溶液中 (浓度为
(浓度为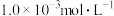 ),除钙率为
),除钙率为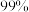 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是________  ;
;
(4)从 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是________ ,过滤,洗涤,干燥;
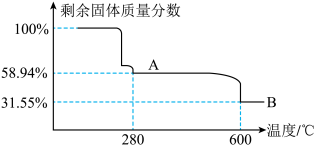
(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是________ ;
(6)基态镍离子 的核外最外层电子排布式是
的核外最外层电子排布式是________ ;
(7) 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为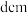 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是________  (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是________  (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
Ⅰ.从某矿渣[成分为
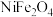 (铁酸镍)、
(铁酸镍)、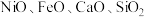 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: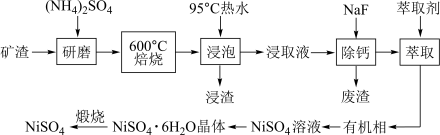
 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:(1)用95℃热水浸泡的目的是
(2)矿渣中部分
 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是(3)向“浸取液”中加入
 以除去溶液中
以除去溶液中 (浓度为
(浓度为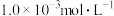 ),除钙率为
),除钙率为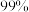 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是 ;
;(4)从
 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是
(6)基态镍离子
 的核外最外层电子排布式是
的核外最外层电子排布式是(7)
 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为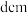 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是 (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是 (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-03-22更新
|
346次组卷
|
2卷引用:湖南省邵阳市2024届高三二模化学试题



