名校
解题方法
1 . ZnS常用于制造白色颜料、发光粉和发光油漆等。以火法炼铜的废料(主要成分是ZnO、CuO,含少量PbO、As2O3、SiO2等)为原料制备粗锌和硫化锌的流程如图:
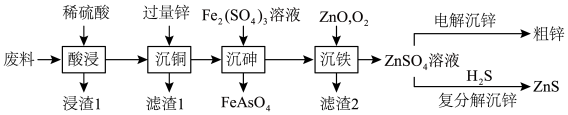
请回答下列问题:
(1)“浸渣1”的主要成分是____ (填化学式)。
(2)从“滤渣1”中提取粗铜的操作是将滤渣1____ 、过滤、洗涤、干燥,得到粗铜。
(3)“沉铁”中O2的作用是____ (用离子方程式表示)。
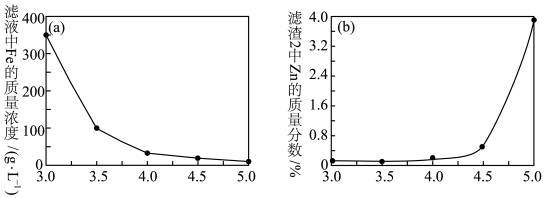
(4)加入ZnO调节溶液pH,滤液中Fe的质量浓度、滤渣2中Zn的质量分数与pH关系如图所示。最适宜的pH为____ 。
(5)以惰性材料为电极,“电解沉锌”的阳极反应式为____ 。
(6)“复分解沉锌”中,Zn2++H2S ZnS↓+2H+的平衡常数K=
ZnS↓+2H+的平衡常数K=____ 。[已知:常温下,Ksp(ZnS)=3.0×10-25,H2S的电离常数Ka1=9.0×10-8,Ka2=1.0×10-15]

请回答下列问题:
(1)“浸渣1”的主要成分是
(2)从“滤渣1”中提取粗铜的操作是将滤渣1
(3)“沉铁”中O2的作用是
(4)加入ZnO调节溶液pH,滤液中Fe的质量浓度、滤渣2中Zn的质量分数与pH关系如图所示。最适宜的pH为

(5)以惰性材料为电极,“电解沉锌”的阳极反应式为
(6)“复分解沉锌”中,Zn2++H2S
 ZnS↓+2H+的平衡常数K=
ZnS↓+2H+的平衡常数K=
您最近一年使用:0次
2 . 钪(Sc)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),还含有少量SiO2、Sc2O3等氧化物,从钛铁矿中提取Sc2O3的流程如下:
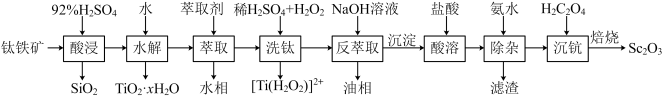
已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
③lg2=0.3,Ksp[Sc(OH)3]=1.25×10-33。回答下列问题:
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是___________ 。
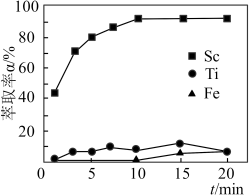
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________ min。
(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是___________ 。
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。

已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | TiO2+ |
| 沉淀完全的pH | 3.2 | 9.0 | 1.05 |
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为

(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 钕铁硼废料中一般含有30%的稀土元素和少量的钴、锰、镍等金属。稀土元素经萃取分离后萃余液化学成分见下表:
从萃余液中回收氧化钴的工艺流程如下:

已知:①萃取剂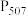 和
和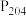 均为磷酸酯,结构为
均为磷酸酯,结构为
②已知常温时相关物质的溶度积
回答下列问题:
(1)P元素在元素周期表中的位置为___________ ,萃取剂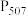 中P原子的杂化类型为
中P原子的杂化类型为___________ 。
(2)已知“滤液1”中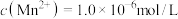 ,则滤液1中
,则滤液1中 的浓度为
的浓度为___________ 。
(3)已知“滤渣”的主要成分为S,写出“酸分解”时 发生反应的离子方程式
发生反应的离子方程式___________ 。
(4)反萃取的目的是___________ 。
(5)“沉钴”后需将沉淀洗净,检验沉淀已洗净的方法是___________ 。
(6)“煅烧”可在纯氩气中进行,写出煅烧反应的化学方程式___________ 。若在空气中煅烧,温度高于400℃时会得到另一种钴的氧化物。已知固体残留率为54.6%,则该氧化物的化学式为___________ (残留率= ×100%)。
×100%)。
| 成分 |  |  |  |  |  |  |
含量 | <0.01 | 65.33 | 10.35 | 1.56 | 0.51 | 0.16 |

已知:①萃取剂
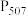 和
和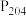 均为磷酸酯,结构为
均为磷酸酯,结构为
②已知常温时相关物质的溶度积
| 化学式 |  |  |  |
 |  | 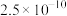 | 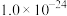 |
(1)P元素在元素周期表中的位置为
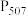 中P原子的杂化类型为
中P原子的杂化类型为(2)已知“滤液1”中
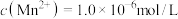 ,则滤液1中
,则滤液1中 的浓度为
的浓度为(3)已知“滤渣”的主要成分为S,写出“酸分解”时
 发生反应的离子方程式
发生反应的离子方程式(4)反萃取的目的是
(5)“沉钴”后需将沉淀洗净,检验沉淀已洗净的方法是
(6)“煅烧”可在纯氩气中进行,写出煅烧反应的化学方程式
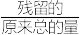 ×100%)。
×100%)。
您最近一年使用:0次
2023-06-03更新
|
439次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题
名校
解题方法
4 . 工业上用含三价钒( )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:

【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
(1)焙烧:向石煤中加生石灰焙烧,将 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
(2)酸浸:
① 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是_______ 。
②酸度对钒和铝的溶解量的影响如图所示:
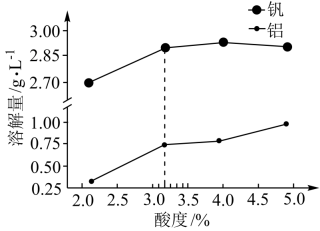
酸浸时溶液的酸度控制在大约3.2%,根据图推测,酸浸时不选择更高酸度的原因是_______ 。
(3)转沉:将浸出液中的钒转化为 固体,其流程如下:
固体,其流程如下:

①浸出液中加入石灰乳的作用是_______ 。
②已知 的溶解度小于
的溶解度小于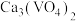 。向
。向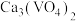 沉淀中加入
沉淀中加入 溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:
溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:_______ 。
③向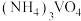 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是_______ 。
(4)测定产品中 的纯度:称取ag产品,先用硫酸溶解,得到
的纯度:称取ag产品,先用硫酸溶解,得到 溶液。再加入
溶液。再加入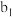 mL
mL 
 溶液(
溶液(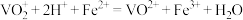 )。最后用
)。最后用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 mL。已知
mL。已知 被还原为
被还原为 ,假设杂质不参与反应。则产品中
,假设杂质不参与反应。则产品中 的质量分数是
的质量分数是_______ 。( 的摩尔质量:
的摩尔质量: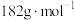 )
)
(5)全钒液流电池是具有发展前景的、用作储能系统的蓄电池,已知放电时 发生氧化反应,电池原理(电解液中含
发生氧化反应,电池原理(电解液中含 )如图:
)如图:
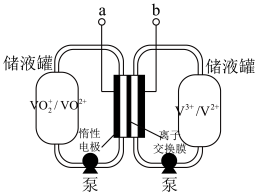
①a是_______ (填“正极”或“负极”)。
②该蓄电池反应方程式为_______ (标出“充电”“放电”方向)。
 )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
 转化为
转化为 的化学方程式是
的化学方程式是(2)酸浸:
①
 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是②酸度对钒和铝的溶解量的影响如图所示:

酸浸时溶液的酸度控制在大约3.2%,根据图推测,酸浸时不选择更高酸度的原因是
(3)转沉:将浸出液中的钒转化为
 固体,其流程如下:
固体,其流程如下:
①浸出液中加入石灰乳的作用是
②已知
 的溶解度小于
的溶解度小于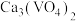 。向
。向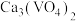 沉淀中加入
沉淀中加入 溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:
溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:③向
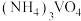 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是(4)测定产品中
 的纯度:称取ag产品,先用硫酸溶解,得到
的纯度:称取ag产品,先用硫酸溶解,得到 溶液。再加入
溶液。再加入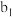 mL
mL 
 溶液(
溶液(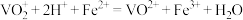 )。最后用
)。最后用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 mL。已知
mL。已知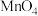 被还原为
被还原为 ,假设杂质不参与反应。则产品中
,假设杂质不参与反应。则产品中 的质量分数是
的质量分数是 的摩尔质量:
的摩尔质量: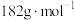 )
)(5)全钒液流电池是具有发展前景的、用作储能系统的蓄电池,已知放电时
 发生氧化反应,电池原理(电解液中含
发生氧化反应,电池原理(电解液中含 )如图:
)如图:
①a是
②该蓄电池反应方程式为
您最近一年使用:0次
2022-05-30更新
|
390次组卷
|
3卷引用:湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题
名校
5 . 某废水中含有 和
和 ,
, 浓度远大于
浓度远大于 。用
。用 溶液调节该废水
溶液调节该废水 (溶液体积变化忽略不计),上层清液中铜元素的含量随
(溶液体积变化忽略不计),上层清液中铜元素的含量随 变化如图所示。
变化如图所示。 在溶液中可形成
在溶液中可形成 和
和 。
。
下列说法不正确 的是
 和
和 ,
, 浓度远大于
浓度远大于 。用
。用 溶液调节该废水
溶液调节该废水 (溶液体积变化忽略不计),上层清液中铜元素的含量随
(溶液体积变化忽略不计),上层清液中铜元素的含量随 变化如图所示。
变化如图所示。
 在溶液中可形成
在溶液中可形成 和
和 。
。下列说法
A.a~b段:随 升高, 升高,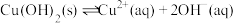 平衡逆向移动 平衡逆向移动 |
B.b~c段:发生反应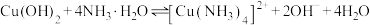 |
C.c-d段:随 升高,溶液中的 升高,溶液中的 浓度上升,再次出现 浓度上升,再次出现 沉淀 沉淀 |
D.推测d点以后,随 升高,上层清液中铜元素含量持续下降 升高,上层清液中铜元素含量持续下降 |
您最近一年使用:0次
2023-05-07更新
|
848次组卷
|
4卷引用:湖南省长沙市一中2024届高三高考适应性演练(二)化学试题
6 . 世界上铬单质及其化合物的生产量呈现高速增长趋势,故铬贫矿的利用至关重要,某铬贫矿主要成分为 ,还含有
,还含有 、
、 、
、 ,采用次氯酸钠法处理矿石并制备
,采用次氯酸钠法处理矿石并制备 的工艺流程如图所示:
的工艺流程如图所示:

回答下列问题:
(1)为了提高“氧化浸出”效率,可采取的措施有___________ (任答一条)。
(2)已知经“氧化浸出”后,铁元素以 形式存在,该过程中
形式存在,该过程中 参与反应的化学方程式为
参与反应的化学方程式为___________ 。
(3)滤渣可能含有的物质有___________ (填化学式)。
(4)经“沉铝”后所得溶液中 的浓度为
的浓度为 ,已知:常温下,
,已知:常温下, ;
; ,此时溶液中
,此时溶液中
___________  ,
,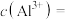
___________  。
。
(5)实验室将浓硫酸和 溶液“混合”时的具体实验操作为
溶液“混合”时的具体实验操作为___________ 。
(6)以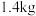 铬贫矿为原料,按照此流程最终得到
铬贫矿为原料,按照此流程最终得到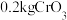 ,核算的原料利用率为
,核算的原料利用率为 ,则该铬贫矿中铬的百分含量[以
,则该铬贫矿中铬的百分含量[以 计]为
计]为___________ 。
(7)以节能环保为原则,试以化合物②为原料制定在此工艺流程中的循环利用方案:___________ (结合化学方程式用文字说明)。
 ,还含有
,还含有 、
、 、
、 ,采用次氯酸钠法处理矿石并制备
,采用次氯酸钠法处理矿石并制备 的工艺流程如图所示:
的工艺流程如图所示:
回答下列问题:
(1)为了提高“氧化浸出”效率,可采取的措施有
(2)已知经“氧化浸出”后,铁元素以
 形式存在,该过程中
形式存在,该过程中 参与反应的化学方程式为
参与反应的化学方程式为(3)滤渣可能含有的物质有
(4)经“沉铝”后所得溶液中
 的浓度为
的浓度为 ,已知:常温下,
,已知:常温下, ;
; ,此时溶液中
,此时溶液中
 ,
,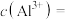
 。
。(5)实验室将浓硫酸和
 溶液“混合”时的具体实验操作为
溶液“混合”时的具体实验操作为(6)以
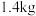 铬贫矿为原料,按照此流程最终得到
铬贫矿为原料,按照此流程最终得到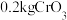 ,核算的原料利用率为
,核算的原料利用率为 ,则该铬贫矿中铬的百分含量[以
,则该铬贫矿中铬的百分含量[以 计]为
计]为(7)以节能环保为原则,试以化合物②为原料制定在此工艺流程中的循环利用方案:
您最近一年使用:0次
名校
解题方法
7 . 以铁镍合金(含少量铜)为原料,生产电极材料 的部分工艺流程如下:
的部分工艺流程如下:
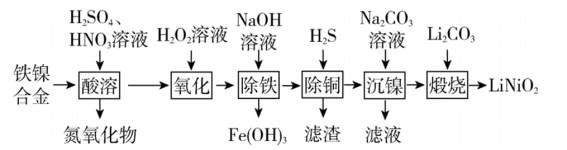
已知:(1)表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 计算)。
计算)。
(2)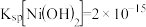 ;
;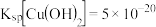 。
。
回答下列问题。
(1) 中
中 的化合价为
的化合价为__ 。“酸溶”时 转化为
转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是__ 。
(2)“酸溶”时镍生成 ,写出铁镍合金中镍参与反应的离子方程式:
,写出铁镍合金中镍参与反应的离子方程式:____ 。
(3)“除铜”时若选用 ,会导致部分
,会导致部分 也产生沉淀,当溶液中
也产生沉淀,当溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中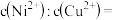
__ 。
(4)“沉镍”时得到碳酸镍( )沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
)沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式为
,该反应的化学方程式为____ 。
(5)“沉镍”后的滤液中主要是 和
和 ,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是
,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是__ 。
(6)已知铁镍合金中镍的质量分数为29.5%,称取10.0g合金,最终制得4.7g ,则合金中
,则合金中 的利用率为
的利用率为____ (保留两位有效数字)。
 的部分工艺流程如下:
的部分工艺流程如下:
已知:(1)表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0
 计算)。
计算)。| 开始沉淀的pH | 沉淀完全的pH | |
 | 6.7 | 9.5 |
 | 1.1 | 3.2 |
 | 5.8 | 8.8 |
 | 4.2 | 7.2 |
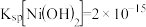 ;
;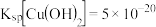 。
。回答下列问题。
(1)
 中
中 的化合价为
的化合价为 转化为
转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是(2)“酸溶”时镍生成
 ,写出铁镍合金中镍参与反应的离子方程式:
,写出铁镍合金中镍参与反应的离子方程式:(3)“除铜”时若选用
 ,会导致部分
,会导致部分 也产生沉淀,当溶液中
也产生沉淀,当溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中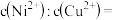
(4)“沉镍”时得到碳酸镍(
 )沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
)沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式为
,该反应的化学方程式为(5)“沉镍”后的滤液中主要是
 和
和 ,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是
,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是(6)已知铁镍合金中镍的质量分数为29.5%,称取10.0g合金,最终制得4.7g
 ,则合金中
,则合金中 的利用率为
的利用率为
您最近一年使用:0次
2021-04-19更新
|
278次组卷
|
4卷引用:湖南省株洲市南方中学2021-2022学年高三下学期4月月考化学试题
湖南省株洲市南方中学2021-2022学年高三下学期4月月考化学试题辽宁省“决胜新高考·名校交流“2021届高三3月联考化学试题(已下线)微专题18 金属及其化合物制备流程(Ni)-备战2022年高考化学考点微专题内蒙古海拉尔第二中学2021-2022学年高三上学期期末考试理科综合化学试题
名校
解题方法
8 .  是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。

已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:_______ 。
(2)“除杂1”时,加入 的作用是
的作用是_______ (用离子方程式表示)。
(3)“固体1”中除了含有 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为_______ ,则“除杂1”过程调节pH范围为_______ 。
(4)在高温下“合成” ,反应的化学方程式为
,反应的化学方程式为_______ 。
(5)已知:常温下,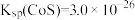 。为了使残液中
。为了使残液中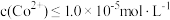 ,必须控制
,必须控制 ≥
≥_______ mol/L。
(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;
第3步:用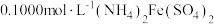 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。
已知: 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。
①“浸渣”中锰元素的质量分数为_______ (用含W、V的代数式表示)。
②如果省略第2步“煮沸溶液”,测得结果将_______ (填“偏高”、“偏低”或“无影响”)。
 是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。
已知几种金属氢氧化物沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 7.6 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.1 | 9.1 | 9.2 |
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:
(2)“除杂1”时,加入
 的作用是
的作用是(3)“固体1”中除了含有
 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为(4)在高温下“合成”
 ,反应的化学方程式为
,反应的化学方程式为(5)已知:常温下,
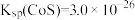 。为了使残液中
。为了使残液中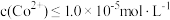 ,必须控制
,必须控制 ≥
≥(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以
 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;第3步:用
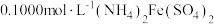 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。已知:
 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。①“浸渣”中锰元素的质量分数为
②如果省略第2步“煮沸溶液”,测得结果将
您最近一年使用:0次
2022-04-18更新
|
350次组卷
|
4卷引用:湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题
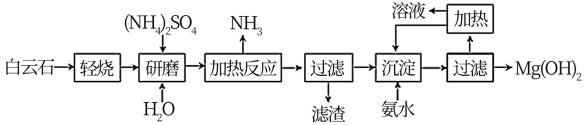
9 . Mg(OH)2是优良的阻燃剂、吸附剂,可以白云石(化学式表示为MgCO3∙CaCO3)为原料来制备。工艺流程如图所示:
回答下列问题:
(1)已知“轻烧”过程中只有碳酸镁发生分解,写出“加热反应”时主要发生反应的化学方程式:____ 。
(2)该工艺中可以循环使用的物质是_____ (填化学式)。
(3)Mg(OH)2可作阻燃材料的原因为_____
(4)“沉淀”时发生反应的离子方程式为_____ 。已知:常温下Ksp[Mg(OH)2]=1.8×10-11,若加入氨水调节溶液的pH=10,通过计算说明溶液中Mg2+是否沉淀完全(离子浓度小于10-5mol·L-1认为沉淀完全):
(5)Mg(OH)2纯度测定。为测定产品纯度,称取试样0.2500g于锥形瓶中,加入适量稀盐酸,待试样完全溶解后加入10mLpH=10的氨一氯化铁缓冲溶液,溶液变浑浊,再滴加3~4滴铬黑T指示剂(BET),用0.2000mol·L-1的EDTA标准溶液滴定至终点,重复上述操作两次,平均消耗EDTA标准溶液20.00mL。[原理:EDTA(无色)+Mg—BET紫红色)=BET(蓝色)+Mg-EDTA(无色)]
①滴定终点的现象为_____ 。
②产品中Mg(OH)2的质量分数为_____ (保留四位有效数字)。

回答下列问题:
(1)已知“轻烧”过程中只有碳酸镁发生分解,写出“加热反应”时主要发生反应的化学方程式:
(2)该工艺中可以循环使用的物质是
(3)Mg(OH)2可作阻燃材料的原因为
(4)“沉淀”时发生反应的离子方程式为
(5)Mg(OH)2纯度测定。为测定产品纯度,称取试样0.2500g于锥形瓶中,加入适量稀盐酸,待试样完全溶解后加入10mLpH=10的氨一氯化铁缓冲溶液,溶液变浑浊,再滴加3~4滴铬黑T指示剂(BET),用0.2000mol·L-1的EDTA标准溶液滴定至终点,重复上述操作两次,平均消耗EDTA标准溶液20.00mL。[原理:EDTA(无色)+Mg—BET紫红色)=BET(蓝色)+Mg-EDTA(无色)]
①滴定终点的现象为
②产品中Mg(OH)2的质量分数为
您最近一年使用:0次
2021-07-30更新
|
449次组卷
|
5卷引用:湖南省武冈市第二中学2022届高三下学期期中考试化学试题
10 . 我国钛资源丰富,但钛矿品位低,且有一半的钛资源是以类质同象形式赋存于钒钛磁铁矿中,难以利用,因此需通过冶炼形成钛渣后再用于提取二氧化钛。利用钛渣(主要成分为 ,含少量铁的氧化物等)采用混合硫酸法制备
,含少量铁的氧化物等)采用混合硫酸法制备 ,该工艺适用于高品钛。具体流程如下:
,该工艺适用于高品钛。具体流程如下:

已知:①六氯钛酸钾是一种无机物,化学式 ,可溶于热水,微溶于冷水。
,可溶于热水,微溶于冷水。
②
③当离子浓度小于10⁻⁵mol/L时视为沉淀完全。
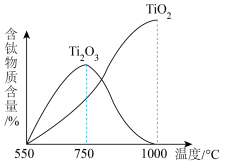
 与氧气反应产物含钛物质含量随温度变化如图所示。
与氧气反应产物含钛物质含量随温度变化如图所示。
请回答:
(1)为提高酸解率,可以采用的措施有___________ 。(任写一点)
(2)向 溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得
溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得 晶体,请写出具体操作
晶体,请写出具体操作___________ 、过滤、洗涤、干燥。
(3) 晶体进行加热分解生成
晶体进行加热分解生成 和“残渣”,“残渣”是
和“残渣”,“残渣”是___________ 。
(4)室温下,若 的
的 为
为 ,若要使得
,若要使得 中的
中的 完全沉淀,需调节pH到
完全沉淀,需调节pH到___________ 。
(5)为获取更为纯净的 ,应控制反应温度T高于
,应控制反应温度T高于___________ 。
(6)某小组为测定绿矾产品的纯度,取12 g绿矾产品溶于稀硫酸配成100 mL溶液,取25.00 mL用0.1000 mol/L ;溶液滴定,平行滴定三组数据如下:
;溶液滴定,平行滴定三组数据如下:
①达到滴定终点时的实验现象是___________ 。
②绿矾产品的纯度为___________ %(保留小数点后2位)。
 ,含少量铁的氧化物等)采用混合硫酸法制备
,含少量铁的氧化物等)采用混合硫酸法制备 ,该工艺适用于高品钛。具体流程如下:
,该工艺适用于高品钛。具体流程如下:
已知:①六氯钛酸钾是一种无机物,化学式
 ,可溶于热水,微溶于冷水。
,可溶于热水,微溶于冷水。②

③当离子浓度小于10⁻⁵mol/L时视为沉淀完全。
 与氧气反应产物含钛物质含量随温度变化如图所示。
与氧气反应产物含钛物质含量随温度变化如图所示。
请回答:
(1)为提高酸解率,可以采用的措施有
(2)向
 溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得
溶液中加入KCl、HCl充分反应后,通过一系列操作可以获得 晶体,请写出具体操作
晶体,请写出具体操作(3)
 晶体进行加热分解生成
晶体进行加热分解生成 和“残渣”,“残渣”是
和“残渣”,“残渣”是(4)室温下,若
 的
的 为
为 ,若要使得
,若要使得 中的
中的 完全沉淀,需调节pH到
完全沉淀,需调节pH到(5)为获取更为纯净的
 ,应控制反应温度T高于
,应控制反应温度T高于(6)某小组为测定绿矾产品的纯度,取12 g绿矾产品溶于稀硫酸配成100 mL溶液,取25.00 mL用0.1000 mol/L
 ;溶液滴定,平行滴定三组数据如下:
;溶液滴定,平行滴定三组数据如下:| 滴定次数 | 1 | 2 | 3 |
 /mL(初读数) /mL(初读数) | 0.10 | 0.33 | 3.20 |
 /mL(终读数) /mL(终读数) | 20.08 | 20.35 | 20.22 |
②绿矾产品的纯度为
您最近一年使用:0次



