名校
解题方法
1 . 下列方案设计或现象和结论均完全正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 比较CH3COONa与NaClO酸性 | 室温下,用pH试纸分别测定室温下,用pH试纸分别测定 | NaClO溶液pH较大,则酸性:CH3COOH>HClO |
| B | 探究侯氏制碱法 | 向饱和食盐水中先通入二氧化碳至饱和后,再通入过量氨气 | 溶液变浑浊,析出NaHCO3 |
| C | 比较AgCl、AgI的Ksp大小 | 向5mL0.1mol/LAgNO3溶液中先加入4滴0.1mol/LNaCl溶液,再加入4滴0.1mol/LKI溶液 | 若先产生白色沉淀,后变为黄色沉淀,则AgI的Ksp较小 |
| D | 探究Na2SO3是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入BaCl2溶液 | 若有白色沉淀产生,则样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 化学是一门以实验为基础的学科。通过分析下列实验现象,得出的结论中正确的是
| 选项 | 实验操作 | 结论 |
| A | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液,观察到溶液变红 | Fe(NO3)2样品已氧化变质 |
| B | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/LNa2S溶液,先出现白色沉淀 | 相同温度下,Ksp(ZnS)<Ksp(CuS) |
| C | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 | 淀粉已经完全水解 |
| D | 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 | AlO2-结合氢离子的能力比碳酸根强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-03-18更新
|
1995次组卷
|
4卷引用:【省级联考】四省名校2019届高三下学期第三次大联考理科综合化学试题
【省级联考】四省名校2019届高三下学期第三次大联考理科综合化学试题【懂做原理题】2020届高三化学选修4二轮专题练——沉淀溶解平衡【精编25题】2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡及其影响因素【精编24题】(已下线)第3章 金属及其化合物 单元测试(测)——2020年高考化学一轮复习讲练测
解题方法
3 . 软锰矿是一种常见的锰矿物,主要成分是MnO2,常含有铁、铝元素形成的杂质。工业上,用软锰矿制取高锰酸钾的流程如下(部分条件和产物省略):
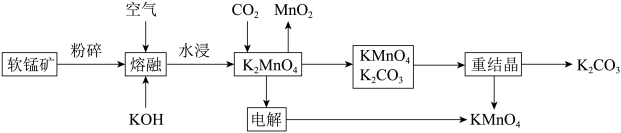
请回答下列问题:
(1)Mn的价层电子排布式为_______ ;杂质中的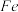 元素在元素周期表中的位置为
元素在元素周期表中的位置为_______ 。
(2)CO2与K2MnO4反应的离子方程式为_______ 。
(3)KMnO4与K2CO3能用重结晶(冷却结晶)的方法分离的原理是_______ 。
(4)“电解”过程中使用的是惰性电极,则:
①阴极附近溶液的pH将_______ (填“增大”“减小”或“不变”)。
②工业上可用石墨为电极电解硫酸锰和硫酸的混合溶液制备MnO2,其阳极的电极反应式为_______ 。
(5)可用过氧化氢溶液滴定的方法测定高锰酸钾样品纯度。当达到滴定终点时,溶液中产生的现象为_______ 。
(6)常温下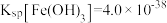 ,
, 。常温下,若某溶液中,
。常温下,若某溶液中, ,
, ,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=_______ mol/L。

请回答下列问题:
(1)Mn的价层电子排布式为
 元素在元素周期表中的位置为
元素在元素周期表中的位置为(2)CO2与K2MnO4反应的离子方程式为
(3)KMnO4与K2CO3能用重结晶(冷却结晶)的方法分离的原理是
(4)“电解”过程中使用的是惰性电极,则:
①阴极附近溶液的pH将
②工业上可用石墨为电极电解硫酸锰和硫酸的混合溶液制备MnO2,其阳极的电极反应式为
(5)可用过氧化氢溶液滴定的方法测定高锰酸钾样品纯度。当达到滴定终点时,溶液中产生的现象为
(6)常温下
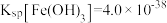 ,
, 。常温下,若某溶液中,
。常温下,若某溶液中, ,
, ,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
,向其中逐滴加入稀氨水,若Mn2+开始沉淀时,c(Fe3+)=
您最近一年使用:0次
名校
解题方法
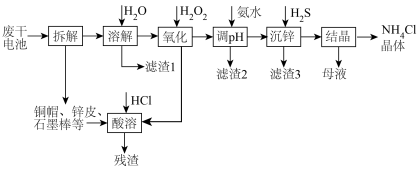
4 . 下图是一种处理废锌锰干电池的流程,电池内除铜帽、锌皮(含少量铁)、石墨棒外,还含有MnOOH、ZnCl2、NH4Cl、C及有机物等糊状填充物。
回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有_______ ;(写一条即可)
(2)将“滤渣1”灼烧有 生成,产生
生成,产生 的化学方程式为
的化学方程式为_______ ;
(3)“氧化”过程中,还原产物是_______ ;
(4)“滤渣2”的主要成分是_______ ;
(5)“调pH”时,应控制溶液pH的范围是_______ ;(已知:“溶解”后的溶液中c(Zn2+)=0.10mol/L,忽略滴加 、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
(6)写出“沉锌”的离子方程式________ ;
(7)测定NH4Cl晶体中的氮元素含量:准确称取样品0.100g放至锥形瓶中,加适量的水完全溶解,再加5mL中性甲醛溶液(足量),摇匀,静置,用0.100mol/L的NaOH标准溶液平行滴定三次,消耗标准溶液的平均体积为18.50mL,则样品中氮元素的质量分数为_______ 。
[已知:4 +6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
+6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]

回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有
(2)将“滤渣1”灼烧有
 生成,产生
生成,产生 的化学方程式为
的化学方程式为(3)“氧化”过程中,还原产物是
(4)“滤渣2”的主要成分是
(5)“调pH”时,应控制溶液pH的范围是
 、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)(6)写出“沉锌”的离子方程式
(7)测定NH4Cl晶体中的氮元素含量:准确称取样品0.100g放至锥形瓶中,加适量的水完全溶解,再加5mL中性甲醛溶液(足量),摇匀,静置,用0.100mol/L的NaOH标准溶液平行滴定三次,消耗标准溶液的平均体积为18.50mL,则样品中氮元素的质量分数为
[已知:4
 +6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
+6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
您最近一年使用:0次
2022-05-07更新
|
323次组卷
|
2卷引用:湖南省株洲市醴陵市第一中学2023届高三月考(五)化学试题
名校
解题方法
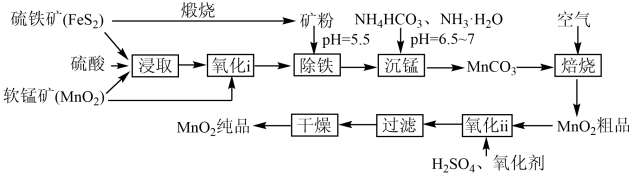
5 . 一种制取电池级二氧化锰的工艺流程如下图:
回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式_______ 。
(2)“氧化ⅰ”过程软锰矿的作用是_______ 。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是_______ (填标号)。
a. b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得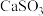 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则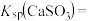
_______ (保留三位有效数字)[已知:室温下亚硫酸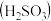 的电离平衡常数
的电离平衡常数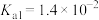 ,
,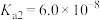 ]
]
(4)“沉锰”过程 转化为
转化为 的离子方程式为
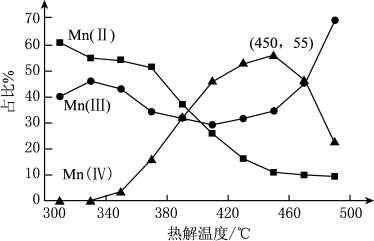
的离子方程式为_______ 。在一定空气流速下,相同时间内“焙烧” ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①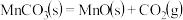
②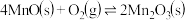

③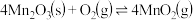

为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是_______ (答出两条)。将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为: ,放电时正极的电极反应式为
,放电时正极的电极反应式为_______ 。
(5)用氧化还原法测定 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用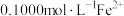 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为_______ (保留3位有效数字)。

回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式
(2)“氧化ⅰ”过程软锰矿的作用是
a.
 b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得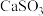 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则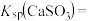
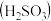 的电离平衡常数
的电离平衡常数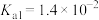 ,
,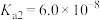 ]
](4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为 ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①
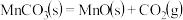
②
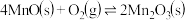

③
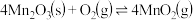

为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是 ,放电时正极的电极反应式为
,放电时正极的电极反应式为(5)用氧化还原法测定
 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用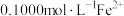 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2022-04-29更新
|
1214次组卷
|
4卷引用:湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题山东省济宁市2022届高三第二次模拟考试化学试题湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题
名校
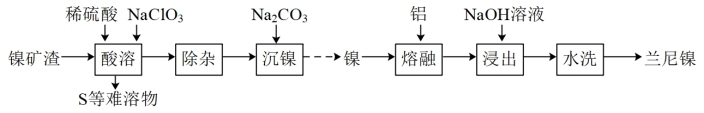
6 . 兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣[主要含 、
、 ,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知: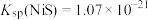 ,
,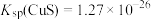
(1)“酸溶”过程中, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)“除杂”过程中加入 除去
除去 发生的反应是:
发生的反应是: ,该反应的平衡常数
,该反应的平衡常数
_______ 。
(3)“沉镍”所得沉淀有多种组成,可表示为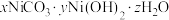 。为测定其组成,进行下列实验:称取干燥沉淀样品
。为测定其组成,进行下列实验:称取干燥沉淀样品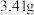 ,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(
,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(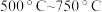 条件下加热,收集到的气体产物只有一种,
条件下加热,收集到的气体产物只有一种,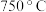 以上残留固体为
以上残留固体为 )。通过计算确定该样品的化学式。(写出计算过程)
)。通过计算确定该样品的化学式。(写出计算过程)_______
(4)“浸出”是制备兰尼镍的关键步骤, 溶液在“浸出”过程中的作用是
溶液在“浸出”过程中的作用是_______ 。
(5)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是_______ 。
 、
、 ,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知:
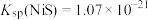 ,
,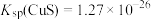
(1)“酸溶”过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(2)“除杂”过程中加入
 除去
除去 发生的反应是:
发生的反应是: ,该反应的平衡常数
,该反应的平衡常数
(3)“沉镍”所得沉淀有多种组成,可表示为
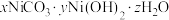 。为测定其组成,进行下列实验:称取干燥沉淀样品
。为测定其组成,进行下列实验:称取干燥沉淀样品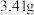 ,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(
,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(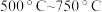 条件下加热,收集到的气体产物只有一种,
条件下加热,收集到的气体产物只有一种,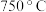 以上残留固体为
以上残留固体为 )。通过计算确定该样品的化学式。(写出计算过程)
)。通过计算确定该样品的化学式。(写出计算过程)
(4)“浸出”是制备兰尼镍的关键步骤,
 溶液在“浸出”过程中的作用是
溶液在“浸出”过程中的作用是(5)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是
您最近一年使用:0次
2022-04-22更新
|
2268次组卷
|
14卷引用:湖南省桂东县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省桂东县第一中学2021-2022学年高三下学期期中考试化学试题湖南省邵东市第三中学2021-2022学年高三下学期5月月考化学试题江苏省百校大联考2021-2022学年高三下学期第四次考试化学试题(已下线)化学-2022年高考押题预测卷02(江苏卷)江苏省盐城市阜宁县东沟中学2021-2022学年高三下学期第四次综合训练化学试题江苏省扬州中学2021-2022学年高二下学期6月月考化学试题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题江苏省南通市通州区金沙中学2021-2022学年高二下学期5月线上教学质量检测考试化学试题江苏省徐州市第七中学2022-2023学年高三上学期10月学情调研化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题第二部分 热点专项突破——解题能力稳提升 专项1 物质制备类的工艺流程 热点1 以矿物为载体的工艺流程(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
解题方法
7 . 某酸性FeSO3溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2,过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
(1)用硫酸亚铁晶体配制FeSO4溶液时还需加入的物质是__________ ;
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为__________;
(3)通入H2S气体至饱和的目的是__________ ;用硫酸酸化至pH=2的目的是__________ ;
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值。
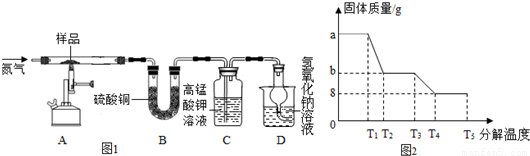
①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有__________ ;
②实验中要持续通入氮气,否则测出的x会__________ (填“偏大”、“偏小”或“不变”);
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液;
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为__________ 。
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为__________;
| A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液 |
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值。

①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有
②实验中要持续通入氮气,否则测出的x会
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液;
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为
您最近一年使用:0次



